蓝莓采后病原真菌的分离鉴定及抑制研究
2020-10-20葛达娥图尔荪阿依·图尔贡魏照辉潘玥王帆周剑忠刘小莉
葛达娥 图尔荪阿依·图尔贡 魏照辉 潘玥 王帆 周剑忠 刘小莉

摘要:以兔眼蓝莓(品种名为灿烂)为材料,采用组织分离法从自然腐败蓝莓中分离、纯化病原真菌,通过形态学观察及分子生物学技术进行鉴定,并考察肉桂醛、柠檬醛、牛至精油、香芹酚和丁香酚等对4种病原菌的抑制效果。结果表明,分离得到6株病原真菌,分别为1株稻黑孢霉(Nigrospora oryzae)、1株青霉属(Penicillium sp.)、3株枝孢属(Cladosporium sp.)和1株链格孢属(Alternaria sp.)真菌,经致病性试验确定链格孢霉为主要病原菌。牛至精油对4种病原真菌均具有较好的抑制效果,对链格孢霉的半最大效应浓度(EC50)为37 mg/L。
关键词:蓝莓;病原菌;分离鉴定;牛至精油;链格孢霉
中图分类号: S436.639文献标志码: A
文章编号:1002-1302(2020)18-0187-05
收稿日期:2019-11-06
基金项目:江苏省农业科技自主创新资金[编号:CX(18)2018];江苏省博士后科研资助计划(编号:2018K094C)。
作者简介:葛达娥(1994—),女,江苏淮安人,硕士研究生,主要从事食品生物技术研究。E-mail:1577118942@qq.com。
通信作者:刘小莉,博士,研究员,主要从事食品生物技术研究。E-mail:liuxljaas@hotmail.com。
蓝莓是杜鹃花科越橘属植物。果实含多种功能活性成分,具有抗癌、抗肥胖、预防退行性疾病、抗炎、保护视力和肝脏、预防心脏病、抗糖尿病、改善脑功能等功效[1]。蓝莓被国际粮农组织列为人类五大健康食品之一,具有“浆果之王”的称号[2-3]。蓝莓一般成熟于6—8月,属高温多雨季节且果皮柔嫩易受机械损伤,为微生物的入侵和生长繁殖提供了有利的条件,仅存放2~4 d就会发生腐烂变质。郭晓月等从云南澄江地区的蓝莓中分离鉴定出3株真菌,分别为枝孢菌属(Cladosporium sp.)、链格孢属(Alternaria sp.)和匍柄霉屬(Stemphylium sp.)真菌[4]。秦士维等从辽宁省的8个蓝莓品种中分离鉴定出相同的病原真菌[5]。随着蓝莓种植面积的扩大,成熟期果实积压、易腐烂、保存难等问题凸显,严重阻碍了蓝莓产业的发展。
研究发现,肉桂醛[6]、柠檬醛[7]、香芹酚[8]、丁香酚[9]、牛至精油[10]等对病原真菌有较好的抑制作用,并能诱导果蔬内防御酶和抗氧化酶活性提高,在很多品种的果蔬防腐保鲜方面具有较好的应用前景,如杨梅[8]、圣女果[11]、荔枝[12]等。本试验旨在分离和鉴定采后蓝莓中的病原真菌,并对其进行抑制试验,以期为研发蓝莓保鲜技术、延长货架期和预防微生物的危害供理论依据。
1 材料与方法
1.1 试验材料
蓝莓(品种名为灿烂,属兔眼系列),于2019年6月17日采自江苏省南京市溧水区白马镇。肉桂醛、柠檬醛、牛至精油、香芹酚和丁香酚等,均购自江西金源天然香料有限公司,用乙醇溶解并配成1 000 mg/L母液。UNIQ-10柱式真菌基因组抽提试剂盒,购自生工生物工程(上海)股份有限公司;马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖肉汤(PDB)培养基,均购自北京奥博星生物技术有限公司;GIS-3500成像仪,购自上海天能科技有限公司;TH4-200荧光倒置显微镜,购自日本Olympus公司;JY300C型电泳仪,购自北京君意东方电泳设备有限公司。
1.2 试验方法
1.2.1 病原真菌分离
病原真菌的分离鉴定参照白雪等的方法[13]。选择无机械损伤和病虫害的成熟果实,采后装入塑料包装盒中,当天运回实验室,将其在室温下放置至腐败。采用组织块分离法从腐烂蓝莓果实上分离病原菌,在无菌操作台中用刀片在蓝莓病健交界处取约30 μm×30 μm的组织块,将切取的组织块经75%乙醇消毒30 s,用无菌水漂洗3次后置于PDA培养基平板上。将平板置于28 ℃恒温箱培养3 d后,用接种针在培养出的菌落边缘挑取少量菌丝移植到另一个PDA培养基平板上培养,重复纯化至平板上只有单一菌落。
1.2.2 致病性试验
采用Lachhab等的方法[14],制备孢子悬浮液,以病原真菌的孢子悬浮液和菌丝作为接种体对蓝莓进行致病性测定。选取无机械损伤、无病害的蓝莓果实,先用75%乙醇浸泡30 s,再用无菌水冲洗4次,晾干备用。用消毒接种针在蓝莓果实上划出伤口,在伤口处分别接种孢子悬浮液和菌丝体,以无菌水作为对照。接种24 h后,每隔 1~2 d观察蓝莓伤口处病原真菌的生长情况。
1.2.3 病原真菌的鉴定
1.2.3.1 形态学鉴定
将分离纯化的菌株接种在PDA培养基平板上于28 ℃条件下培养,观察菌丝生长状况、菌落颜色和质地。通过荧光倒置显微镜观察病原真菌菌丝及孢子的形态并拍照。参照《真菌鉴定手册》及相关文献,进行初步的鉴定。
1.2.3.2 分子生物学鉴定
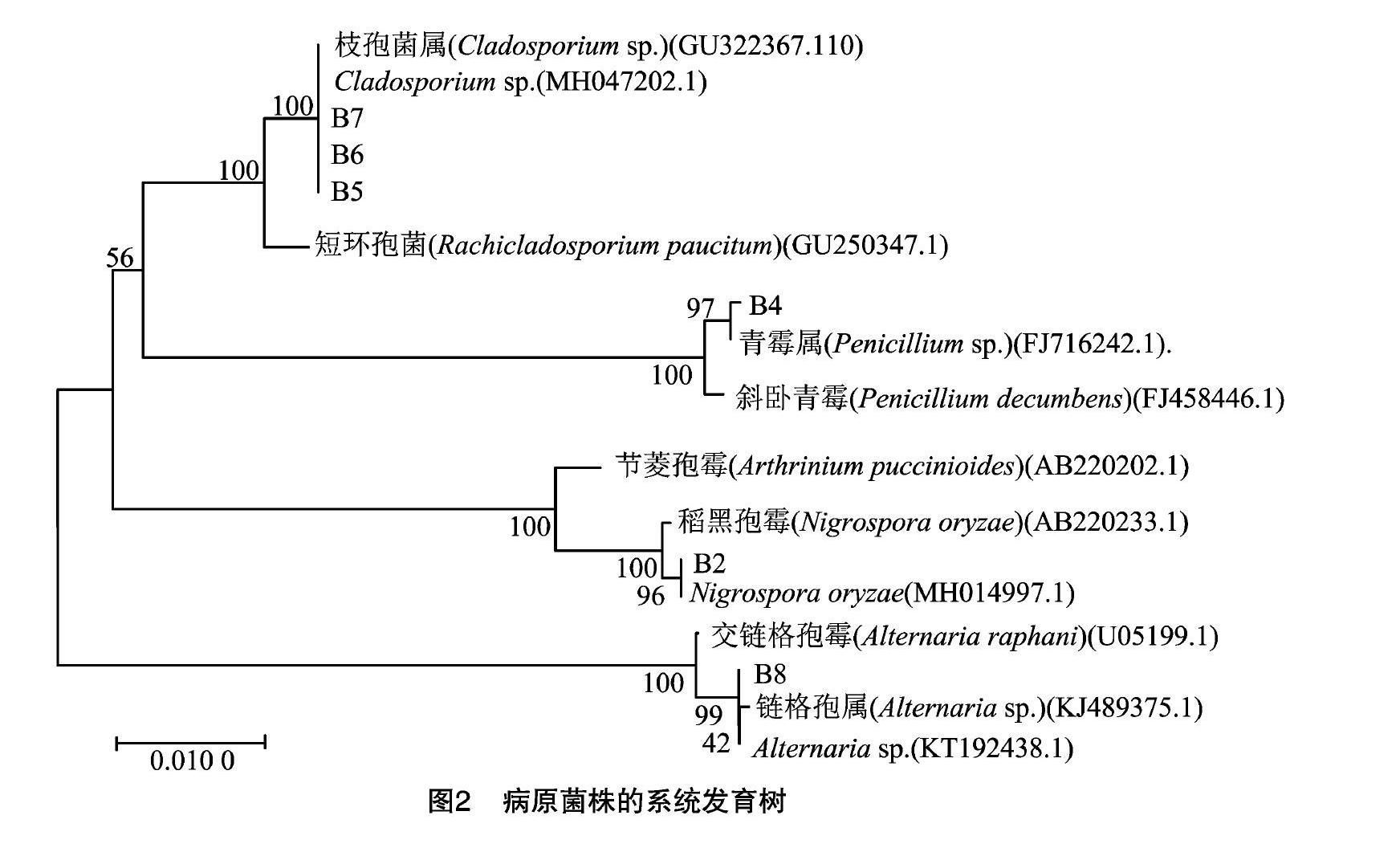
将“1.2.2”节中孢子悬浮液接入PDB液体培养基中培养24 h后收集菌体,冻干,经液氮研磨后用真菌基因组DNA提取试剂盒进行DNA提取。采用真菌扩增通用引物NS1F:5′-GTAGTCATATGCTTGTCTC-3′,NS8R:5′-TCCGCAGGTTCACCTACGGA-3′,进行18S rDNA基因的聚合酶链式反应(PCR)扩增。PCR反应体系总体积为50 μL,包括模板DNA 1.0 μL,正反向引物各2.0 μL,Premix Tap 25 μL,ddH2O 20 μL。PCR扩增条件:95 ℃预变性5 min后持续变性30 s,55 ℃ 退火30 s,72 ℃延伸 60 s,共38个循环,最后72 ℃延伸5 min。反应结束后PCR产物经过 10 000 mg/L 琼脂糖凝胶电泳检测。扩增产物由生工生物工程(上海)股份有限公司进行测序。将测序结果进行BLAST比对,根据序列同源性从高到低的次序选取模式菌株的序列,利用MEGA软件以距离矩阵法中的邻接法(neighbor-joining method,NJ法)构建系统发育树,并进行Bootstrap分析,重复次数为 1 000 次[15]。
1.2.4 不同精油对病原菌的抑制作用
1.2.4.1 生长速率法
采用生长速率法[16]测定不同精油对B2、B5和B8致病菌丝生长的影响。分别吸取2 mL肉桂醛、柠檬醛、牛至精油、香芹酚和丁香酚等的母液加入到200 mL PDA培养基中,使其终浓度为100 mg/L,混匀后倒入无菌培养皿,备用。用直径为6 mm的无菌打孔器从培养5 d的致病菌菌落边缘位置切取菌饼,将菌丝面贴在含精油的平板和对照平板中,对照平板的培养基不含精油。将培养皿置于28 ℃恒温培养箱内培养5 d后测量菌落直径,并对其结果进行统计分析。
1.2.4.2 琼脂扩散法
由于青霉无蔓延性,采用琼脂扩散法研究不同精油对B4的抑制作用。吸取 2 mL “1.2.2”节中B4的孢子液于200 mL 50 ℃的PDA培养基中,摇匀,倒入无菌平皿中,待培养基凝固后,使用直径为6 mm的无菌打孔器在抑菌平板上打孔。每孔加入80 μL 10 000 mg/L精油母液,以80 μL 95%乙醇作为对照,于28 ℃培养箱中培养 5 d 后,通过测量透明圈大小观察抑菌效果。
1.2.5 牛至精油对链格孢霉的抑菌效果
分别吸取0.4、0.8、1.2、1.6、2.0 mL的牛至精油母液于200 mL PDA培养基中,使牛至精油的终浓度分别为20、40、60、80、100 mg/L。参照“1.2.4.1”节中的方法,研究不同浓度牛至精油对链格孢霉的抑制效果。按公式(1)计算牛至精油对链格孢霉菌丝生长的抑制率,每组处理重复3次,取其平均值。将抑制率换算成概率值(y),牛至精油浓度(mg/L)换成对数值(x),建立毒力回归方程(y=ax+b),计算出牛至精油对链格孢霉的半最大效应浓度(EC50)。
生长抑制率=(对照菌落直径-6 mm)-(處理菌落直径-6 mm)对照菌落直径-6 mm×100%。(1)
1.3 数据处理
试验数据采用DPS软件整理并进行方差分析及差异显著性检验(P<0.05),用Origin Pro 8.5软件绘制图形。
2 结果与分析
2.1 病原真菌的分离与形态学观察
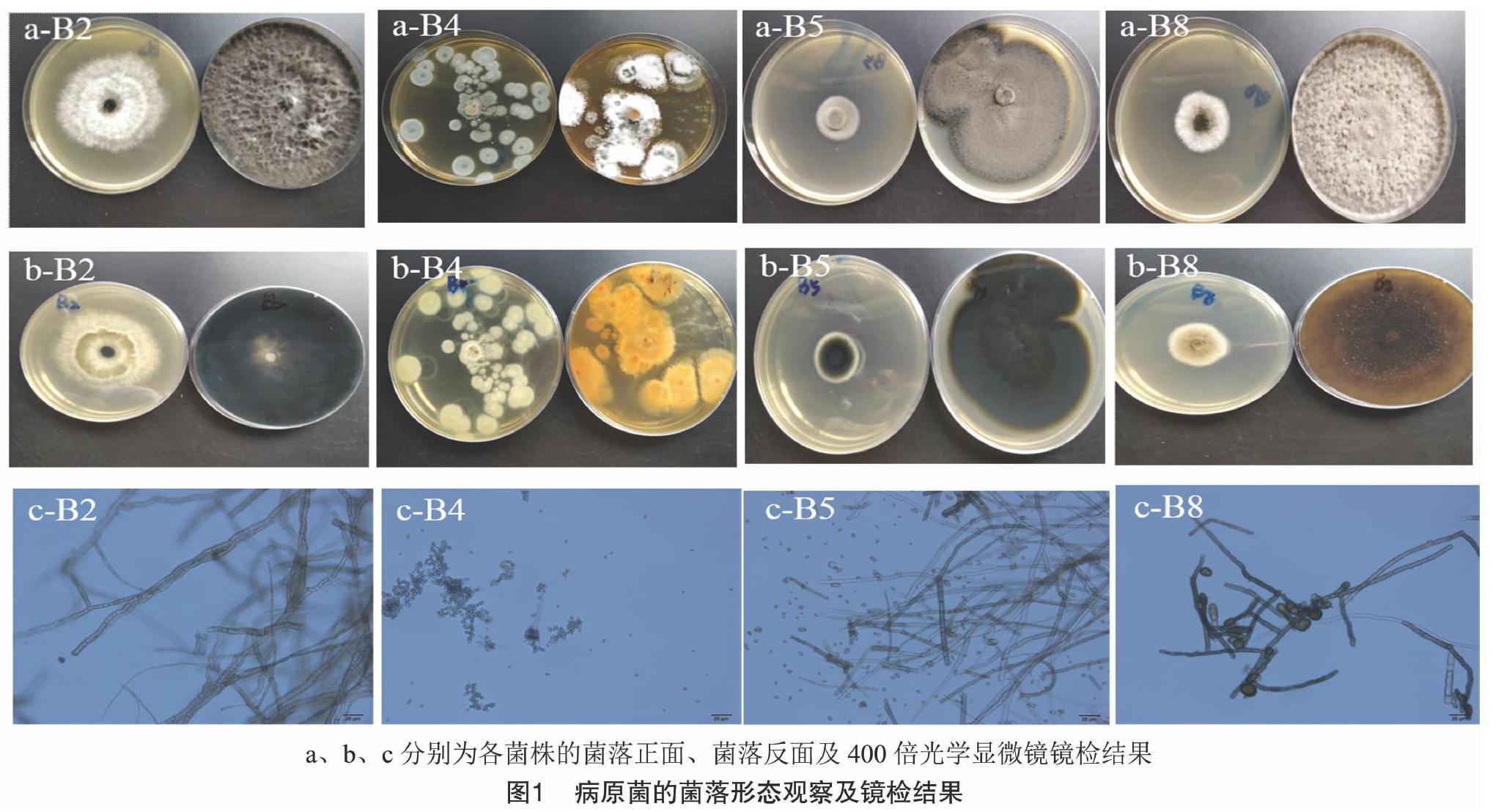
从自然腐烂的蓝莓果实上共分离出6株真菌,分别记为B2、B4、B5、B6、B7、B8。
菌株B2在PDA培养基上菌落质地疏松,初期菌丝为白色绒毛状,呈放射状扩展,后由中央起渐变成为黑色,最后菌落正反面均为黑色。病菌菌丝分隔明显,初为无色,后为黑色,分生孢子梗单生,直立,有时分枝,具隔膜。分生孢子顶生于一个无色透明的瓶状细胞上,扁球状、近球形,后变黑色(如图1中a-B2、b-B2、c-B2)。
菌株B4在PDA培养基上菌落呈绒状,圆形,基本上无气生菌丝;菌丝开始为白色,逐渐变为青绿色,菌落表面呈颗粒状,干燥;基质颜色为白色,后变为黄绿色。显微镜观察其菌丝呈扫帚状;有分生孢子梗和分生孢子,且分生孢子无色,近球形(如图1中 a-B4、b-B4、c-B4)。
菌株B5、B6、B7在PDA培养基上菌落呈绒状,绿色,基质颜色由绿色变为黑灰色;镜检观察菌丝具隔膜,孢子为卵形(如图1中a-B5、b-B5、c-B5)。
菌株B8在PDA培养基上菌丝较长,呈棉絮状,初期为灰白色,逐渐长满平皿,最终转为灰褐色至黑色。镜检显示菌丝体不分枝或分枝较少,具隔膜。孢子具有格纹,暗褐色(如图1中a-B8、b-B8、c-B8)。
2.2 分子生物学鉴定与系统发育树构建
将测序结果与GenBank上已登录的基因序列进行比对,选取相近的参考菌株,利用MEGA 7软件基于18S rDNA序列采用NJ法构建系统发育树,结果如图2所示。从系统发育树来看,B2菌株与稻黑孢霉(Nigrospora oryzae)亲缘关系较近,初步将B2菌株鉴定为Nigrospora oryzae;B4菌株与青霉属(Penicillium sp.)聚在一起,亲缘关系较近,可将其归为Penicillium sp.;B5、B6、B7菌株与枝孢属(Cladosporium sp.)在亲缘关系上最近,将B5、B6、B7菌株在分类学地位上归于Cladosporium sp.;B8菌株与链格孢属(Alternaria sp.)的遗传距离最近,因此,将其分别归为Alternaria sp.。结合传统形态学特征,综合鉴定结果为B2菌株为稻黑孢霉,B4菌株为青霉,B5、B6、B7菌株为枝孢霉,B8菌株为链格孢霉。
2.3 菌株的致病性检测
B2菌株接种在蓝莓果实放置2 d后长出细长的白色菌丝,之后在果皮表面迅速扩展,存放至第7天时,菌丝颜色变深至深褐色。菌株B4导致蓝莓出现凹陷症状,后长出白色散点状菌落,继续培养菌落变为绿色。菌株B5、B6、B7侵染蓝莓果实后,在蓝莓伤口处长出绿色菌丝,继续放置,菌丝颜色加深但未扩展出伤口以外区域。菌株B8从蓝莓伤口处长出白色菌丝,继续放置5 d后,菌丝变成灰褐色且铺满蓝莓表面。经与原始自然腐败蓝莓上菌落的形态与颜色(图3-A)进行对比,初步断定B8菌株是导致蓝莓腐烂的主要病原菌。
2.4 精油的筛选
根据菌株鉴定结果,B5、B6、B7菌株均为枝孢属真菌,选择B5菌株作为枝孢属真菌的代表进行后续研究。由图4可知,通过显著性分析(P<005)发现肉桂醛、柠檬醛、牛至精油、丁香酚和香芹酚等对B2、B4、B5、B8菌株的生长均有一定的抑制作用,且4种病原菌对不同精油的敏感度不同。通过比较菌落直径发现,相同浓度的精油对B2、B5、B8菌株具有较好抑制作用的是牛至精油和香芹酚,透明圈大小显示B4菌株对肉桂醛和牛至精油均敏感,因此选择牛至精油作为抑菌剂并研究其对优势病原菌的抑制效果。
2.5 牛至精油对链格孢霉菌丝生长的抑制作用
由表1可以看出,牛至精油对链格孢霉具有一定的抑制效果,随着牛至精油浓度的提高抑制效果逐渐增强。在较低浓度下,即牛至精油浓度为 20 mg/L 时,就有明显抑制作用;当浓度为100 mg/L时,菌落延伸量为0。通过计算各处理组的菌丝抑制率,建立毒力回归方程为y=4.609 3x+15.789 3(r2=0.998 4),根据方程计算出牛至精油对链格孢霉的半最大效应浓度(EC50)为37 mg/L。
3 讨论与结论
随着蓝莓种植生产面积的扩大,蓝莓采后真菌病害引起的蓝莓品质下降及货架期缩短问题显得越来越严重。研究蓝莓病害首先就要进行病原菌的分离鉴定,传统形态学和分子生物技术对病原菌进行鉴定已经成为常用且准确可靠的手段。本研究根据分离出的6个菌株的形态和18S rDNA序列的分析结果,将分离得到的菌株B2、B4、B8分别确定为黑孢属、青霉属和链格孢属真菌,B5、B6、B7确定为枝孢属真菌。经致病性检测,链格孢霉为主要病原菌。据报道,王晓等在枸杞采后贮藏过程中分离鉴定出链格孢霉[16]。吕禾等也在晚熟桃采后贮藏过程中分离鉴定出链格孢霉[17]。霉菌侵染果实后,不仅对果实外观及品质产生一定的影响,甚至还能产生毒素,危害到人体的健康,所以有效控制链格孢霉侵染采后果蔬至关重要。由于链格孢霉菌具有寄生和腐生性的特点,在-2~0 ℃条件下也能够生存,通常使用的低温贮藏、气调保鲜等物理手段不能彻底杜绝采前及采后蓝莓表面链格孢霉菌对果实的侵害。本试验以不同精油处理4株病原菌,结果表明,牛至精油对其均具有较好的抑制作用,当浓度为100 mg/L时,能完全抑制链格孢霉菌丝的生长,其EC50为37 mg/L。余兴等以500 μL/L萱衣草精油、薄荷精油和葡萄籽精油直接作用于链格孢霉,其抑制率分别为90.18%、87.09%、20%[18],说明牛至精油在抑制链格孢霉生长方面作用明显,可以作为一种有效的蓝莓采后防腐保鲜剂,具有较大的商业应用前景。
参考文献:
[1]Ma L Y,Sun Z H,Zeng Y W,et al. Molecular mechanism and health role of functional ingredients in blueberry for chronic disease in human beings[J]. International Journal of Molecular Sciences,2018,19(9):2785.
[2]趙金海,王 雷,黄国庆,等. 蓝莓的营养成分测定及保健功能研究[J]. 黑龙江科学,2018,9(9):50-51.
[3]袁晓晶. 蓝莓新品种对比试验报告[J]. 河南农业,2017(28):18.
[4]郭晓月,丁雅迪,邓 佳,等. 蓝莓贮藏期病原真菌的分离与鉴定[J]. 北方园艺,2015(24):104-108.
[5]秦士维,夏秀英,安利佳. 蓝莓果实潜伏侵染病原真菌的分离与鉴定[J]. 北方园艺,2017(18):41-48.
[6]Gabriel K T,Leila K,Sidney A C,et al. Antimicrobial activity of essential oils against the fungal pathogens Ascosphaera apis and Pseudogymnoascus destructans[J]. Mycopathologia,2018,183(6):921-934.
[7]杨滢滢,陈 明,万春鹏,等. 天然芳樟醇和柠檬醛对4种果蔬采后致病菌抑菌活性研究[J]. 生物灾害科学,2016,39(2):80-83.
[8]王双辉,罗 林,罗丽娟,等. 香芹酚和丁香酚对杨梅致病菌的抑菌作用[J]. 湖南农业科学,2017(3):63-65.
[9]Cícero C P,Medeiros E A,Pereira O L,et al. Cellulose acetate active films incorporated with oregano (Origanum vulgare) essential oil and organophilic montmorillonite clay control the growth of phytopathogenic fungi[J]. Food Packaging and Shelf Life,2016,9:69-78.
[10]Hu F,Tu X F,Thakur K,et al. Comparison of antifungal activity of essential oils from different plants against three fungi[J]. Food and Chemical Toxicology,2019,134:110821.
[11]Seyed H M,Valero D. Bioactive compounds in tomato fruit and its antioxidant activity as affected by incorporation of Aloe,eugenol,and thymol in fruit package during storage[J]. International Journal of Food Properties,2016,20(19):1-9.
[12]钟业俊,徐欣源,刘成梅,等. 茶树油、丁香酚、柠檬醛在荔枝保鲜中的应用[J]. 江西食品工业,2011(4):42-45.
[13]白 雪,姜爱丽,胡文忠,等. 采后蓝莓果实表面病原菌的分离鉴定及PCR检测[J]. 食品工业科技,2015,36(23):297-300,305.
[14]Lachhab N,Sanzani S M,Mohamed A B,et al. Effect of some protein hydrolysates against gray mould of table and wine grapes[J]. European Journal of Plant Pathology,2016,144(4):821-830.
[15]解淑慧,邵兴锋,王 可,等. 柑橘采后腐烂主要致病菌的分离鉴定及丁香精油对其抑制作用研究[J]. 果树学报,2013,30(1):134-139,181.
[16]王 晓,徐小迪,陈 勇,等. 宁夏枸杞鲜果采后病原菌的分离、鉴定及水杨酸的抑病效果研究[J]. 食品安全质量检测学报,2018,9(22):5837-5842.
[17]吕 禾,李 昀,冯丽琴,等. 晚熟桃采后锈斑处病原菌的分离与鉴定[J]. 保鲜与加工,2018,18(2):19-24.
[18]余 兴,孔庆军,任雪艳. 3种精油对水果病原菌的抑菌效果研究[J]. 食品与生物技术学报,2017,36(7):714-719.
