鸽新城疫灭活疫苗效力评价中实验鸽的筛选
2020-10-20刘云迎刁小龙陈坚屠颉何海蓉
刘云迎 刁小龙 陈坚 屠颉 何海蓉
摘要:为解决鸽新城疫灭活疫苗免疫效力评价中的标准鸽缺失问题,筛选满足要求的试验鸽。2019年3月对鸽场饲养管理和鸽群发病史情况进行调研,筛选合格鸽场;采血进行鸽新城疫抗体检测,排除高母源抗体鸽群;进一步检测鸽圆环、鸽腺病毒和鸽痘,排除感染上述易感病原鸽群;最后对选定的鸽隔离饲养一定时间,排除潜在的病原感染;采用筛选鸽进行鸽新城疫灭活苗免疫攻毒试验,验证是否满足试验的需求。通过调研,确定3家鸽场,从1月龄左右鸽群中随机选择50羽健康鸽进行检测,ND母源抗体为0~1 ∶32不等,均无鸽腺病毒感染,但有个别鸽存在圆环抗体或携带鸽痘病毒。从其中2家鸽场购回HI抗体≤1 ∶4,且无其他病原感染风险的鸽各25羽进行鸽新城疫灭活疫苗免疫攻毒试验,血清学检测结果显示,免疫组鸽免后28 d ND HI抗体在1 ∶16~1 ∶64之间,均值在1 ∶32以上;攻毒保护结果为,免疫组17/20~19/20保护,对照组均5/5发病,3~4羽死亡。通过鸽场调研初筛、新城疫HI抗体检测、鸽常见病原检测、隔离观察等步骤筛选的实验鸽可满足鸽新城疫灭活疫苗效力评价试验的要求,且结果稳定可靠。通过该研究筛选的实验鸽,满足试验需求、提高研究结果的可靠性和重复性,并在保证鸽用疫苗质量方面具有重要意义。
关键词:鸽新城疫灭活苗;效力评估;实验鸽;筛选研究
中图分类号: S858.91文献标志码: A
文章编号:1002-1302(2020)18-0177-04
收稿日期:2019-11-08
基金项目:江苏省泰州市科技支撑计划(农业)项目(编号:SNY20190069)。
作者简介:刘云迎(1988—),女,山东滨州人,硕士,兽医师,主要从事新兽药研发与应用研究。E-mail:liuyunying@xnswkj.cn。
通信作者:何海蓉,博士,高级兽医师,主要从事禽病诊断、疫苗研发与评价研究。E-mail:hehairong@xnswkj.cn。
实验动物是生物制品研发、生产和检验的重要原材料之一,实验动物的品质直接影响动物试验结果。我国是实验动物生产和使用大国,但我国自主培育的实验动物种质资源很少,标准化与社会化程度低。目前,国际上公认的陆禽类实验动物,只有无特定病原体(specific pathogen free,SPF)鸡,其他禽类如鸭、鸽、鹅等既无标准也无级别,因标准试验动物的缺失,严重限制了相关预防及治疗性产品的开发。
近几年,随着我国养鸽业的迅速发展,对鸽疾病的研究越来越多。鸽Ⅰ型副黏病毒病(Pigeon Paramyxovirus Ⅰ,PPMV-Ⅰ)俗称鸽瘟,又称鸽新城疫,是由鸽Ⅰ型副黏病毒引起的一种急性、热性、高度接触性传染病。各种品种、日龄鸽均可感染。该病流行期长,具有发病快、发病率和死亡率高的特点。病死率为30%~80%,严重时死亡率可达95%以上。近年来鸽新城疫流行病学调查显示,我国鸽群中流行的鸽新城疫病病毒均以基因Ⅵb亚型为主。目前,市场上的新城疫疫苗主要为防控鸡新城疫而开发,其与基因Ⅵb亚型的鸽新城疫病病毒遗传距离较远,且存在明顯的抗原差异性,因此经常出现免疫过的鸽场散发鸽新城疫的现象。为此,笔者所在课题组研究开发了Ⅵb亚型鸽新城疫灭活疫苗。研究早期在开展动物试验时,因无标准SPF级鸽,普通鸽个体差异较大,得出的试验数据存在偏差。因此笔者所在课题组建立了试验鸽的筛选方法。本研究筛选的实验鸽不仅可满足鸽新城疫灭活疫苗效力评价试验的要求,同时能够提高相关研究结果的可靠性和重复性,保证鸽用疫苗产品的质量。
1 材料与方法
1.1 试验材料
1.1.1 实验动物 白羽王鸽,购自江阴、如皋和高港3地某鸽场。
1.1.2 主要试剂 Ⅵb亚型鸽新城疫灭活疫苗、鸡新城疫血凝抑制试验抗原、鸽新城疫阳性血清、阴性血清和血凝抑制试验抗原、鸽腺病毒检测试剂盒和鸽痘检测试剂盒,均由笔者所在实验室制备;检验用毒鸽副黏病毒Pi/NT/2011株,由扬州大学分离、保存;鸡新城疫标准阳性血清,购自中国兽医药品监察所;鸽圆环检测试剂盒,购自上海酶联生物科技有限公司。
1.1.3 试验地点 抗体及病原检测在中崇信诺生物科技泰州有限公司研发中心实验室进行,动物试验在中崇信诺生物科技泰州有限公司实验动物房进行。
1.2 方法
1.2.1 实验鸽的筛选
1.2.1.1 初筛 对江阴鸽场、如皋鸽场及高港鸽场进行调研,实地查看鸽场饲养管理条件,同时询问鸽场发病史、疫苗免疫史及兽药使用情况。观察鸽群精神状态、采食、饮水、粪便及生长发育等是否正常。
1.2.1.2 抗体检测 从符合初筛条件的鸽群中随机抽取50羽1月龄左右的鸽,编号并采血,分离血清。因目前鸽场一般采用鸡新城疫疫苗来预防鸽副黏感染,故采用鸡新城疫血凝抑制试验抗原测定HI抗体效价,检测每只鸽的母源抗体水平。
1.2.1.3 易感病原的检测 将采集的血样按照鸽圆环病毒抗体(CV-Ab)ELISA检测试剂盒、鸽腺病毒PCR检测试剂盒和鸽痘病毒PCR检测试剂盒说明书进行检测。剔除检测结果阳性或可疑者。
1.2.1.4 隔离观察 筛选合格的鸽购回,隔离饲养至少1周,隔离期间每日观察鸽精神、采食、饮水、粪便及生长发育情况。
1.2.2 鸽新城疫灭活疫苗效力试验 取筛选的鸽25羽,20羽各胸部肌肉注射灭活疫苗0.2 mL,另5羽不免疫作为对照。接种后28日,连同对照鸽分别采血分离血清,用鸽新城疫血凝抑制试验抗原测定HI抗体效价,同时胸部肌肉注射鸽副黏病毒Pi/NT/2011株,每羽0.2 mL(含106EID50,EID50指鸡胚半数感染量)。观察14 d,记录各免疫组和对照组发病死亡情况。
2 结果与分析
2.1 阴性鸽的筛选情况
2.1.1 鸽场调研情况 经调研,江阴、如皋及高港鸽场的饲养管理条件较好,近2年内均未发生过细菌、病毒、寄生虫感染,它们的种鸽在近半年内均未接种过疫苗。
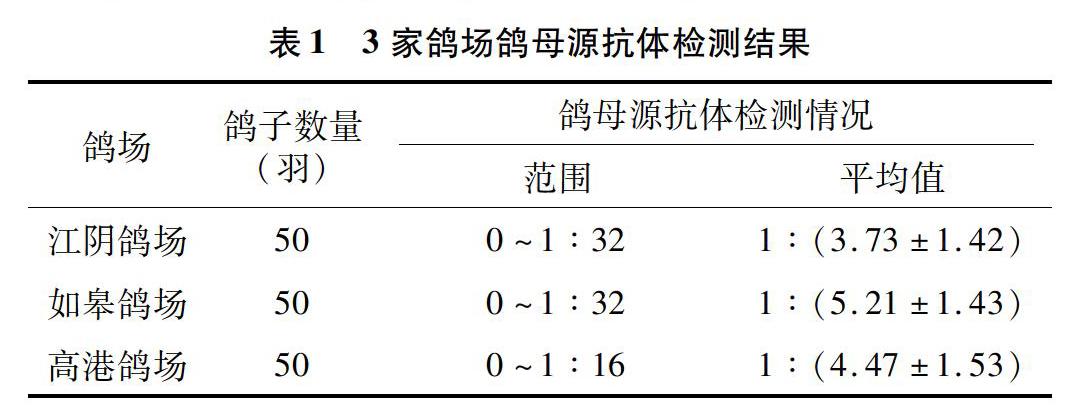
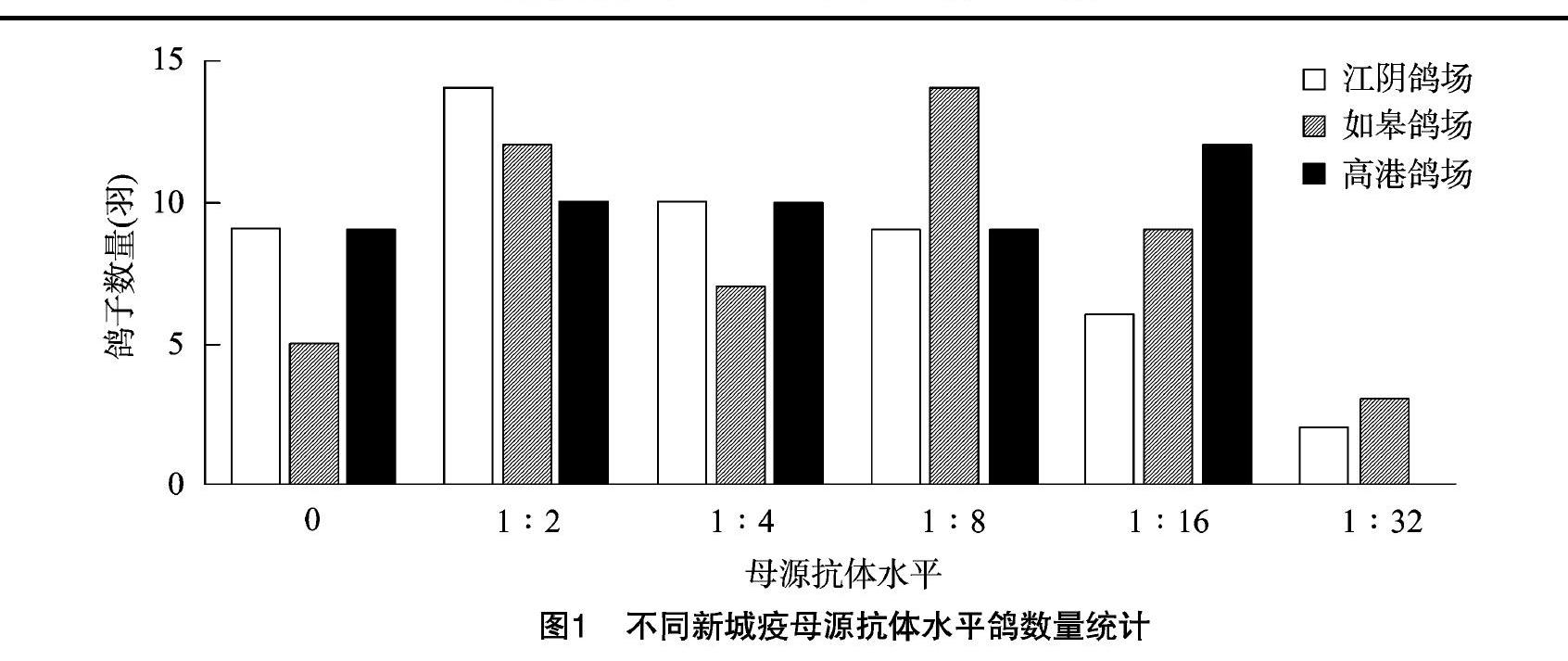
2.1.2 新城疫抗体检测结果 经检测,鸽群ND母源抗体为0~1 ∶32不等,3家鸽场HI抗体≤1 ∶4的鸽分别占比66%、48%和58%。检测结果显示,在父母代鸽同一时间免疫且产蛋时间相同的情况下,所产雏鸽的母源抗体水平仍有较大差异。不同鸽场鸽母源抗体检测情况见表1、图1。
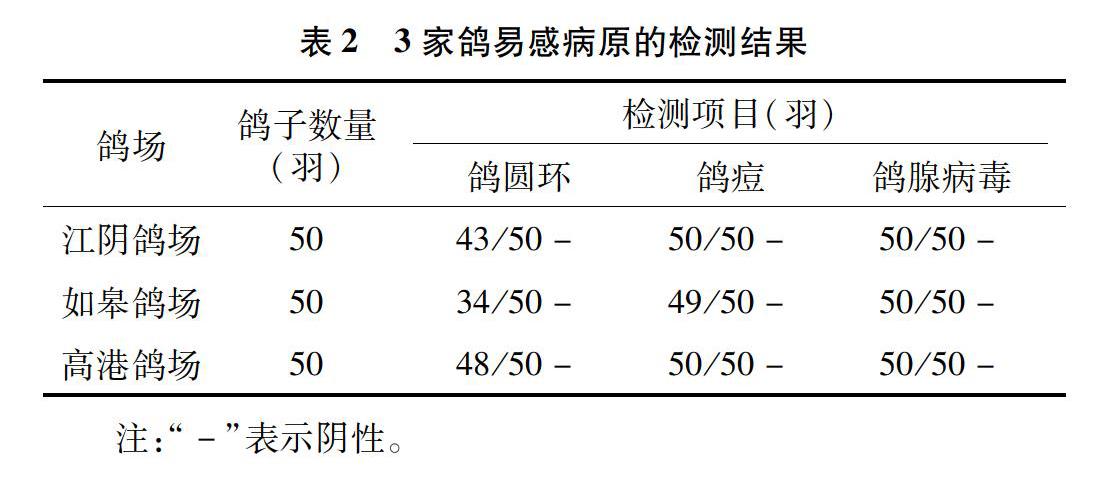
2.1.3 易感病原的检测结果 按照鸽圆环病毒抗体(CV-Ab)ELISA检测试剂盒说明书、鸽腺病毒PCR检测试剂盒说明书和鸽痘病毒PCR检测试剂盒说明书对采集的血样进行检测。结果显示,3家鸽场均无鸽腺病毒感染,个别鸽存在鸽圆环抗体或鸽痘病毒,提示可能存在鸽圆环病毒或鸽痘病毒感染。检测结果详见表2。
2.1.4 隔离观察 从江阴鸽场和高港鸽场各购回25羽HI抗体≤1 ∶4,且无其他易感病原感染的鸽,隔离观察1周。鸽精神、采食、饮水、粪便均正常。
2.2 鸽新城疫灭活疫苗效力试验结果
用筛选的不同来源鸽同时进行鸽新城疫灭活疫苗免疫攻毒试验。结果显示,免疫后28 d,免疫组各鸽新城疫HI抗体在1 ∶16~1 ∶64之间,免疫组均值在1 ∶32以上;攻毒后二免疫组各有1羽和3羽鸽出现拉稀、翅膀下垂等症状,其余免疫鸽精神、采食、饮水、粪便均正常,无拉稀、翅膀下垂、瘫痪等神经症状,17/20~19/20保护。对照组攻毒后全部发病,主要表现在羽毛蓬乱、缩颈、呆立不动、嗜睡、单侧或双侧翅膀下垂、个别瘫痪、头颈扭曲、拉黄绿色稀粪、食欲不振、个别呼吸困难。攻毒后14 d内各组3~4羽死亡。剖检肌胃内容物呈墨绿色,腺胃黏膜、肠道黏膜出血。免疫攻毒试验结果见表3。
3 结论与讨论
实验动物是生命科学领域研究的重要支撑条件,世界上生物医学研究论文有50%以上是通过动物试验获得数据。在兽用生物制品领域,实验动物的质量直接关系到兽用生物制品的产品质量和生物安全性。实验动物是一种“活的试剂和度量容器”,研发课题的确立,成果水平的高低均取决于实验动物的质量[1]。现行《中国兽药典》附录3501中对生产、检验用动物标准进行了明确规定,但未见对实验鸽的标准和要求。近年来,我国养鸽业发展迅速,规模化养殖企业不断增多,养鸽业已经成为继鸡、鸭、鹅之后的第四大禽类养殖产业,位居特禽养殖之首[2]。随着养鸽业的发展,对鸽的养殖及疾病的研究越来越多。鸽新城疫是影响养鸽业发展的重要威胁之一。近几年的流行病学调查显示,当前鸽群中新城疫流行株为Ⅵb亚型禽Ⅰ型副黏病毒,与鸡群中主要流行株的基因型不一致[3-5],试验也证明鸽新城疫与鸡新城疫存在抗原差异性[6-7],单纯使用鸡新城疫疫苗不能较好地保护鸽群免受当前鸽新城疫流行株侵袭[8]。因此,研制与当前鸽群流行株基因型一致的疫苗非常重要。目前,國内对鸽源新城疫病毒的研究主要集中在分离、鉴定、检测方法及诊断试剂盒的研发,对疫苗的研制还较少,未见相关临床批件或Ⅵb亚型鸽源新城疫疫苗注册上市。为此,笔者所在课题组以Ⅵb亚型流行株为亲本,利用反向遗传技术及平台成功构建出首个Ⅵb亚型鸽新城疫病毒致弱株,开发出鸽专用的新城疫灭活疫苗。在毒种研究、生产工艺研究及疫苗质量研究过程中,许多试验数据均需要标准实验动物来完成,但目前国内尚无SPF级鸽或标准的实验动物鸽。
笔者所在实验室在鸽新城疫灭活疫苗的研究过程中发现,鸽的品种、日龄、机体状况、饲养环境等对试验结果有很大影响。为了减少动物模型对试验结果的影响,笔者所在课题组尽可能地选择同一来源的非免鸽进行试验。但因所需试验鸽数量较多,小规模鸽场难以满足需求,大规模鸽场的鸽母源抗体水平太高。而且在试验过程中,由于饲养条件或环境的改变,鸽携带的病原会暴发,导致鸽发病或死亡,影响试验结果,浪费人力、物力、财力。在目前尚无标准实验鸽的情况下,为避免鸽体内外所携带的特定病原及母源抗体干扰,保证试验结果的可重复性,笔者所在课题组基于试验的需要,针对鸽对各种病原的易感性,建立了满足试验要求的实验鸽筛选方法。
通过对鸽场进行调研,排除半年内有寄生虫、细菌或病毒感染的鸽场,选择眼睛炯炯有神、警惕性高,且采食、饮水、粪便及生长发育等正常的鸽群作为候选鸽群。然后从1月龄鸽群中各随机选择50羽鸽编号、采血并分离血清,检测新城疫母源抗体情况,排除新城疫HI抗体高于1 ∶4的鸽子。从检测结果来看,幼鸽新城疫母源抗体水平参差不齐,HI抗体在0~1 ∶32不等,≤1 ∶4的鸽占比50%左右,这与单达聪等的研究结果[9]一致。同时对血样分别进行鸽圆环、鸽痘及鸽腺病毒的感染检测,结果显示3个鸽场均无鸽腺病毒感染,个别鸽存在鸽圆环抗体或携带鸽痘病毒,提示可能存在鸽圆环病毒或鸽痘病毒感染风险[10-12]。国内外流行病学调查结果显示,由于鸽养殖的特殊性,鸽圆环感染在鸽群中普遍存在[13]。鸽感染圆环病毒后会导致免疫器官萎缩和淋巴细胞凋亡,抑制体液免疫和细胞免疫[14],进而影响疫苗的免疫效果。因此,笔者所在课题组将抗体检测符合要求且无鸽圆环、鸽痘及鸽腺病毒感染的鸽购回,隔离观察1周,筛选精神、采食、饮水及粪便未见异常的鸽,用于鸽新城疫灭活疫苗效力试验的研究。疫苗免疫后28 d,免疫组鸽HI抗体水平均有增长,且个体差异小。免后28 d攻毒,对照组均5/5发病,3/5~4/5死亡,试验成立;免疫组17/20~19/20保护,均达质量标准,说明经初筛、新城疫抗体监测、易感病原排查、隔离饲养1周后筛选的健康鸽可满足鸽新城疫灭活疫苗效力评价试验的要求,能够真实反映疫苗的免疫效果。因此,在目前无SPF级或标准实验鸽的情况下,通过本研究对鸽进行的筛选,能够获得满足实验需求的靶动物,减少因靶动物差异对试验结果造成的不良影响,另本研究可为SPF级鸽的培育和筛选奠定基础。
参考文献:
[1]江合适. 实验动物在兽医生物制品中的应用[J]. 畜牧兽医科技信息,2018(3):6.
[2]赵宝华,邢 华,吴荣富. 鸽病诊断与防治原色图谱[M]. 北京:金盾出版社,2011.
[3]Far A R,Peighambari S M,Pourbakhsh S A,et al. Co-circulation of genetically distinct groups of avian paramyxovirus type 1 in pigeon Newcastle disease in Iran[J]. Avian Pathology,2017,46(1):36-43.
[4]羅瑶瑶,王静静,王云平,等. 2014—2017年我国部分地区10株鸽副黏病毒的分布及其分子特征[J]. 中国兽医学报,2018,38(10):1883-1886,1931.
[5]Cong X,Xu X H,Yin R F,et al. Identification and pathotypical analysis of a novel VIk sub-genotype Newcastle disease virus obtained from pigeon in China[J]. Virus Research,2017,238:1-7.
[6]赵振振. 2011—2015我国部分地区鸽源新城疫病毒分子流行病学调查及鸽新城疫疫苗VIb-I4的免疫效力试验[D]. 扬州:扬州大学,2016.
[7]Yang S,Yu P,Yang Y L,et al. The ntail region of nucleocapsid protein is associated with the pathogenicity of pigeon paramyxovirus type 1 in chickens[J]. Journal of General Virology,2019,100(6):950-957.
[8]邵洪泽,边 艳,吉凤涛,等. 鸡新城疫疫苗对鸽副黏病毒病免疫效果观察[J]. 吉林畜牧兽医,2013,34(11):10-11.
[9]单达聪,于肖寒,计 峰,等. 幼龄鸽新城疫母源抗体消长规律的研究[J]. 中国家禽,2019,41(1):65-67.
[10]Vereecken M,Herdt P D,Ducatelle R. Adenovirus infections in pigeons:a review[J]. Avian Pathology,1998,27(4):333-338.
[11]孙兴臣,熊晓妍,李敏婕,等. 1株赛鸽源鸽圆环病毒全基因克隆与序列分析[J]. 病毒学报,2017,33(5):720-727.
[12]池雪林,陈珍珍,曾显成,等. 鸽痘病毒的分离鉴定及病理组织学观察[J]. 中国兽医学报,2018,38(11):2078-2083.
[13]Stenzel T,Andrzej K. The epidemiology,molecular characterization and clinical pathology of circovirus infections in pigeons-current knowledge[J]. Veterinary Quarterly,2017,37(1):166-174.
[14]Stenzel T,Dziewulska D,S′miaek M,et al. Comparison of the immune response to vaccination with pigeon circovirus recombinant capsid protein (PiCVrCP) in pigeons uninfected and subclinically infected with PiCV[J]. PLoS One,2019,14(6):e0219175.
