稻曲病菌致病力分化与接种处理条件优化
2020-10-20徐晗闫晗褚晋缪建锟杨皓白元俊董海
徐晗 闫晗 褚晋 缪建锟 杨皓 白元俊 董海

摘要:从源于2个地区种植的辽粳401自然发病的8穗稻曲病穗的8个稻曲球中分离获得15株稻曲病菌(Ustilaginoidea virens),其中从2个稻曲球的不同部位共分离获得8株稻曲病菌。用人工注射接种法将菌株分别接种到水稻品种丰田一号(感病品种)和辽粳401(中抗品种)上。结果表明,分离的菌株致病力分化较大。不同地区种植的同一寄主品种菌株致病力有差异;同一稻曲球上分离的菌株表现出致病力差异;同一菌株接种不同水稻品种,株发病率主要与水稻抗性有关。为提高稻曲病病菌接种成功率,对接种稻曲病病菌的水稻进行不同梯度的温度和保湿时间处理。结果表明,低温处理有利于提高稻曲病病菌的接种成功率。
关键词:稻曲病菌;致病力分化;接种处理条件;真菌
中图分类号: S435.111.4+6文献标志码: A
文章编号:1002-1302(2020)18-0128-04
收稿日期:2019-10-29
基金项目:国家重点研发计划(编号:2017YFD0300709-A05)。
作者简介:徐 晗(1989—),女,辽宁本溪人,硕士,助理研究员,主要从事水稻真菌性病害病原学及防治技术研究。E-mail:xuhan1989@126.com。
通信作者:董 海,硕士,研究员,主要从事水稻病害研究。E-mail:lnsydh@163.com。
水稻稻曲病(rise false smut)是由稻绿核菌[Ustilaginoidea virens (Coole) Takahashi]侵染引起的水稻穗部真菌性病害。稻曲病的发生会造成稻穗空秕率增加,水稻产量下降;同时,稻曲球含有的稻曲菌毒素可以引起人畜病变[1]。稻曲病病害严重时,发病率高达44.1%,产量损失高达26.9%[2]。因此,控制稻曲病的发生发展,对水稻生产至关重要。
目前,学者们对稻曲病病菌的侵染过程已做了大量研究,普通观点认为,稻曲病病菌以菌核和厚垣孢子的形式在田间病残体、土壤或者其他寄主植物上越冬,翌年在合适条件下萌发侵染水稻。张震等研究推测,稻曲病病菌侵染水稻雌蕊发生在水稻开花以前,可直接从子房上获得营养形成稻曲球[3]。研究稻曲病病菌的致病力分化,有助于病害流行预测和抗病品种的选育,同时也是综合防控稻曲病的基础性工作[4]。但迄今为止,有关稻曲病病菌致病性分化的研究鲜有报道。
人工接种技术是为探索稻曲病病菌侵染过程、致病力分化、寄主的抗病机制及抗病育种等过程不可逾越的一步,目前稻曲病病菌人工接种方法还不够成熟。张君成等报道用马铃薯蔗糖培养基(potato-saccharose,简称PS)液体培养獲得的菌丝片段和分生孢子混合液于16:00—18:00注射接种抽穗破口前6~9 d的水稻,接种效果最好[5-6]。但对于接种后不同梯度的温度和保湿时间对稻曲病病菌接种发病率的影响报道较少。为此,本试验对稻曲病病菌接种不同品种后条件的处理进行比较研究,以明确接种后不同温度和保湿时间对稻曲病发生的影响。
1 材料与方法
接种试验于2019年8月5日在辽宁省农业科学院盆栽场试验基地进行,2019年9月9日调查接种结果。室内试验于2018年5月至8月在辽宁省农业科学院植物保护研究所进行。
1.1 供试材料
1.1.1 菌株
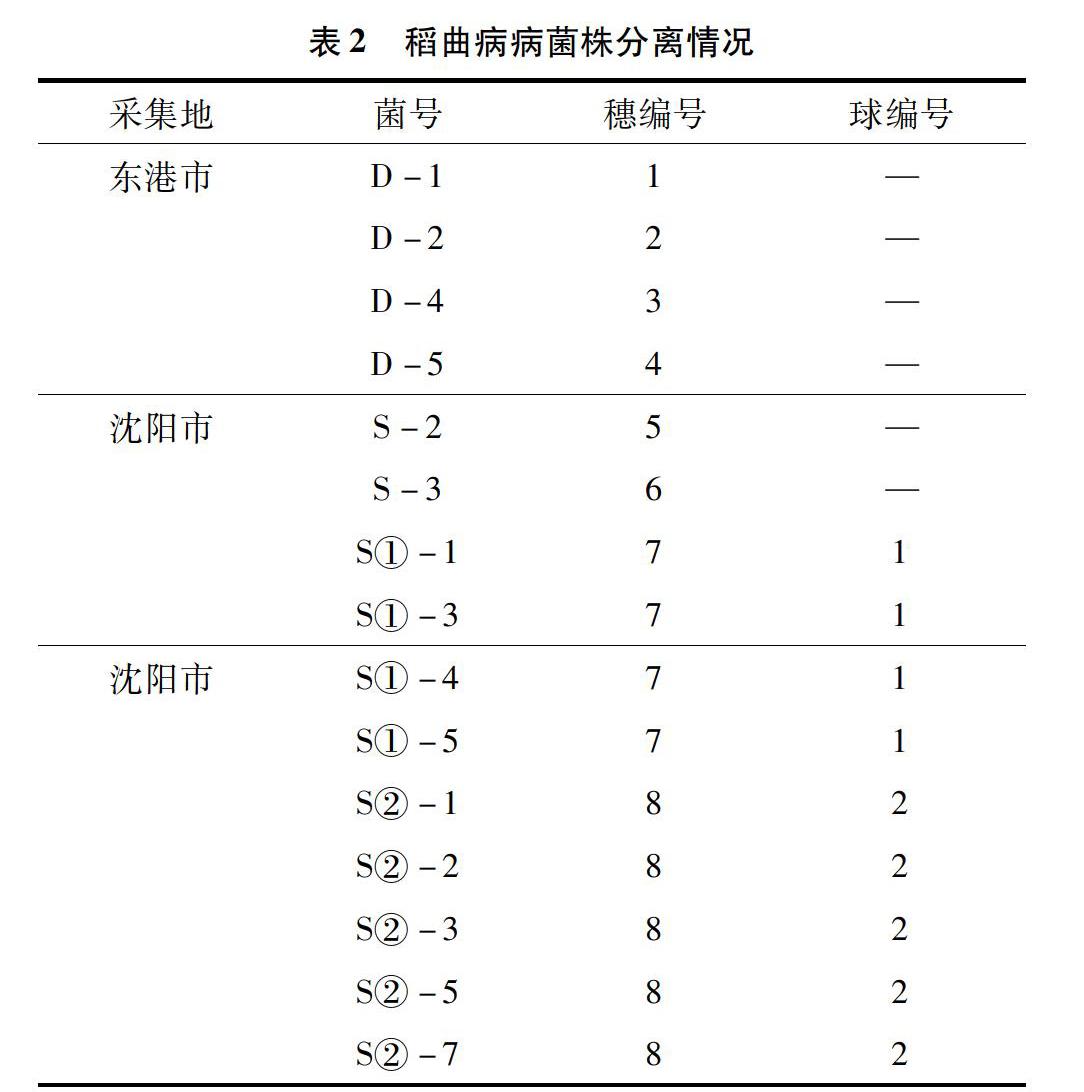
2018年采集于辽宁省沈阳与东港2个地区种植的辽粳401自然发病的稻曲病标样。
1.1.2 培养基成分
马铃薯蔗糖琼脂培养基(potato-saccharose-agar,简称PSA):200 g马铃薯、20 g蔗糖、20 g琼脂,加水至1 L。PS:200 g马铃薯、20 g 蔗糖,加水至1 L。
1.1.3 接种水稻品种
辽粳401由辽宁省水稻研究所提供。丰田一号由辽宁省盐碱地利用研究所提供。
1.2 方法
1.2.1 供试菌株的分离与培养
采用厚垣孢子悬液法,从稻曲球中分离菌株,并将上述分离菌株进行单孢纯化。提取菌株DNA,按照Zhou等方法[7]对菌株进行分子鉴定。纯化菌株在滤纸片上于 -20 ℃ 条件下保存。
1.2.2 水稻的种植和接种体的制备
水稻的种植:将水稻种子消毒后进行育苗,种植于育秧盘中。待生长到四叶期插秧于草炭土和黄土1 ∶1的盆中,每盆4点,每点2棵苗,常规栽培管理。
接种体的制备:将滤纸片上活化的稻曲病病菌移入PS培养基中,27 ℃,130 r/min振荡培养,7 d后可获得大量菌丝和薄壁分生孢子。
1.2.3 接种方法
在水稻孕穗期,即在水稻破口抽穗前7 d,用注射器将菌丝-分生孢子接种液(1×106个/mL)从侧面注入稻苞直至充满溢出(每穗1~2 mL)。每盆设无菌水注射作空白对照。每个菌株接种水稻10~20株。作温湿度处理的水稻使用混合菌株接种50株。
1.2.4 各接种条件的不同设置
接种后盆栽分别置于(15±1)、(20±1)、(25±1) ℃的人工气候室中,相对湿度为(95±5)%、光—暗为12 h—12 h交替培养。在保湿48、72、96 h后,分别将水稻移至室外继续培养。于傍晚(16:00—18:00)盆栽注射接种后,室外常规培养作为对照组。
1.2.5 病情调查统计方法
接种21 d后调查接种结果,记录水稻病穗数及每穗病粒数。参考前人研究的分级标准[8-9],结果见表1,将病级分为11级。病情指数计算公式:病情指数=∑(各级病穗数×相应的级数)/(调查总穗数×最大病级数)×100。
2 结果与分析
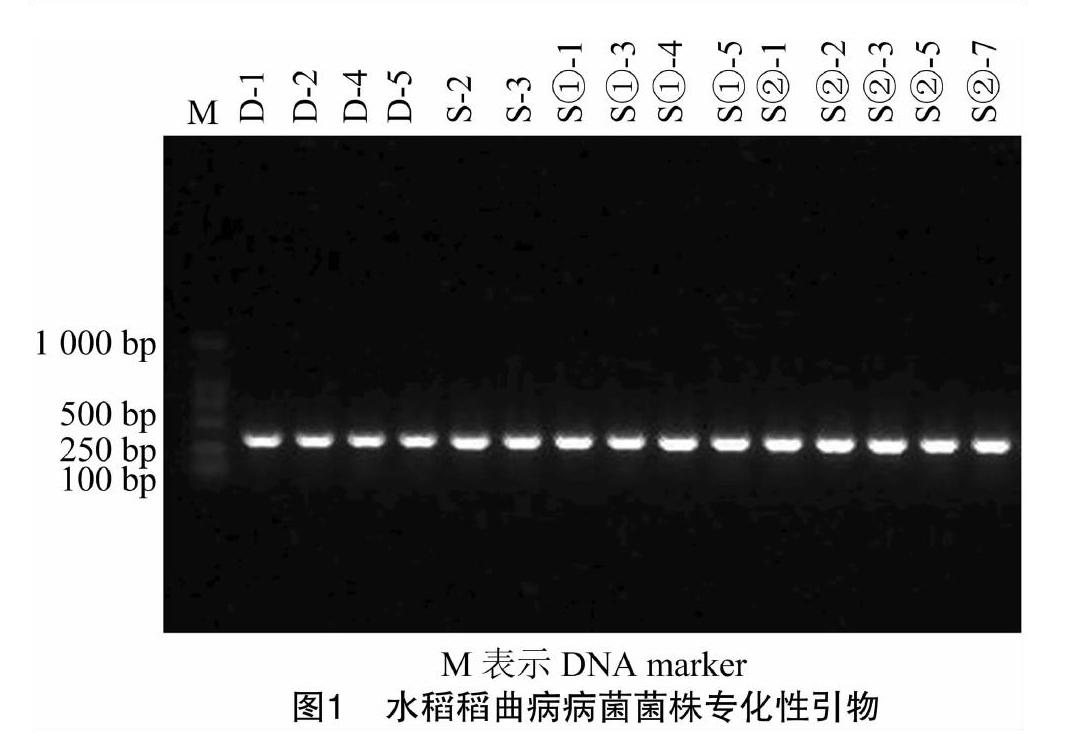
从田间采集的稻曲病标样上采用徐晗等的厚垣孢子液法[10],分离出15株稻曲病单孢菌株。其中东港市分离出4株菌株,沈阳市分离出11株菌株(表2)。沈阳市的S①-1~S①-5来源于同一稻曲球(1号球)的不同部位,S②-1~S②-7来源于另一稻曲球(2号球)的不同部位。为保证供试菌株的可靠性,对分离菌株的菌落形态、分生孢子形态等进行形状观察,发现供试菌株与笔者所在实验室保存的其他稻曲病病菌菌株相似。进一步提取分离的病原菌DNA,采用对稻曲病病菌特异的监测引物进行分子鉴定,所有分离菌株均在约380 bp处出现目的条带,以此判断分离菌株均为稻曲病菌(图1)。
2.1 不同地区种植的同一寄主品种的分离菌株致病力分析
选取2个采集地共8株菌株,接种同一水稻品种丰田一号,每个菌株注射接种20株孕穗期水稻,接种结果见表3。通过调查计算发病率和病情指数,发现不同地区种植的同一寄主品种分离的菌株致病力存在差异,东港地区菌株接种株发病率和病情指数最大值分别为45%、15,最小值分别为5%、1,平均值为20%、7;沈阳地区菌株接种株发病率和病情指数最大值分别为75%、38,最小值分别为20%、7,平均值为48%、18。表明菌株致病力分化可能与地域有很大关系。
2.2 同一稻曲球来源的不同菌株的致病力分析
选取来源于2个稻曲球的共8株菌株,分别接种同一水稻品种丰田一号,每个菌株注射接种10株孕穗期水稻,接种结果见表4。从同一稻曲球上分离的稻曲病病菌,接种水稻后仍表现出比较大的致病力差异。以从8号病穗上分离的5个稻曲病病菌为例,病情指数最大值为32,最小值为7,平均值为16。
2.3 同一菌株接种不同水稻品种的致病力分析
选取8个菌株,分别接种丰田一号和辽粳401,每个菌株注射接种孕穗期水稻,接种结果见表5,空白对照均未发病。对8个菌株的株发病率和病情指数作均值处理后,2个水稻品种的病情指数一致,但“田一号的株发病率高于辽粳401。接种菌株是从辽粳401上分离得到,而接种结果表明,菌株分离寄主接种结果并不显示出特殊性,接种结果主要与水稻抗性有关。
2.4 接种后不同温湿度条件对穗发病率与病情指数的影响
由表6可以看出,在保湿时间相同的条件下,低温处理有利于提高发病率和病情指数,提高接种成功率。而在相同温度处理下,保湿时间的延长,对接种结果影响不大。15 ℃处理组和20 ℃处理组接种结果均高于室外对照组;但25 ℃处理组接种结果与室外对照组相差不大。
3 结论与讨论
本研究利用2018年采集的稻曲病样,分离出15株单孢菌株,通过形态观察和分子特异性引物检测,确认这15株单孢菌株均为稻曲病菌株。将15株菌株进行水稻孕穗期注射接种,结果表明,不同地区种植的同一寄主品种分离出的菌株存在致病力差异,说明菌株致病力与地域有关;对来源于同一稻曲球不同部位分离菌株的接种结果发现,菌株存在较大的致病力差异;同一菌株对不同水稻品种接种结果表明,株发病率与水稻抗性有较大相关性。
已有研究报道表明,在同一个稻瘟病病斑上,存在不同类型的稻瘟病病菌小种类型,这种现象可能来源于生理小种的变异, 或是由不同菌株同时侵染造成的[11-12]。本研究表明,来源于同一稻曲球的菌株存在致病力分化,并且后期调查结果证明,菌株S②-1接种丰田一号在8月末稻曲球上有菌核产生,而S②-2~S②-7没有菌核产生;而菌株 S②-1 接种辽粳401没有产生菌核。目前菌核的产生机制尚不明确,还需大量试验研究。
稻曲病病菌的人工接種技术是深入研究稻曲病的瓶颈,因此有必要探索高效引发稻曲病的接种技术。前人已对不同接种体的接种效果和接种时间进行了深入探讨[13],注射接种孕穗期水稻,是目前比较常见的稻曲病病菌接种方法,在试验过程中,笔者也尝试用喷雾接种、棉花团蘸取菌悬液保湿处理等方法,但均未能接种成功。为提高稻曲病病菌的接种成功率,笔者对注射接种的水稻进行不同温度、不同保湿时间的处理进行探索。试验结果表明,对于注射接种的水稻进行低温处理可以提高稻曲病病菌的接种成功率。15、20 ℃温度处理组接种株成功率和病情指数要高于室外条件接种成功率,但 25 ℃ 处理接种成功率与室外对照组相差不大,甚至略低于室外对照组,这可能是因为室外对照组8月夜间温度在20 ℃左右,对于接种算是一个短暂的低温处理。接种后处理条件的改变可以导致接种结果的变化,因此接种后条件的处理也是影响稻曲病病菌接种成功率的一个重要因素。试验初步认为,低温处理有利于提高稻曲病病菌的接种成功率。
全部试验均在盆栽条件下进行,每盆注射无菌水作为空白对照,对照均未发病,因此可以认为发病是由人工接种引起的。接种后不同处理试验采用混合菌株注射接种,以排除菌株致病力差异引起的接种效果不同。
参考文献:
[1]Koiso Y,Yin L,Iwasaki S,et al. Ustiloxins,antimitotic cydic peptides from false smut balls on rice panicles caused by Ustilaginoidea virens[J]. The Journal of Antibiotics,1994,47(7):765-773.
[2]Baruah B P,Senapotu D,Ali M S. False smut:a threat to rice growers in Assam[J]. Indian Journal of Mycology and Plant Pathology,1992,22(3):274-277.
[3]张 震,叶胜海,柴荣耀,等. 基于稻曲球机构分析稻曲菌的侵染部位和侵染时期[J]. 浙江农业学报,2010,22(2):207-210.
[4]尹小乐,陈志谊,于俊杰,等. 江苏省水稻区域试验品种对稻曲病的抗性评价及稻曲病菌致病力分化研究[J]. 西南农业学报,2014,27(4):1459-1465.
[5]张君成,陈志谊,张炳欣,等. 稻曲病的接种技术研究[J]. 植物病理学报,2004,34(5):463-467.
[6]缪巧明,王永华. 水稻品种对稻曲病的抗病性鉴定技术研究[J]. 西南农业学报,1994,7(2):67.
[7]Zhou Y L. Specific and sensitive detection of the fungal pathogen Ustilaginoidea virens by nested PCR[J]. Mycosystema,2004,23(1):102-108.
[8]唐春生,高家樟,曹国平,等. 稻曲病病情分级标准的研究和应用[J]. 湖南农业大学学报(自然科学版),2000,26(2):122-125.
[9]李小娟,刘二明,肖启明,等. 水稻对稻曲病抗性的分级及相应级别的产量损失[J]. 湖南农业大学学报(自然科学版),2011,37(3):275-279.
[10]徐 晗,白元俊,缪建锟,等. 不同储存时期稻曲病菌分离方法的比较[J]. 吉林农业大学学报,2017,39(5):524-526.
[11]黄 富,涂建华. 稻瘟病菌致病性变异研究[J]. 水稻高梁科技,1997(2):26-29.
[12]周益军,程兆榜,范永坚,等. 田间水稻单个病斑中稻瘟病菌的遗传多样性[J]. 植物保护学报,2003,30(4):337-342.
[13]周永力,樊金娟,曾超珍,等. 稻曲病菌遗传多样性与群体结构的初步分析[J]. 植物病理学报,2004,34(5):442-448.
