重组菌丝霉素在毕赤酵母中的分泌表达及活性研究
2020-10-20邓赣奇陈柏东黄增颖宫莉张辉华刘燊
邓赣奇 陈柏东 黄增颖 宫莉 张辉华 刘燊
摘要:为获得一种能分泌菌丝霉素的毕赤酵母菌并探讨菌丝霉素的活性,将优化的目的蛋白碱基序列与标签MBP基因序列融合,通过双酶切将重组基因序列插入到毕赤酵母pGAPZaA表达载体上并进行连接反应。取10 μL连接产物转化至感受态细胞,挑取含Zeocin(25 mg/L)平板筛选出的单菌落进行PCR鉴定,将阳性克隆送往测序公司测序。对鉴定正确的含有重组质粒的大肠杆菌DH5α进行活化培养并提取其质粒,得到的重组质粒进一步线性化和纯化,并电转入GS115感受态细胞中筛选出阳性克隆,诱导分泌蛋白,对其进行Western blot检测、纯化、活性分析和质谱鉴定,得到的重组蛋白为55 Ku左右,浓度为700 mg/L,纯度达到80%以上。质谱鉴定结果表明,蛋白序列的覆盖率达到98%,纯化后的蛋白也对金黄色葡萄球菌具有抑制作用,成功构建出一株能够分泌菌丝霉素的毕赤酵母菌,这为菌丝霉素的工业化生产和研发新型绿色的饲料添加剂奠定了基础。
关键词:菌丝霉素;毕赤酵母;重组蛋白;饲料添加剂
中图分类号:S182;S816.7 文献标志码: A
文章编号:1002-1302(2020)18-0086-06
收稿日期:2019-11-03
基金项目:佛山市生物活性肽工程技术研究中心项目(编号:2017GA00022);广东省教育厅高校科研项目(编号:2017GCZX006)。
作者简介:邓赣奇(1995—),男,江西赣州人,硕士研究生,从事动物营养研究。E-mail:dengganqi@foxmail.com。
通信作者:刘 燊,博士,副教授,主要从事动物生物技术与动物营养研究。E-mail:shencn@aliyun.com。
抗生素自被发现以来,为人类社会做出了极大贡献,它不仅拯救了无数人的生命,更使畜牧生产得到了极大的提高。但随着抗生素的大量使用和滥用,抗生素在畜禽体内大量残留,威胁着食品安全并影响生态环境,这使得细菌产生耐药性而出现“超级细菌”。在欧洲的一些国家如瑞典,在1986年禁止向饲料中添加抗生素[1],而为响应国家绿色发展的理念,我国农业农村部兽医局局长冯忠武在2018年的中国饲料发展论坛上表示,药物饲料添加剂将在2020年全部退出[2],“减抗”“替抗”因此成为了非常热的研究方向,目前研究人员新研制出许多“减抗”“替抗”的产品,如微生态制剂、酶制剂、酸化剂、中草药制剂、抗菌肽等。抗菌肽作为绿色、高效、低毒、广谱的饲料添加剂,是现在比较热门的研究对象之一。
抗菌肽是生物体在抵抗病原菌时产生的一种防御性小肽,是组成免疫系统的重要组成成分,它对真菌、病毒、肿瘤等均有抑制作用,抗菌谱广、分子量小、不易产生耐药性、热稳定性和水溶性好,是目前替代抗生素较为理想的抗菌剂之一[3]。菌丝霉素是Mygind等从腐生子囊菌的分泌蛋白中分离得到,它是首次发现的真菌防御素,对人体不会产生危害[4]。Schneider等研究表明,菌丝霉素的作用机制主要是通过阻断细胞壁的合成而起到杀菌的作用[5]。有研究表明,菌丝霉素对革兰氏阳性菌有较强的抑制能力,没有溶血性作用,可以用来治疗感染革兰氏阳性菌的疾病,可替代部分的抗生素类药物[6-7]。传统获得菌丝霉素的方法是从天然微生物中分离提取,但这种方法分离纯化工序复杂、成本高、产量低,限制了其广泛的应用。
近年来,得益于基因工程的大力发展,通过构建高效的蛋白表达系统即可获得更多的菌丝霉素。根据万津的研究,将Ple多聚体基因克隆到毕赤酵母分泌型表达载体pPICZaA,转化后得到1株基因工程菌PPle,通过摇瓶诱导,毕赤酵母基因工程菌PPle分泌水平達143 mg/L[8]。李洪金等探讨重组NZ2114毕赤酵母工程菌的高效发酵工艺,并从培养基配方、接种条件、甲醇诱导、流加方式、菌体湿重等几个方面入手,结果发现,使用BSM培养基,接种量为15%,甲醇诱导48 h,湿重达到3×105 mg/L时,菌丝霉素的表达量是最高的且活性达到最佳状态,此时的成本也控制在可接受范围内[9]。李延的重组菌丝霉素发酵培养基优化试验表明,甘油基础盐培养基为最适发酵培养基,在发酵114 h时,上清液的总蛋白浓度可达3 941 mg/L[10]。
本试验通过重组菌丝霉素基因序列,将其克隆到毕赤酵母表达载体pGAPZaA中,构建出一种胞内表达菌丝霉素的毕赤酵母菌,再通过适当的发酵条件,分离纯化获得菌丝霉素,为其工业化生产以及重组菌丝霉素作为饲料添加剂的开发利用奠定基础。
1 材料与方法
1.1 试验菌种与质粒
毕赤酵母GS115菌用于重组载体的表达;pMAL-c5x质粒(10 ng/μL)用于扩增编码融合标签MBP的基因序列;DH5α感受态细胞;pGAPZaA载体。
1.2 试验试剂
试验主要试剂有UltraPureTM DNase/RNase-Free Distilled Water(10977015,Invitrogen)、2×Hotstart Taq PCR ProMix、2×PfuMax HiFi PCR ProMix,均购自广州英赞生物科技有限公司;凝胶纯化试剂盒、DNA纯化试剂盒、质粒提取试剂盒、胶回收试剂盒,均购自天根生化科技有限公司;10×FD buffer、10×T4 ligase buffer、10×Cutsmart Buffer、Buffer A[50 mmol/L三甲醇氨基甲烷(pH值8.0)、50 mmol/L 氯化钠、5%甘油]、洗脱缓冲液Buffer B[50 mmol/L三甲醇氨基甲烷(pH值8.0)、50 mmol/L氯化钠、500 mmol/L咪唑、5%甘油];Low Salt LB(不含抗生素)培养液;抗生素Zeocin;T4 DNA连接酶、限制性内切酶(AvrⅡ、EcoRⅠ和XbaⅠ)、DNA marker、蛋白质marker,均购自大连TaKaRa公司;YPDS培养基(10.0 g/L酵母提取物、20.0 g/L蛋白胨、20.0 g/L葡萄糖、1.0 mol/L山梨醇);LDST溶液[100 mmol/L LiAc,10 mmol/L dithiothreitol,0.6 mol/L sorbitol,10 mmol/L Tris-HCl(pH值75),现用现配不能保存];考马斯亮蓝G-250;其他试剂均为进口或国产分析纯。
1.4.6 重组菌丝霉素在毕赤酵母中的表达检测和浓度的测定 在30 ℃、250 r/min条件下分别培养0、6、12、24、48、72、96 h,用15 mL离心管取6 mL培养液,于8 000 r/min离心5 min,上清转至另一个 15 mL 离心管,不同表达时间的培养液上清经超滤浓缩、硫酸铵沉淀并复溶后进行Western blot检测。考马斯亮蓝与芳香族氨基酸在酸性介质中结合后,溶液变成蓝色,溶液的最大吸收峰从465 nm转成595 nm,因为颜色的变化程度与蛋白浓度呈正比,所以再检测595 nm处溶液中蛋白质浓度的吸光度,即可进一步得其浓度,所得重组菌丝霉素蛋白的浓度为 700 mg/L,用50 mmol/L三甲醇氨基甲烷(pH值80)、50 mmol/L氯化钠和5%甘油的缓冲液将其储存。
1.4.7 重组菌丝霉素蛋白的质谱鉴定 将纯化所得重组菌丝霉素蛋白液加入0.05 mol/L TCEP溶液,60 ℃反应1 h,还原完后,加入 55 mmol/L MMTS溶液,并在室温下避光45 min;然后将菌丝霉素蛋白液加入10 Ku超滤管中,12 000 g下离心20 min,后加入100 μL UA(8 mol/L urea,pH值8.5)溶液,12 000 g 离心20 min,并离心2次,将 100 μL 0.25 mol/L TEAB加入到超滤管中,12 000 g离心20 min,重复3次;继续加入50 μL 0.5 mol/L TEAB溶液和2%胰酶(胰酶与蛋白质量比为1 ∶50),在37 ℃下孵育12 h。次日补加1%胰酶(胰酶与蛋白质量比为1 ∶100),并在37 ℃孵育4 h,离心收集滤液,低温真空抽干。
所得样品用0.1%甲酸、2%乙腈混合液进行溶解,在13 200 r/min,4 ℃条件下离心20 min,取上清,进行质谱鉴定;做完质谱后,还需将质谱原始文件经过MM File Conversion软件处理转换,然后将所得到的数据与数据库进行比对分析。
1.4.8 重组菌丝霉素蛋白体外抑菌活性的测定 将保存在-20 ℃的大肠杆菌、沙门氏菌和金黄色葡萄球菌菌液划板活化,直至长出单菌落为止,挑取单菌落于LB液体培养基中,孵化培养12 h,用3个锥形瓶分别配制100 mL LB固体培养基,在灭完菌冷却至45 ℃时,分别吸取100 μL菌液加入到培养基中并轻轻摇均匀倒板,待板干燥后摆放好牛津杯,将提纯得到的重组菌丝霉素蛋白(700 mg/L)稀释10倍、100倍,吸取200 μL分别加入牛津杯中,空白对照则加无菌水,并做3个重复,然后放入 37 ℃ 培养箱中培养12 h,用电子游标卡尺测量抑菌圈的大小。
2 结果与分析
2.1 重组基因的验证
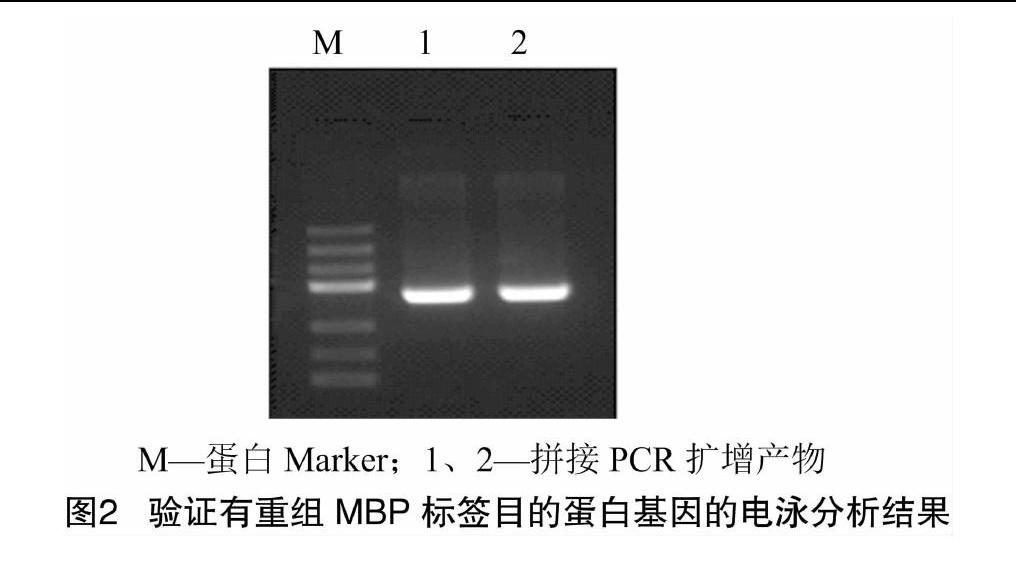
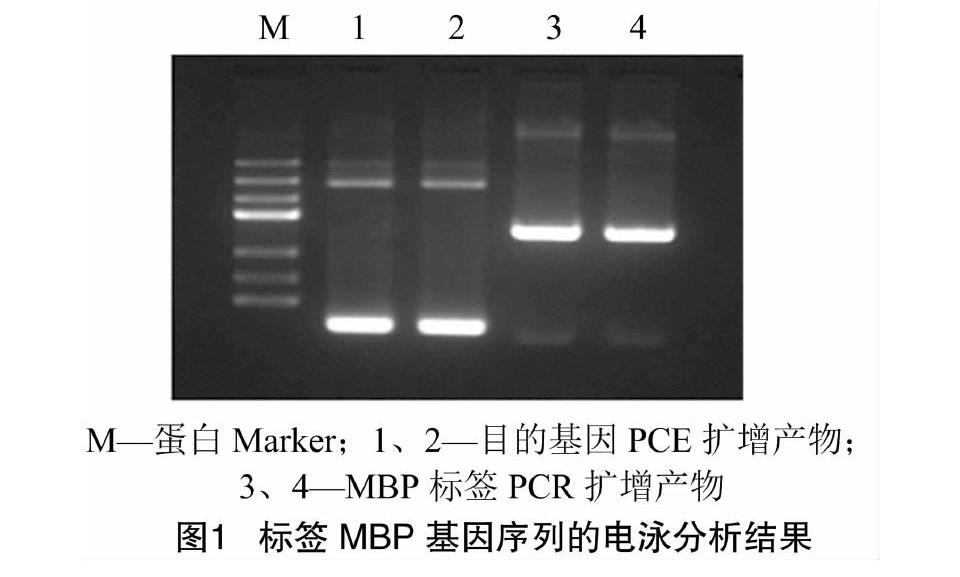
在完成标签MBP基因序列的PCR扩增编码融合,合成重组有MBP标签的目的蛋白基因序列后,分别取PCR产物进行1.0%琼脂糖电泳分析,结果(图1、图2)表明,扩增大小与理论预测相符合。
2.2 pGAPZaA-MBP表达载体的验证
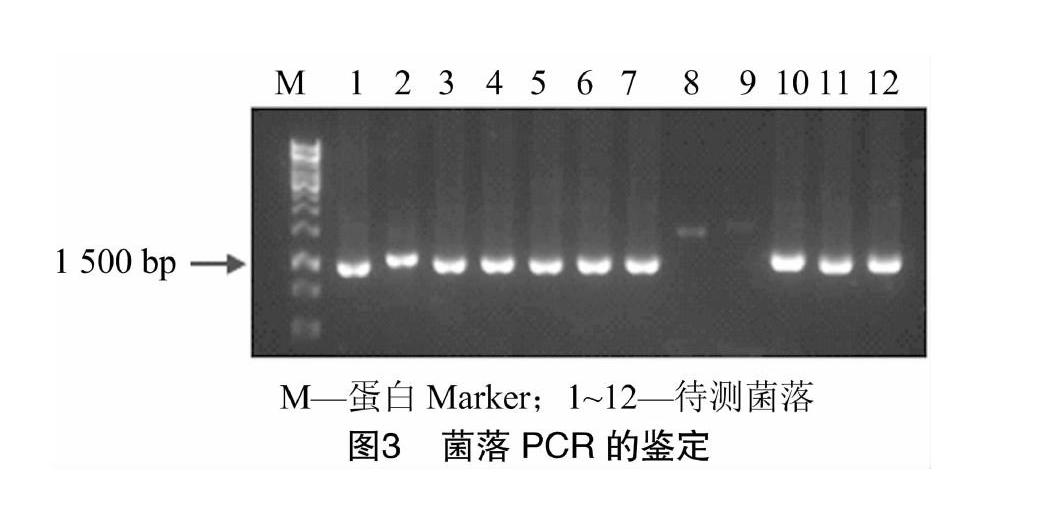
挑取12个“1.4.5”节中平板上的单菌落,分别溶到500 μL含25 μg/mL Zeocin的Low Salt LB培养液中,37 ℃、180 rpm/min振荡培养4 h,每管取 0.5 μL 菌液作模板进行PCR,后取5 μL PCR产物进行1.5%瓊脂糖电泳分析,用载体上游和下游引
物扩增的条带理论大小为1 300 bp左右,结果表明,实际扩增条带为1 500 bp,符合合理的范围内,而除第8、9号外其他均为阳性克隆菌(图3),为进一步鉴定,挑取10、11号菌进行测序,测得部分结果如图4所示,其中小写部分为N端融合标签MBP蛋白的部分基因序列,标记下划线部分为目的蛋白的基因序列即菌丝霉素的基因序列,标记方框部分为C端融合标签的基因序列,测序结果表明MBP基因克隆正确,成功构建了重组表达载体pGAPZaA-MBP。
2.3 重组菌丝霉素蛋白的纯化及在毕赤酵母中的表达检测
纯化后的重组菌丝霉素蛋白进行SDS-PAGE电泳,由图5可见,蛋白纯化后纯度在80%以上。将不同时间的培养液上清经超滤浓缩、硫酸铵沉淀并复溶后进行Western blot检测,由图6可知,带组氨酸标签的目的蛋白获得了可溶性表达,并且在 48 h 培养后目的蛋白的表达量趋于饱和,因此表达培养时间为48 h较好。
2.4 重组菌丝霉素蛋白的质谱鉴定
根据质谱的鉴定分析可得重组菌丝霉素蛋白完整的氨基酸序列,如图7所示,其中标记方框部分表示未匹配上的序列,其余部分均为匹配上的序列,将鉴定分析出的序列用MASCOT(V21,Matrix Science,London U.K)搜库软件进行比对可得蛋白序列的覆盖率达98%,则可得该蛋白即为重组菌丝霉素蛋白。
2.5 重组菌丝霉素蛋白体外抑菌活性的研究
将重组菌丝霉素蛋白(700 mg/L)稀释10、100倍后,测得其对金黄色葡萄球菌、大肠杆菌和沙门氏菌抑制效果的数据,用软件SPSS21进行数据分
析,结果(表1)表明,重组菌丝霉素对革兰氏阳性菌如金黄色葡萄球菌有抑制效果,且重组菌丝霉素的浓度越高抑制效果就越好,而重组菌丝霉素对革兰氏阴性菌如大肠杆菌、沙门氏菌的抑制效果非常的微弱,这与Mygind等的研究结果[4,8]相同。
3 讨论
防御素是机体第一道防线的组成成分,属于β折叠型抗菌肽,广泛存在于各种生物中,对真菌、细菌、病毒、肿瘤等均具有一定的抑制作用[11-12]。目前,制备防御素的途径主要有天然提取、化学合成、基因工程表达,因前2种获取方法提取工艺复杂、成本高等,基因工程表达则成为获取大量外源蛋白的主要方法[13]。毕赤酵母因为具有较为完善的基因表达调控机制、蛋白质加工修饰能力且不会产生内毒素,所以广泛用于产外源蛋白的表达系统[14-15]。
本试验提供一种获取多量重组菌丝霉素及其表达载体构建的方法,即根据目标蛋白质的氨基酸序列,对密码子优化并确定碱基序列,将含有MBP的基因序列与pGAPZaA表达载体相连接,并将重新组成的载体转入到毕赤酵母细胞中,表达出所需要的菌丝霉素,对其进行纯化得到浓度为 700 mg/L,并对金黄色葡萄球菌有一定的抑制效果。根据Zhang等研究,菌丝霉素类似物NZ2114对金黄色葡萄球菌具有较高的专一性,抗菌效果可达到与青霉素与万古霉素相当甚至更优[16],则表明重组菌丝霉素都具有对金黄色葡萄球菌较强抑制效果的趋同性。
抗菌肽被认为是最具有发展前景的绿色饲料添加剂之一,与传统抗生素相比,它具有无耐药性和对人体无毒副作用,是抗生素理想的替代品之一[17]。近年来,一些抗菌肽产品已投入到市场上销售,表明抗菌肽应用到饲料添加剂中正日渐变得广泛,根据Ma等的研究,饲料中添加重组防御素可以显著增加肉鸡的平均日增质量、降低料肉比,与空白对照组相比,血清免疫球蛋白M与免疫球蛋白G等含量都显著增高,其脂肪酶与胰蛋白酶的活性也会增高[18]。根据李延等研究表明,在基础日粮的基础上添加0.2%重组菌丝霉素可以显著提高断奶仔猪的平均日采食和平均日增质量,其回肠中食糜双歧杆菌的数量也显著增加[19];此外,菌丝霉素也具有治疗奶牛金葡菌乳腺炎的潜力[20]。
根据这些研究结果可知,重组菌丝霉素作为饲料添加剂,对肉鸡、仔猪等都具有较好的促生长效果,甚至可作为药制剂来治疗某些疾病。该研究为产多量的菌丝霉素提供了更加廉价的途径,同时也为绿色新型饲料添加剂的利用和开发奠定了基础。
参考文献:
[1]Castanon J R. History of the use of antibiotic as growth promoters in European poultry feeds[J]. Poultry Science,2007,86(11):2466-2471.
[2]許剑琴. 中兽医药——减抗替抗主力军[J]. 北方牧业,2018(20):15-16.
[3]Zanetti M. Cathelicidins,multifunctional peptides of the innate immunity[J]. Journal of Leukocyte Biology,2004,75(1):39-48.
[4]Mygind P H,Fischer R L,Schnorr K M,et al. Plectasin is a peptide antibiotic with therapeutic potential from a saprophytic fungus[J]. Nature,2005,437(761):975-980.
[5]Schneider T,Kruse T,Wimmer R,et al. Plectasin,a fungal defensin,targets the bacterial cell wall precursor lipid Ⅱ[J]. Science,2010,328(5982):1168-1172.
[6]Yang Y L,Da T,Jun Z,et al. Characterization of recombinant plectasin:solubility,antimicrobial activity and factors that affect its activity[J]. Process Biochemistry,2011,46(5):1050-1055.
[7]Jun Z,Yang Y L,Da T,et al. Expression of plectasin in Pichia pastoris and its characterization as a new antimicrobial peptide against Staphyloccocus and Streptococcus[J]. Protein Expression and Purification,2011,78(2):189-196.
[8]万 津. 菌丝霉素在毕赤酵母中的分泌表达及其对大鼠肠道健康和免疫功能的影响[D]. 雅安:四川农业大学,2015.
[9]李洪金,陈天任,孙丹丹,等. 菌丝霉素NZ2114毕赤酵母工程菌高效发酵工艺的研究[J]. 广东饲料,2016,25(1):26-29.
[10]李 延. 重组菌丝霉素抗菌肽的发酵培养基优化及其在断奶仔猪上的应用效果研究[D]. 雅安:四川农业大学,2015.
[11]Droin N,Jean-Baptiste H,Ducoroy P,et al. Human defensins as cancer biomarkers and antitumour molecules[J]. Journal of Proteomics,2009,72(6):918-927.
[12]Terras F R,Eggermont K,Kovaleva V,et al. Small cysteine-rich antifungal proteins from radish: their role in host defense[J]. Plant Cell,1995,7(5):573-588.
[13]叶 滔,杨静美,闫 凯,等. 菌丝霉素NZ2114基因在毕赤酵母中表达及中试发酵研究[J]. 饲料工业,2015,36(16):54-59.
[14]Parachin N S,Mulder K C,Viana A A B,et al. Expression systems for heterologous production of antimicrobial peptides[J]. Peptides,2012,38(2):446-456.
[15]聂金梅,李阳源,刘金山,等. 黑曲霉葡萄糖氧化酶基因改造及其在毕赤酵母中的表达[J]. 江苏农业科学,2018,46(20):17-21.
[16]Zhang Y,Teng D,Mao R Y,et al. High expression of a plectasin-derived peptide NZ2114 in Pichia pastoris and its pharmacodynamics,postantibiotic and synergy against Staphylococcus aureus[J]. Applied Microbiology and Biotechnology,2014,98(2):681-694.
[17]万 津,陈代文,余 冰,等. 重组菌丝霉素高密度发酵制备及其功效研究[J]. 农业生物技术学报,2015,23(12):1625-1631.
[18]Ma J L,Zhao L H,Sun D D,et al. Effects of dietary supplementation of recombinant plectasin on growth performance,intestinal health and innate immunity response in broilers[J]. Probiotics and Antimicrobial Proteins,2020,12(1):214-223.
[19]李 延,万 津,晨 光,等. 重组菌丝霉素发酵培养基筛选及重组菌丝霉素在断奶仔猪上的应用[J]. 动物营养学报,2016,28(1):208-216.
[20]李连彬. 菌丝霉素源抗菌肽对金黄色葡萄球菌乳腺炎的防治及其耐药产生机制的研究[D]. 杨凌:西北农林科技大学,2018.
