硫氰合铁配合物光度法测定有机溶剂的水含量*
2020-10-18白海鑫刘小花孟彦羽魏彦彦
白海鑫,刘小花,李 鑫,孟彦羽,魏彦彦
(河南农业大学理学院,河南 郑州 450002)
化工行业中经常遇到测定有机溶剂中水的含量问题,有机溶剂中的水分的多少直接影响着有机溶剂的效能,对精密的合成与分离测试有至关重要的影响。因此,有机溶剂中水含量的测定是一个非常重要且常见的分析问题。
卡尔·费休尔法是有机溶剂中水含量测定最经典的化学分析方法[1-2]。卡尔·费休尔法的当前技术已比较成熟,但任存在着反应速率慢、易受干扰、精密度差、毒性大等缺点[3]。
测定有机溶剂中水含量的方法还有气相色谱法[4]、荧光法[5]、红外光谱法[6]和传感器技术[7]等。这些方法亦各有缺限,如需较昂贵的仪器设备,环境要求高,准备时间长,无大范围应用的可能等。烘干法、共沸法[8]等在食品行中水分测定时有操作时长、精度差等问题。利用在有机溶剂中氯冉酸与水的络合反应来测定有机溶剂中水含量[9]的方法所用仪器虽简单,但其所用试剂对人有害。
本实验通过研究不同配比的硫氰合铁配合物{[Fe(SCN)n](3-n)}在含水乙醇溶剂中的吸收光谱化,建立了一种快速、简单、准确、试剂无毒害的测定有机溶剂中水含量的新方法。本工作研究了有机溶剂中的水含量与不同配位比的[Fe(SCN)n](3-n)的吸光度A之间的关系,所建方法具有成本低、重现性好、灵敏度高、简单、快速等优点。
1 实 验
1.1 主要试剂及仪器
无水氯化铁(FeCl3)、硫氰酸铵(NH4SCN)、无水乙醇(C2H5OH)、95%乙醇、及其它所用试剂均为分析纯及其以上等级的试剂。
吸收光谱及其它光度测定所用仪器为北京普析通用仪器有限责任公司的TU-1901紫外可见分光光度计,光谱扫描范围190~900 nm,石英比色皿光程为1 cm。
1.2 实验方法
实验中所用FeCl3与NH4SCN贮备液均为0.02000 mol/L的乙醇溶液,二者按不同摩尔比混合得所需的[Fe(SCN)n](3-n),再按需稀释。对[Fe(SCN)n](3-n)进行光谱扫描时,逐渐增加有机溶剂(如无水乙醇)中的含水量;时间扫描所用入射光波长为配合物的λmax。
测定时将一定量的水或含水的样品加入比色皿中与[Fe(SCN)n](3-n)的乙醇溶液混匀后,立即于分光光度计上测定。
2 结果与讨论
2.1 含水有机溶剂中[Fe(SCN)n](3-n)的吸收光谱与变色机理
研究表明,不同配位比的[Fe(SCN)n](3-n)在有机溶剂(如乙醇)中的吸光谱,均随着有机溶剂中的含水量的变化而变。以图1为例:各配位比的[Fe(SCN)n](3-n)在有机溶剂中的吸收光谱峰,均随有机溶液中水含量的增加而逐渐降低。
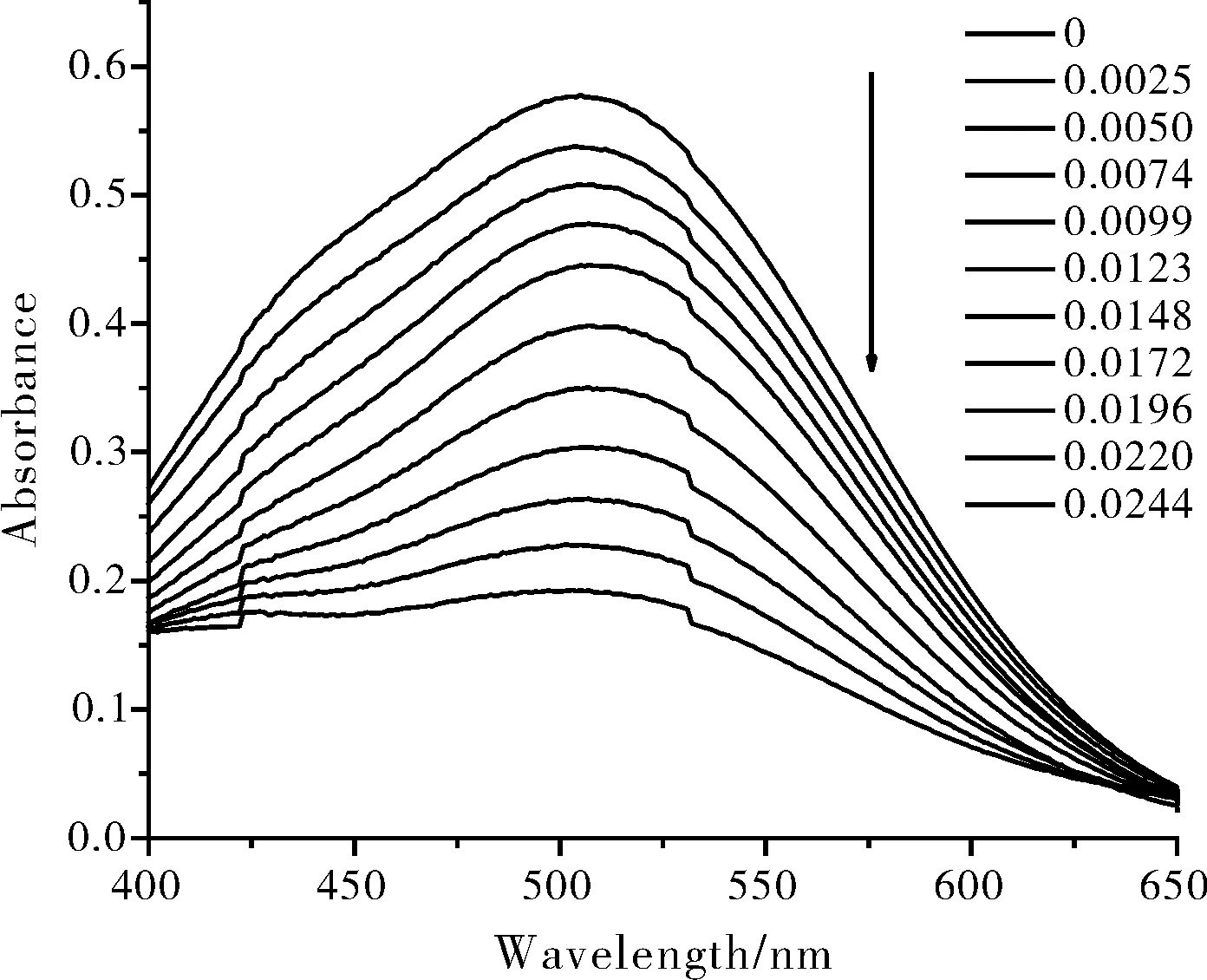
图1 FeCl3与NH4SCN摩尔比为1:3所得[Fe(SCN)n](3-n)吸收光谱随水含量的变化Fig.1 Absorption spectral changes of [Fe(SCN)n](3-n) obtained by FeCl3 and NH4SCN molar ratio of 1:3 in the presence of water
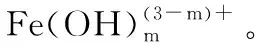
[Fe(SCN)n](3-n)=Fe3++nSCN-
(1)
(2)
SCN-+H+=HSCN
(3)
[Fe(SCN)n](3-n)在有机溶剂有化学平衡式(1);当有水加入时,发生Fe3+与H2O水解反应式(2);反应(3)的发生又促进了反应(1)与(2)化学平衡的进一步正向进行,最终导致颜色的转变:由血红色渐变到淡黄色。
2.2 反应时间对测定的影响
[Fe(SCN)n](3-n)的生成时间实验中,按一定摩尔比混合FeCl3与NH4SCN的贮备液,监测反应过程中溶液的吸光度(A)。研究表明,摩尔比(1:1)~(1:6)混合所得[Fe(SCN)n](3-n)的A与时间t的变化情况相一致。以FeCl3与NH4SCN摩尔比1:2时所得[Fe(SCN)n](3-n)的A与t扫描数据为例予以说明(图2a):当二者混合后,立即混匀2 min后,再进行时间扫描,其A值一直比较稳定。
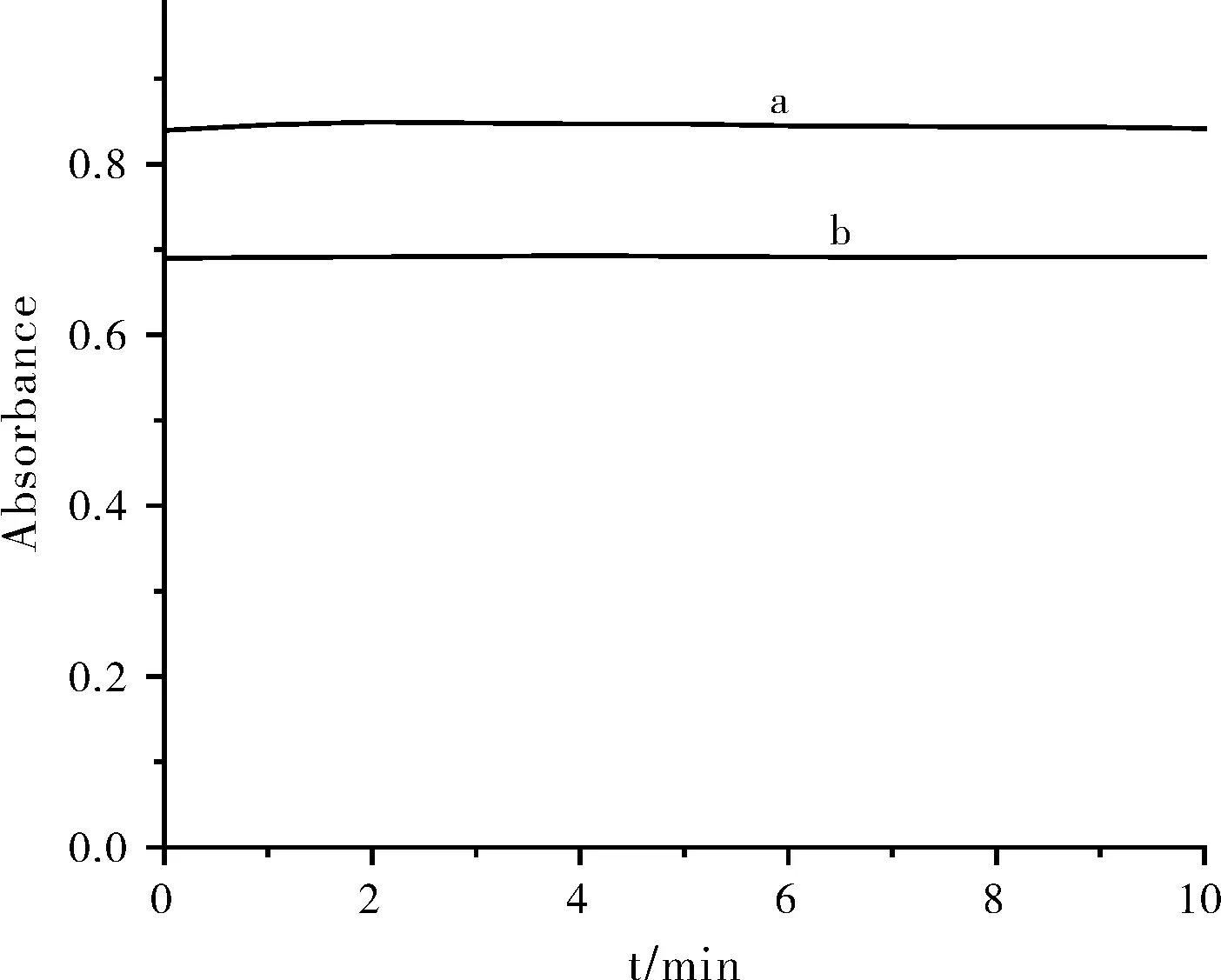
图2 [Fe(SCN)n](3-n)的吸光度与反应时间的关系曲线Fig.2 The relation plots of the absorbance of [Fe(SCN)n](3-n) and reaction time
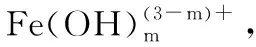
这些结果均系实验室温度下得到的。这也表明,[Fe(SCN)n](3-n)在有机溶剂中与水的反应不受实验室温度波动影响。
2.3 有机溶剂中水含量的定量分析
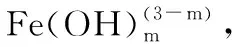
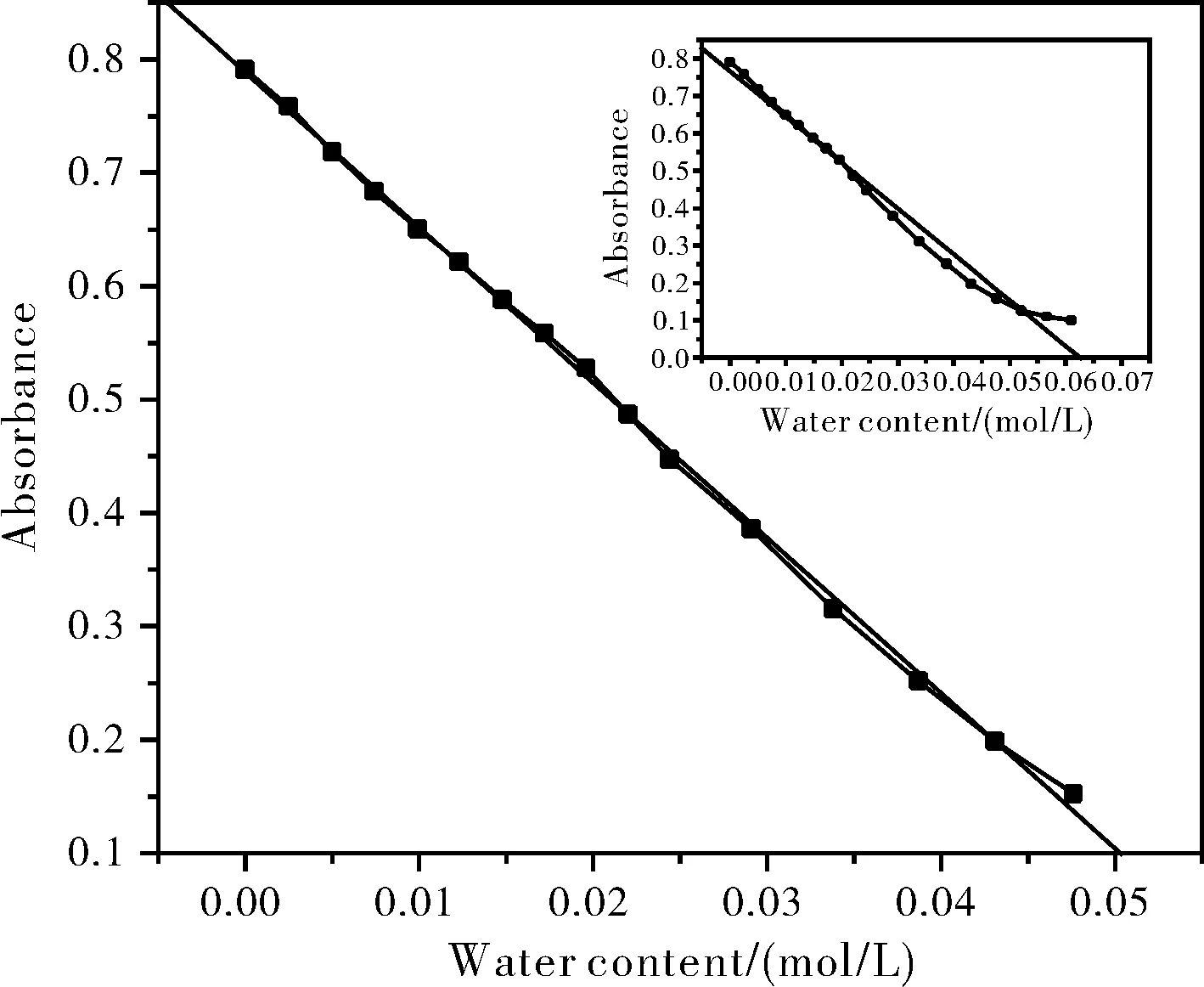
图3 FeCl3与NH4SCN摩尔比1:2时[Fe(SCN)n](3-n)在514 nm处吸光度值随水浓度变化曲线Fig.3 The plot of [Fe(SCN)n](3-n) absorbance at 514 nm with water concentration when the molar ratio of FeCl3 to NH4SCN is 1:2
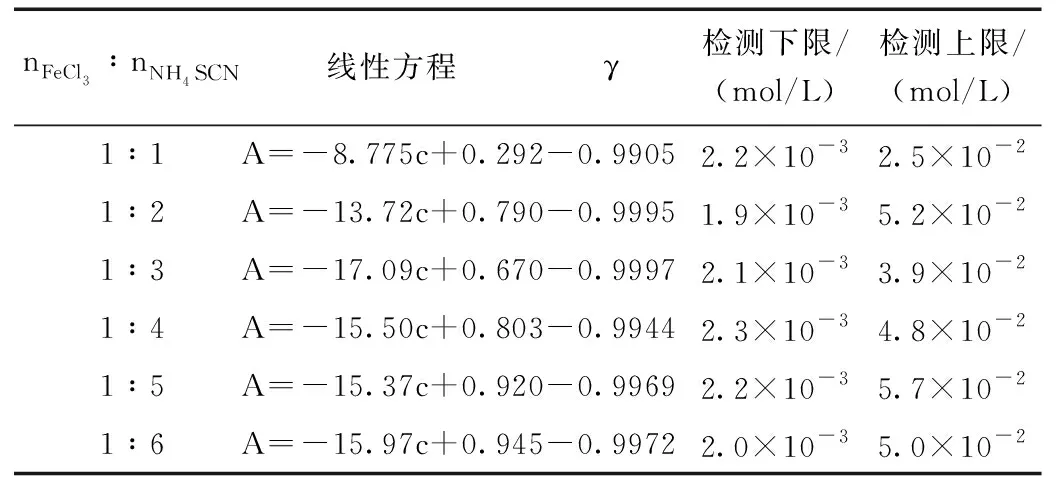
表1 配位比为(1:1)~(1:6)时的[Fe(SCN)n](3-n)吸光度与水含量间的线性方程及其检测限Table 1 Linear equation and detection limit between [Fe(SCN)n](3-n) absorbance and water content when the coordination ratio is(1:1)~(1:6)
2.4 测水含量的线性范围
本工作以1.0×10-4mol/L为硫氰合铁配合在有机溶剂的初始浓度,递增有机溶剂中的水浓度,以线性拟合法确定其测定水含量的线性范围。结果如表1所示,检测上限与溶液中[Fe(SCN)n](3-n)的不同及各自的最大吸光值的不同而略有差异。图4为FeCl3与NH4SCN摩尔比1:2时吸收光谱随水含量变化,当水浓度增大到一定程度后,光谱已不出峰。这是水含量超出检测上限所致。图3中的插图也表明,当乙醇溶液中水浓度为由0.0521 mol/L增至0.0556 mol/L时,所得线性方程的γ由-0.9980变为至-0.9875,此时A与c之间的线性关系已经较差。实际应用中,当有机溶剂中水含量太高而超出线性范围时,可以通过适当增加其中配合物的初始浓度来增大检测的线性范围。故使用该法测水含量时,可不受线性范围的限制。
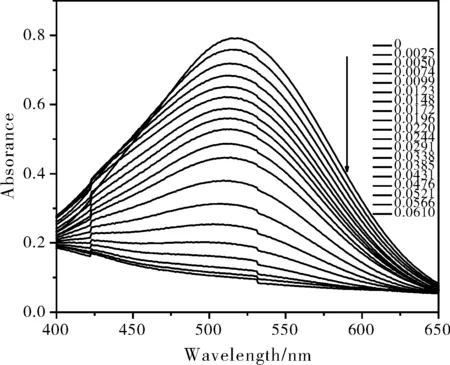
图4 FeCl3与NH4SCN摩尔比为1:2所得[Fe(SCN)n](3-n)的吸收光谱随水含量的变化Fig.4 Absorption spectral changes of [Fe(SCN)n](3-n) obtained by FeCl3 and NH4SCN molar ratio of 1:2 in the presence of water
2.5 样品测定和加标回收率
以市售95%乙醇为样品,平行测定10次的结果为:该乙醇中水含量为4.83%,相对标准偏差为3.03%;又对上述样品进行了加标回收实验,所得加标回收率为98.46%~103.50%。结果表明,该法测定有机溶剂中水含量结果可靠,重现性好。
3 结 论
本工作基于FeCl3与NH4SCN按不同摩尔比所得[Fe(SCN)n](3-n)在有机溶剂中的吸收光谱随水含量的变化,探讨了该配合物在机溶剂中与水的变色反应机理、反应时间及实室温度波动的影响,进而建立了一个简单、快速测定有机溶剂中水含量的方法。该法基于[Fe(SCN)n](3-n)吸光度与有机溶剂中水含量间的线性关系而建,其γ为-0.9997~-0.9905。样品测定结果表明,该方法是具有良好的准确度和重现性,结果令人满意。鉴于上述结果及该法所用仪器及试剂较廉价,故本文所建方法具有操作简单、快速、成本低、重现性好、灵敏度高等优点。因此,本研究所建立的基于[Fe(SCN)n](3-n)吸收光谱的测定有机溶剂中水含量的方法在工业生产和实验室研究中都有重要实际应用意义。
