长江岸线宜昌江段五种不同类型水样对稀有鲫胚胎的毒性
2020-10-15王能汉邓巧玲范垚城唐海滨
王能汉 邓巧玲 范垚城 唐海滨 雷 磊 曹 宏
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
长江作为我国第一大河, 在我国社会发展中有重要的地位。然而, 近20年来其干线及支流的污水排放总量明显增加, 虽经一定程度的治理及控制,但其流域内的河流及湖泊水质改善程度依然效果不显著[1]。最新的中国环保公报中显示: 长江流域的淡水资源中Ⅳ类水占9.0%, Ⅴ类水占1.8%, 劣Ⅴ类水占1.8%[2], 这几类水是无法饮用且不能与人体直接接触的, 特别是劣Ⅴ类水质除调节局部气候外,几乎无其他功能[3]。长江岸线在城市化和工业化以及农业村镇的道路建设过程中, 对水环境均造成了不同程度的影响。其污染面源类型涉及生活污水、工业污水、农业面源污水、渔业污水、长江航道等。为了对这几种水质综合评价, 除常规理化指标外, 对污染河流进行生物毒性检测和分析尤为必要。
稀有鲫(Gobiocypris rarus)是一种我国特有的小型鲤科鱼类,亦是优良的模式动物[4]。从1990年起, 稀有鲫就被作为我国标准鱼类实验动物而进行了目的培育, 目前该物种已有较多应用于遗传学、基础生物学、毒理学、病理学等领域的研究报道[5]。同时, 稀有鲫已被我国环境保护部列为新化学物质测试推荐鱼种[6,7], 首个关于使用稀有鲫的测试标准—化学品稀有鲫急性毒性试验(GB/T29763—2013)目前也已经正式公布并实施[8]。本研究以稀有鲫胚胎为试验对象, 参考国际经济与合作组织(Organization for Economic Cooperation and Development, OECD)在2013 年颁布的《鱼类胚胎急性毒性试验方法》(OECD TG 236,Fish Embryo Acute Toxicity Test, FET)[9], 检测长江岸线宜昌江段五种不同污染类型的典型水样对稀有鲫胚胎的毒性效应, 探讨其水质毒性检测的有效方法, 并为长江岸线宜昌江段水体污染的综合评价及后续治理提供依据。
1 材料与方法
1.1 水样采集及水质分析
结合污水监测点布设的原则[10], 共在宜昌江段设计5个采样点, 5个采样点水样包含长江城镇开发过程的几种典型代表水样: 市政管网生活污水、工业污水、农业面源污水、渔业污水和长江航道水样。采样时间是2019年3月26—27日, 根据采样点编号为1#、2#、3#、4#、5#水样。取得的水样用棕色玻璃瓶密封后带回, 并放入4℃冷库保存以供取用,具体取样地点如图 1所示, 各组水样详细信息见表 1。
试验水样的化学需氧量(Chemical oxygen demand, COD)、总氮(TN)、总磷(TP)、硝态氮(NO3-N)、氨氮(NH3-N)、亚硝态氮(NO2-N)和高锰酸盐指数分别通过重铬酸盐反应法、硫酸盐氧化法、消解-抗坏血酸法、镉反应法、水杨酸法和重氮化法、酸性高锰酸盐法完成。重金属采样微波消解法测定。农药残留则采用UPLC超高效液相色谱法测定。
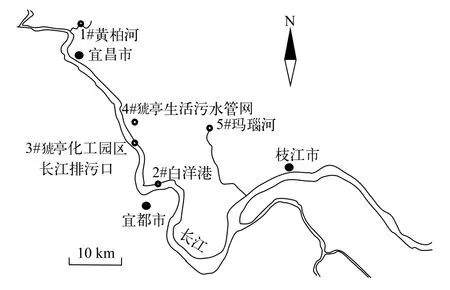
图1 水体采样点流域示意图Fig. 1 Schematic diagram of the sampling sites
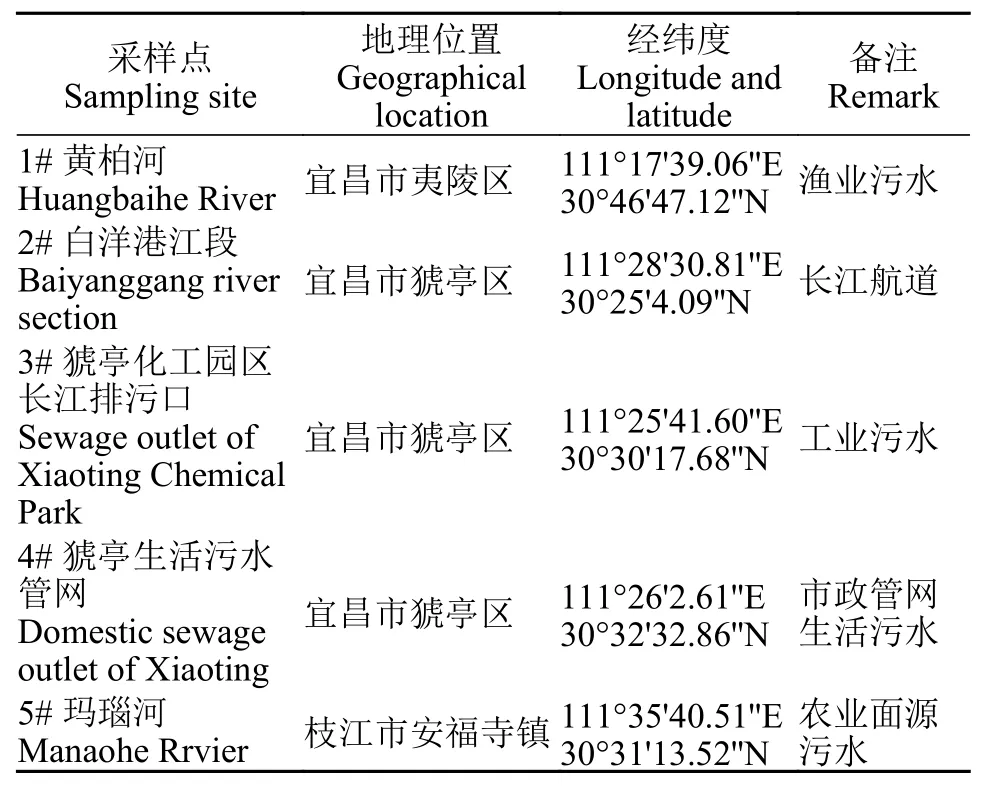
表1 水体采样点的地理信息Tab. 1 The geographic information of the sampling sites
1.2 稀有鲫胚胎的急性毒性试验
健康的稀有鲫实验亲鱼来自于中国科学院水生生物研究所稀有鲫普通级和清洁级资源保存基地培育的野生封闭群(IHB)系。每天投喂2次红虫, 光照12h。实验开始前期, 根据其产卵间隔节律和产前行为, 将亲鱼配对, 并人工授精。人工授精90min内, 体视镜(OLYMPUS BX53)镜检选择处于16细胞期前, 无明显不规则分裂或破损的受精卵用于急性毒性实验。
试验方法参考《鱼类胚胎急性毒性试验方法》(OECD TG 236)。用滴管随机挑选24 枚受精鱼卵,转移到24 孔细胞培养板(NEST), 每孔1个受精卵。其中第一排4个孔各加入2 mL空白对照组水样作为对照组, 空白对照组水样采用标准稀释水, 配置方法如下: a. 氯化钙溶液: 将11.76 g CaCl2·2H2O溶解于超纯水中, 稀释至1 L; b. 硫酸镁溶液: 将4.93 g MgSO4·7H2O溶解于超纯水中, 稀释至1 L; c. 碳酸氢钠溶液: 将2.59 g NaHCO3溶解于超纯水中, 稀释至1 L; d. 氯化钾溶液: 将0.23 g KCl溶解于超纯水中, 稀释至1 L。将以上四种溶液各25 mL加以混合并用超纯水稀释至1 L[11]。
其余每一排4孔则分别加入不同的5组待检水样, 每孔2 mL, 每个24孔细胞板作为1组, 每孔各放置1枚鱼卵, 共设3组平行。然后将孔板置于(25±1)℃光照培养箱中(珠江LRH-250-G)、光照比为12h﹕12h (白昼﹕黑夜) 的环境中暴露, 每24h 换1 次试验用水, 进行为期96h的暴露试验。在试验的24h、48h、72h和96h时检查胚胎的发育情况和存活率。采用体式显微镜观察测试胚胎发育情况, 每24h记录死亡胚胎数量、幼鱼孵出数量及畸形幼鱼数量, 并统计48h时胚胎心率。利用数码相机连接体式显微镜(Carl Zeiss Stemi 508)对胚胎的损伤特征和幼鱼的畸形特征进行拍照记录。
1.3 数据分析
试验数据以均数±标准差(Mean±SD)表示, 使用SPSS20.0统计软件进行单因素方差分析(Oneway ANOVA), 组间比较采用Duncan’s多重比较进行检验。以P<0.05为显著性差异。
暴露实验中主要的统计指标计算公式如下: 心率(次/分钟)=15s心率×4; 孵化率(%)=(孵化个体/受精卵数)×100; 畸形率(%)=(畸形个体数/受精卵数)×100; 存活率(%)=(存活数/受精卵数)×100。
2 结果
2.1 水样的理化指标
我们对水样进行了常规污染物的检测, 表 2显示了五组水样的常规污染物检测结果。同时, 我们将部分指标与Ⅲ类地表水指标进行了比较, 发现:1#水样各项基本达到Ⅲ类地表水指标; 2#水样总磷超标外, 其他各项指标均达到Ⅲ类地表水指标;3#和4#水样各项指标全面超标, 水质较差; 5#水样在总磷和高锰酸盐指数存在一定程度的超标(图 2)。同时, 我们还检测了各组水样中的重金属含量(表 3),发现3#水样中各项重金属指标均高于其他组。
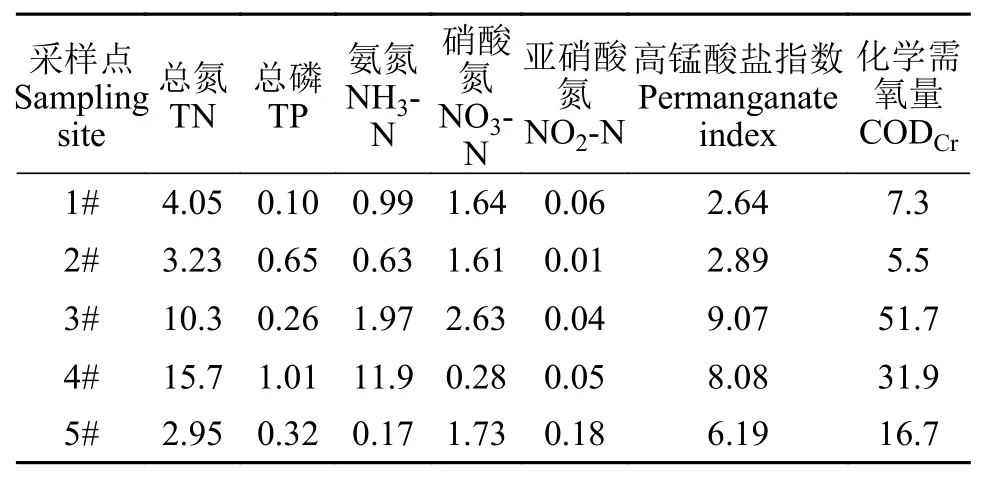
表2 各水样的常规污染物信息Tab. 2 The concentration of several conventional pollutants in each sample (mg/L)
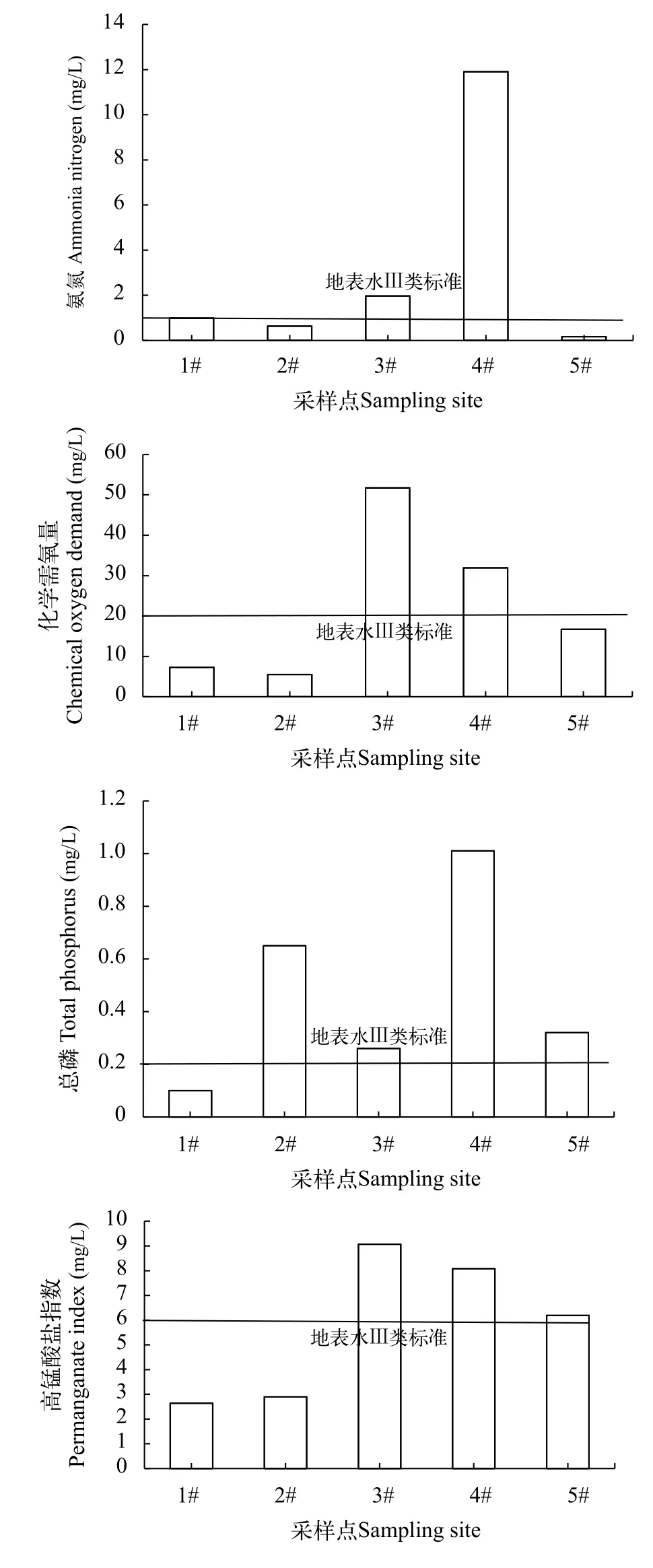
图2 各水样的常规污染物指标与Ⅲ类地表水的对比Fig. 2 The conventional pollutants index among the level III standard surface water in each sample
2.2 生物毒性
本实验在暴露处理48h后, 统计了各组稀有鲫胚胎的心率(图 3)。4#水样胚胎心率最低,3#水样其次, 二者相对于对照组均有极显著的降低(P<0.01)。
同时, 我们在72h后, 统计了各组水样处理后的稀有鲫胚胎孵化率(图 4)。2#水样胚胎孵化率变化趋势总体上与对照组最为接近, 受到影响最小。1#、5#水样胚胎的整体孵化率一定程度低于对照组, 而3#、4#水样胚胎整体上孵化率显著低于其他组(P<0.05)。
研究发现, 经过猇亭工业污水长江排污口的3#水样和取自猇亭生活污水管网的4#水样处理后的稀有鲫胚胎, 在其发育过程中出现了多种畸形症状, 例如脊椎弯曲、身体弯曲、卵黄囊水肿、卵黄囊吸收迟缓及鱼鳔无法充气等; 此外, 4#水样处理后的稀有鲫胚胎相比较其他组, 还出现了多例心包肿大的畸形(图 5)。经统计发现, 4#水样处理后的稀有鲫胚胎出现畸形率及发育迟缓的比例最高, 3#次之; 而相比较而言, 经过1#、2#、5#水样处理后的胚胎则几乎无畸形症状出现(图 6)。
在进行完96h暴露实验后, 统计最终各组的成活率(图 7)。结果显示3#、4#水样处理后的稀有鲫胚胎成活率最低, 而2#水样处理后与对照组均无死亡现象, 1#、5#组处理后的稀有鲫胚胎成活率则略低于对照组。本次实验结果显示2#水样其生物毒性相对最少, 对稀有鲫胚胎发育几乎无影响, 1#、5#其次, 3#工业污水水样水质较差, 4#生活污水水样污染最严重, 对胚胎发育毒性最大。
3 讨论

表3 各水样中的重金属质量浓度Tab. 3 The heavy metal concentrations of each sample (μg/L)
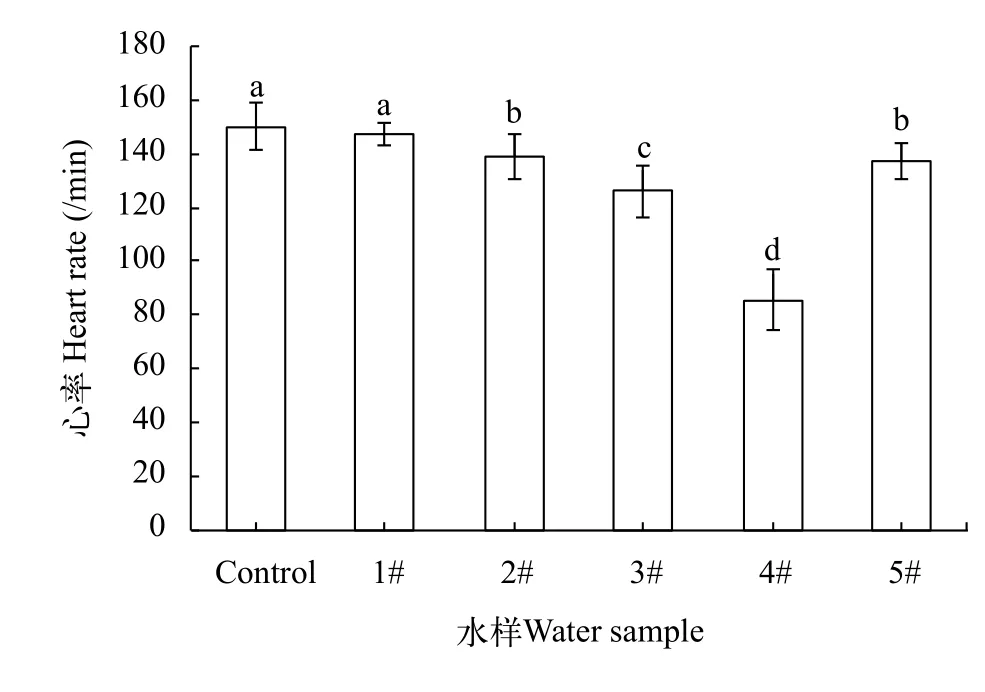
图3 各水样对稀有鲫胚胎心率的影响Fig. 3 The effect of samples on the heart rate of the embryo of rare minnow

图4 各水样处理后的稀有鲫胚胎孵化率对比Fig. 4 The hatching rates of the embryo of rare minnow in different sample treated groups
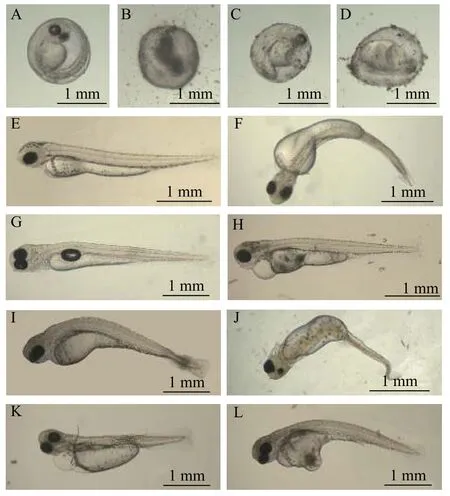
图5 发育异常的稀有鲫胚胎特征Fig. 5 The characteristics of malformation in the embryos of rare minnow
本次实验采集了长江岸线宜昌段城镇化过程中五种不同类型的典型水样。其中, 生活污水取自宜昌市猇亭区的生活污水市政管网, 其来源主要是家庭生活使用后产生的废水,此类废水中通常含有大量的氨盐和磷酸盐[12]。工业污水是取自宜昌市猇亭化工园区长江排污口, 该园区主要有宜昌市兴发化工集团等企业, 主要集中于磷化工系列产品的生产与开发。农业面源污染的水样及渔业污水分别取自于枝江市安福寺镇的玛瑙河及宜昌市夷陵区的黄柏河, 这类水体的污染主要来自农业生产活动中的氮素和磷素等营养物质、农药以及其他有机或无机污染物质。包括化肥污染、农药污染、集约化养殖场污染。主要污染物是重金属、硝酸盐、氨盐、有机磷、六六六、DDT、病毒、病原微生物、寄生虫和塑料增塑剂等[13]。此外, 我们还采集了长江宜昌白洋港江段的水样, 这五组水样能较为全面的反映在该季节长江岸线宜昌江段各类型水体的总体污染状况。
本研究针对五组水样检测了常规污染物及部分重金属含量等指标。研究发现, 多种污染物共存时往往存在叠加、拮抗或协同等复合毒性作用[14]。此外, 单一的理化指标不能反映多种污染物之间的联合作用, 运用生物对水体生物毒性进行评估直接反映复杂体系中所有组分的综合作用[15]。本研究利用五组水样处理了稀有鲫胚胎, 结果显示长江宜昌白洋港江段、农业面源及渔业区域水样水质相对较好, 而取自猇亭化工园区长江排污口的3#水样和猇亭区生活污水市政管网的生活污水(4#水样)则水质污染相对严重。
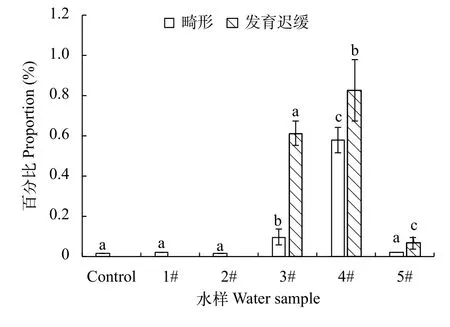
图6 各水样中稀有鲫胚胎畸形率及发育迟缓率的对比Fig. 6 The effects of samples on malformation and retardation rates of embryos of rare minnow
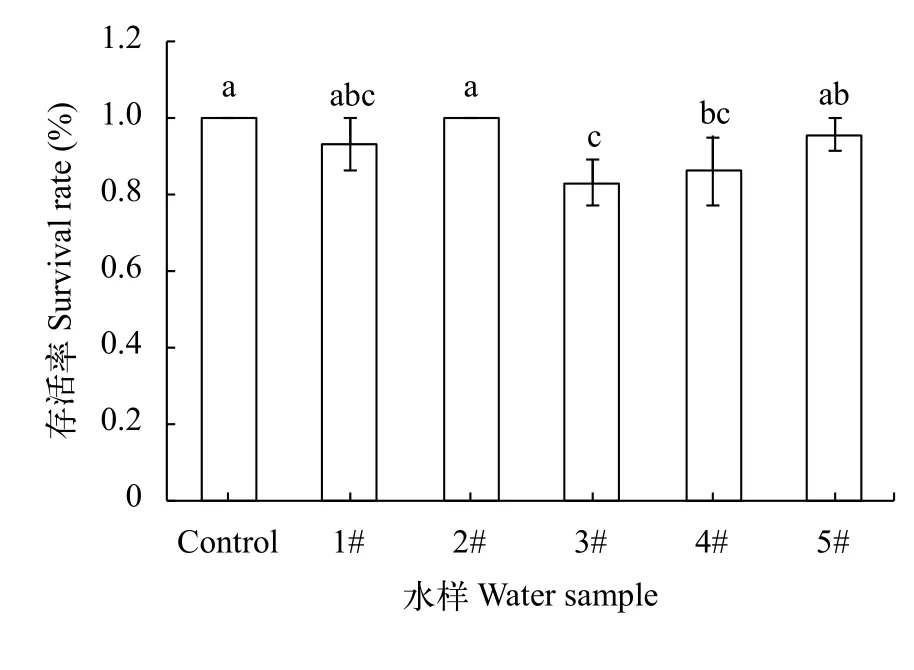
图7 各水样处理96h后的稀有鲫胚胎存活率对比Fig. 7 The survival rates of the embryos of rare minnow in different water sample treated (96h) groups
已有的研究表明, 稀有鲫胚胎在25℃环境下在发育到约34h时, 进入心脏搏动期, 心脏完全形成并开始缓缓搏动[16]。此次我们利用不同水样处理后发现, 48h时的心率结果显示4#水样处理后的胚胎心率最低, 3#水样次之, 显示出发育异常的特征。研究发现, 4#水样的氨氮指标相对最高, 处理后的稀有鲫胚胎出现了大量的发育异常并且死亡率明显增高。特别是4#水样处理的稀有鲫胚胎出现了大量的心包肿大现象, 心率、畸形率和存活率等影响指标上也更加严重, 说明4#水样中的高氨氮含量在对稀有鲫胚胎发育的生物毒性上起了主要作用。此外, 4#水样处理后的胚胎存在提前破膜现象, 推测有可能是氨氮通过渗透卵膜, 改变胚胎细胞膜内外渗透压造成的[17,18]。
综合本次试验所有结果, 我们发现2#(长江宜昌白洋港江段)水样水质最好, 污染相对最少, 对稀有鲫胚胎发育几乎无影响; 1#(黄柏河, 渔业污水)水样和5#(玛瑙河, 农村面源污染)水样水质相对较好; 3#水样(猇亭化工园区工业污水)及4#水样(猇亭区生活污水)的水质最差, 特别是4#水样, 其对稀有鲫胚胎发育毒性最大。因此, 对长江岸线宜昌江段水污染治理提出的建议是: 该区域生活污水污染治理应放在第一位, 其次工业污水污染。尤其需要优先控制的指标是生活污水中的氨氮含量。
