水域生态学中生物稳定同位素样品采集、处理与保存
2020-10-15王玉玉曾庆飞
徐 军 王玉玉 王 康 曾庆飞 张 敏 张 欢
(1. 中国科学院水生生物研究所, 武汉 430072; 2. 北京林业大学生态与自然保护学院, 北京 100083; 3. 中国科学院南京地理与湖泊研究所, 南京 210008; 4. 华中农业大学水产学院, 武汉 430070; 5. 南昌大学生命科学学院, 南昌 330031)
稳定同位素分析是确定生态系统食物网中生物营养级和能量流动途径的重要技术[1—4]。通过分析、模拟与比较生物营养生态位与营养关系的变化可以了解人为干扰如何影响能量从食物网底层到顶级捕食者的流动[5,6]。然而, 对营养生态位的长时间尺度或大空间对比的研究较为困难。一方面, 营养生态位研究可能来自不同研究人员、不同采样和处理方法, 这种不一致性增加了生物样品分析结果的不确定性, 妨碍了调查结果的比较; 另一方面, 使用已存档的生物样本进行营养生态位研究有助于研究人员获得生态系统生物营养生态位基准特征, 对认识不同时间格局下生物在食物网中功能具有重要意义。然而, 由于同位素分析自身的特点, 样本的储存(冻干、烘干或防腐剂保存)本身可能会更改同位素特征, 进而影响对营养生态位的评价[7]。
就碳、氮稳定同位素而言, 其随营养级的变化通常分别0.4‰和3.4‰[3], 而已有研究报道的样品处理与保存的同位素变异许多已经超出了营养级间的变异[8,9]。此外, 许多研究也发现较小的同位素变异与重要的食物网结构与功能改变相关联。例如, Vander Zenden[10]发现外来鱼类引起湖泊食物网结构的改变, 进而导致土著捕食鱼类碳、氮稳定同位素发生了1.8‰和0.6‰的变化。Perga和Gerdeaux[11]也报道了Lake Geneva在恢复其寡营养水平的过程中,Coregonus lavaretus(L.)的碳稳定同位素每十年平均改变仅为1‰。这些研究均表明, 生态系统干扰在短时间内不一定会导致在生物营养生态位发生巨大改变。因此, 准确认识样品采集、处理与保存过程中影响稳定同位素分析的可能因素,并避免这类差异, 对准确评估食物网中生物营养生态位及正确理解人类活动引起的食物网结构与功能变化就有重要意义[12]。
基于上述可能由于样品采集、处理与保存所导致的样品稳定同位素的变化, 本文主要目的为:(1)通过同位素质量平衡模型的模拟, 直观展示由于样品采集、处理与保存引起的潜在同位素变异对评价生物营养生态位的影响, 并分析这种不确定性的效应; (2)综合现有水域生态系统研究中常见类群的常用样品采集、处理与保存的思路与技术手段,探讨各种因素引起同位素变异的原因与差异; (3)确定适用性较强的样品采集、处理与保存程序, 用于多空间尺度、长时间系列的同位素生态学比较研究的对比、校验与修正。
1 水域生态系统中同位素特征与不确定性分析
1.1 影响因素的复杂性与多样性
随着稳定同位素质谱的出现和发展, 科学家得以精确地测量某种元素的稳定性同位素比值在不同物质中的含量, 并结合稳定性同位素独特的物理性质和化学性质, 例如同位素质量平衡效应(Equilibration)以及同位素分馏效应(Fractionation), 探讨生态系统中物质循环和能量流动规律[13]。在水域生态系统中, 影响浮游植物、底栖藻类与水生高等植物等初级生产者的稳定同位素特征的因素非常多, 例如叶绿素、磷和CO2浓度、光强和水的流速、地下水的上涌、水华的爆发和洪水、无机碳源, 以及微生物碳源[14]。在光合作用过程中, 植物叶片表层周围的CO2扩散作用也会影响植物的稳定性同位素比率, 例如底栖藻类通常处于一种CO2限制的条件中, 所以底栖藻类区分12CO2和13CO2的能力较差。而相对于底栖藻类, 浮游藻类处于一种CO2相对充足的条件中, 所以浮游藻类可以选择性地吸收更易于进行光合作用的12CO2。因此, 相对于浮游藻类, 底栖藻类的δ13C较高[15]。生物化学过程是影响消费者与其食物之间同位素分馏的主要因素。例如呼吸作用所产生的二氧化碳中13C含量相对动物自身的13C组成较低[16], 因而可用于解释消费者相对食物碳稳定性同位素比率增大的现象[16]。存在于成脂过程中丙酮酸氧化反应中对13C的重同位素歧视作用[16]导致了生物体内脂类含量相对较高的组织比脂类含量低的组织碳稳定性同位素比率低。动物细胞内谷氨酸和天冬氨酸之间的转氨作用过程中,14NH2比15NH2快1.0083倍, 这导致了食物缺乏的情况下动物组织15N的增加[17]。与食物相比, 消费者的氮稳定性同位素比率约增加3‰—5‰,这可能是因为消费者的排泄物中尿素和氨的氮稳定性同位素相对较低, 从而导致了高营养级生物的氮稳定性同位素相对较高[18]。此外生物体内的稳定性同位素特征还受到不同水域生态系统类型、寄主和宿主之间的特殊营养关系、生物个体或种群水平食性转变、代谢机能、栖息地、饵料的质量等一系列因素的影响[14,19]。
1.2 不确定性对食物来源贡献的敏感性分析
为了举例说明样品采集、处理与保存所导致的稳定同位素变化对评价生物营养生态位的影响,我们首先定义稳定同位素不确定性为真值与检测值之间的同位素差异, 即由于样品采集、处理和保存引起的生物稳定同位素变化(图 1a)。这张图反映的是消费者样品采集的不确定性(U)与样品真值(T)之间的稳定同位素变异, 以及不确定性的度量与二者的关系; 在此基础上, 我们进一步定义了一个基于稳定同位素的食物网, 包括一个消费者(T)及4个潜在食物来源(数字, 图 1b), 其中A、B、C、D分别为定义的四种不确定性条件。通过使用基于同位素质量平衡建立的Isosource模型[20]对该食物网中生物营养来源模拟。从图 2可以看出, 生物的4种食物来源相对比例在真实条件和其他不同的不确定性条件下的变化。由于D这种极端情形已经分布在食物来源的同位素范围之外, 因此无法给出其分布频次特征图。
以上4个案例反映了在一个简单食物网中捕食者对4种食物来源利用的特征。通过IsoSource模型的模拟和预测, 我们可以看到由于捕食者自身同位素特征的不确定性对评价食物来源幅度和方向均会产生一定水平的影响。这种对生物营养生态位的判别不确定性取决于生物稳定同位素组成变异的幅度, 同样也受到食物自身的稳定同位素变异的影响。因此, 由于样品采集、处理与保存所导致的样品稳定同位素的不确定性会影响对所研究的系统不同生物营养生态位的判断。通过减小样品采集、处理与保存所导致的样品稳定同位素的不确定性对于减小评判生物营养生态位的变异至关重要; 同时也有助于同位素数据的解释和对食物网结构与功能的正确认识。
2 生物样品的采集
2.1 样品采集与保存的容器
由于稳定同位素分析所需样品量非常少, 样品受到污染的风险相对较高[21]。因此所有样品采集装置及样品容器(例如Eppendorf管、锡纸和玻璃管等)都应预先使用10%HCl浸泡30min, 用去离子水反复清洗3次, 然后干燥备用。此外, 玻璃器皿(抽滤装置、过滤漏斗和小玻璃瓶等)应在在马弗炉中450℃预烧4h备用。这两种处理方法主要用于消除无机和有机碳和氮的影响[7]。样品容器的标签通常包含以下信息, 如样品编号、取样时间、取样地点、取样类型、分析项目、现场处理方式和采样人, 并且与采样现场记录和其他样品记录相对应,例如坐标、天气、水体理化特征等。
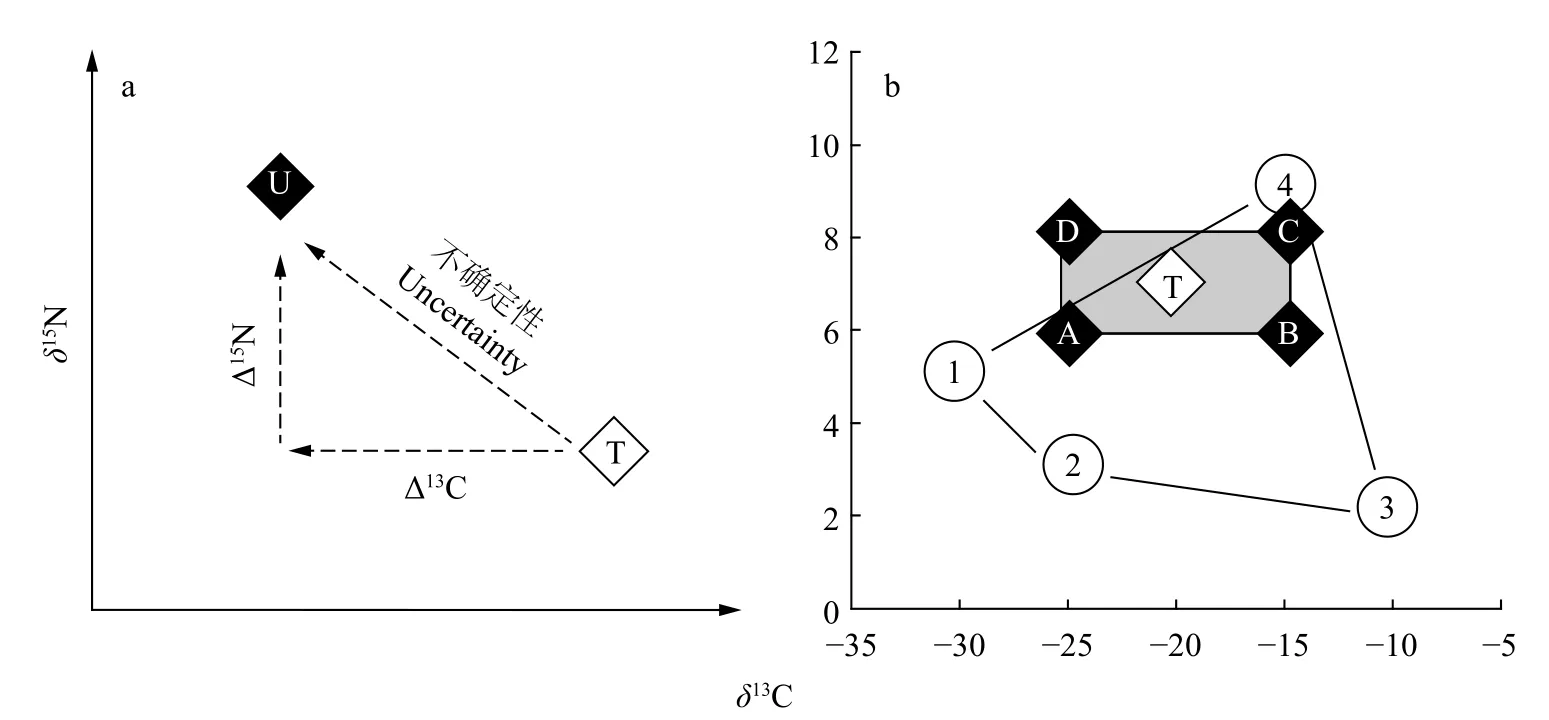
图1 不确定性度量及消费者与四种食物来源的营养关系定义Fig. 1 Measurement of uncertainty and the defined trophic system composed of one consumer and its four potential food sources
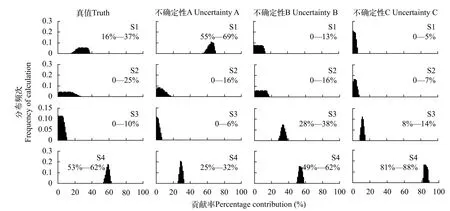
图2 消费者四种食物来源不同情境下的分布频次特征Fig. 2 Frequency of consumer’s four food sources in different contexts
2.2 初级生产者
悬浮颗粒有机物是水体中生物地球化学循环的重要组成部分, 是食物网底层最重要的物质与能量提供者[22]。采集悬浮颗粒有机物样品需使用玻璃纤维滤膜。滤膜孔径大小根据实验设计方案决定。因为不同来源或批次的滤膜可能包含大量且不同的碳或氮的污染, 所以采集前滤膜在马弗炉中450℃预烧4h备用。水样首先经200—250 μm浮游生物网预过滤, 以避免悬浮颗粒有机物颗粒大小的非均质性。预过滤水样如果无法在采样现场立即过滤, 则应及时低温避光运回实验室, 并在12h内完成过滤。水样过滤前摇匀使用。过滤后悬浮颗粒有机物滤膜直接烘干至恒重(60℃, 48h)或冷冻干燥。如不能及时干燥, 滤膜则需低温保存(-20℃)。在悬浮颗粒有机物含量较低的情况下, 可以在滤膜烘干前或后将表面有机物剥离或刮离下来, 这样一方面可以降低滤膜本身对样品中碳或氮含量的稀释作用, 同时也可以延长元素分析仪-同位素质谱联用仪中燃烧系统的使用寿命[23]。
应在采样地点用浮游生物网(根据实际需要选择网孔大小)收集足够的藻类材料。在显微镜下将非藻类颗粒物用毛吸管手动吸出。将剩余部分过滤到孔径为10—30 μm的滤膜上, 然后存储在液态氮中。在实验室中用离心方法(1min, 10000×g)进一步将藻类与其他有机颗粒分离。将离心管上部绿色部分分离镜检, 再次手动移除非藻类物质, 并用去离子水冲洗, 如此反复3次。最后镜检记录藻类样品优势种组成[24]。浮游生物学家也设计了多种特殊的离心装置来收集藻类细胞[25]; 同时, 还有藻类群体色素特殊化合物的同位素分析[26]以及流式细胞分离耦联同位素分析[27]等方法。这些方法需要特殊仪器设备, 生态系统研究中的应用具有一定局限性。此外, 也有学者利用光诱导迁移方法分离沉积物底栖藻类, 但也受到生物类型以及牧食者对藻类摄食习性等因素的限制[23,28]。藻类样品直接烘干至恒重(60℃, 48h)或冷冻干燥。如不能及时干燥, 滤膜则需低温保存(-20℃)。
其他常见初级生产者包括水生维管束植物、附着藻类以及沉积物有机物等等。水生维管束植物的样品相对较易获得。取活体水生维管束植物的叶片或整株。将其表面附着藻刮洗后, 用去离子水反复冲洗3次。水生维管束植物样品直接烘干至恒重(60℃, 48h)或冷冻干燥。如不能及时干燥, 滤膜则需低温保存(-20℃)。附着藻类通常采集方法为现场刮取或刷洗水生植物、石头或其他非生物表面的附着物获得。用去离子水或现场过滤的水样冲洗附着藻类3次, 直接烘干至恒重(60℃, 48h)或冷冻干燥。如生物量较低可过滤至预烧的滤膜上后进行烘干或保存[28]。沉积物有机物采集方法为现场用沉积物采集器获得表层或柱状样品, 用500目筛网过筛, 去除大型底栖动物活体或残骸, 以及大尺寸颗粒, 以便获得均匀性较高的稳定同位素样品。样品放入酸洗容器, 低温运输到实验室, 直接烘干至恒重(60℃, 48h)或冷冻干燥[28]。
2.3 消费者
底栖动物大型底栖动物样品通常用彼得森采泥器采集表层沉积物, 经分样筛原位手动分检,鉴定生活史阶段及种属特征[29]。分离样品量需根据物种个体大小以及仪器分析精度来确定。在样品收集过程中应注意水体基本特征, 包括生境特征和底栖动物生活史。以摇蚊幼虫为例, 幼虫期需要30—50个个体混合才能满足一次稳定同位素测试,混合样品可以避免种间差异的影响; 而对于三、四龄幼虫也可以进行个体测定, 一方面可以反映相对较长时间的摄食特征, 同时也可以观测个体食性的差异[30]。
浮游动物浮游动物样品的收集可以根据实际情况选择不同孔径大小的浮游生物网进行。在样品收集后, 保持活体低温保鲜(4℃)运输到实验室, 进行活体镜鉴与分离。如果是为了获取混合浮游动物样品, 则需通过镜鉴出去肉眼可见的非浮游动物物质, 例如碎屑。如果是为了获得优势种类样品, 则可以通过微毛细管, 在解剖镜或显微镜下挑取分离。由于个体大小的差异, 分析所需单个测试样品可能有数十个到几百个组成。分离纯化后的浮游动物样品放置在盛有去离子水的器皿中, 等待进一步处理[31]。分离样品3—5份待测, 样品的浮游动物种类、大小等信息同步记录[32]。
鱼类就鱼类样品而言, 由于鱼类个体的不同组织间同位素特征值有所不同, 因此选择何种组织进行分析将会影响对营养关系的解释。通常取鱼类背部白色肌肉来指示个体稳定同位素特征。如果鱼类个体较小, 则取鱼类整体(去除肠含物或内脏)作为同位素分析对象。在许多情况下, 由于不能伤害鱼类(如受保护鱼类), 则采集鱼类其他组织, 例如鳍条、血液、体表黏液和鳞片等等。由于不同组织的同位素周转特征差异显著, 可导致其同位素与个体同位素产生差异, 从而影响对数据的解释。例如黏液稳定同位素周转要远远快于其肌肉[33]。那么这些同位素周转快的组织(如胰腺、血液、体表黏液等)通常可以用来指示生物近期(数天至数周)的营养生态位; 而同位素周转慢的组织(如肌肉和鳞片等)其同位素特征可以指示中长期(数月至数年)的营养生态位[34]。需要注意的一点就是, 不同组织同位素特征的差异一方面是由于同位素周转周期不同引起的, 另外一种因素就是不同组织脂类含量变化引起的。在同一个体的某一组织中, 脂类通常比蛋白质和碳水化合物等物质的碳稳定同位素偏低。因此, 在同位素分析前对不同组织或器官进行去脂处理(参见去脂部分)[35]。
3 生物样品的处理
3.1 肠道排空
肠含物对小个体生物稳定同位素可能存在一定影响。通常在生产力较高的水体这种影响相对较高。因此, 浮游动物与底栖动物经分离后需要在去离子水中暂养。暂养时间视个体大小而定。通常浮游动物需要4h以上, 而底栖动物需要12h以上。暂养结束后可通过显微镜镜鉴确定是否完全排空[36,37]。本过程也适用于其他以个体为分析对象的小型生物。在暂养过程中, 需及时移除水体中的粪便, 以避免某些生物的自食粪便的特点。
3.2 酸化
由于有机样品采集过程中易受到碳酸盐的潜在影响而改变样品的稳定同位素特征[38]。因此需要对易受此类影响的样品, 包括沉积物有机物、悬浮颗粒有机物、有机碎屑和大型水生植物等, 进行酸化处理。由于酸化处理会在某种程度上改变氮同位素的含量[39], 因此建议酸化样品前将样品分为两个部分, 一部分酸化后用于碳稳定同位素的分析,另一部分不酸化用于其他同位素分析[38]。酸化采用1 mol/L HCl, 过量加入样品后直至反应结束气泡消失, 用去离子水冲洗3次后待用[40]。
3.3 去脂
生物组织中脂类δ13C值相对于其他生物化学物质较低, 其原因为在脂类合成过程中丙酮酸转化为乙酰辅酶 A时存在重同位素歧视效应[16]。此外, 动物脂肪蓄积反映了生活史不同时期的能力需求, 受到生境、大小和生长时期的多种因素影响。因此组织中脂类含量可以影响样品δ13C, 并可能导致对生物营养生态位的错误解释。因此, 在分析样品同位素之前在分析之前对样品进行脂类提取, 主要方法有chloroform-methanol[41]和hexane-isopropanol[42]。通常, 当样品C:N>4时, 可参考使用脂类含量的校正公式[43—46]。通过比较脂类提取前后的白色肌肉组织的同位素比率, 研究人员发现由于白色肌肉组织脂类含量较低所以同位素变化无显著差异[45]。但是脂类含量受到多种因素影响, 因此特定研究仍需要确定特定物种各生活时期的修正系数, 以保证分析和解释的准确性[12]。
4 生物样品的保存
样品从采集、处理到检测之前的需要经过保存过程, 才可以在实验室进行分析。此外, 博物馆与各类科研机构标本馆中也保存了大量的样品。因此, 如果上述各类过程中保存技术会改变的样品同位素特征, 那么也会导致随后对生物营养生态位的误判, 以及影响对食物网历史变化特征的重建[8]。
4.1 冷冻与烘干
在样品采集、处理与运输的过程中冷冻、冷冻干燥和烘干保存是现阶段最理想的方法[21]。尽管绝大多数报道均认为冷冻或冻干不影响样品的同位素组成[8,48—50], 也有报道表明冷冻在短期内不影响同位素特征, 长时间保存也会影响同位素特征, 特别是对于无脊椎动物的保存(例如浮游动物)[8,35]。其原因推测为在解冻处理过程中, 样品细胞破裂导致部分同位素流失所引起的[35]。在过去的20年间, 样品保存使用最多的方法就是低温烘干的方法。通常采用60℃烘箱24—48h。这取决于样品的大小与含水量, 其原则为烘干至恒重。近期研究表明鱼类肌肉样品烘干长期保存对稳定同位素组成没有任何影响, 因此烘干可以作为首选的保存方法[51]。但是烘干对无脊椎动物的保存效果, 仍需进一步研究确定。我们建议使用60℃对样品进行烘干, 以保证烘干的稳定性和结果的可比性[51,52]。
4.2 乙醇与福尔马林
许多研究表明乙醇和福尔马林保存会显著影响样品的稳定同位素含量。主要可能的因素为乙醇和福尔马林自身的碳可能会污染样品本身从而影响他们的δ13C值, 加上乙醇和福尔马林作为一种溶剂会溶解出样品自身的一些有机物质, 例如脂类或蛋白质[45,51]。因此, 这两种保存方法并不适合用于稳定同位素样品的保存[8,47,53]。同时, 福尔马林对人体有危害作用, 乙醇由于易燃不适和长途携带。但是由于博物馆或标本馆中用此类方法保存了大量的生物样本[45], 而实际上这两种保存方法在一定时间后相对稳定[8,48,51,54], 因此在分析此类长期保存的样本之前, 必须了解样本的保存方法、时间、样品类型, 进而开展保存实验, 一起获得合理的校正因子[8,48,51,54]。
4.3 腌渍
在许多偏远地区采样过程中, 由于供电无法保证, 所以冷冻或烘干保存收到一定限制, 因此腌渍这种保存方法就显得十分必要了。通常使用饱和氯化钠水溶液保存样品[8]。研究表明饱和氯化钠水溶液保存对鱼类肌肉稳定同位素含量没有显著影响[54]。但直接用氯化钠腌制则存在影响生物组织稳定同位素的可能[8,54]。因此, 在使用此类方法是需要判断样品的类型对此类保存方法的响应[49,54]。
4.4 进样前处理
进行样品同位素分析前, 第一, 对样品中的结缔组织进行清理; 第二, 所有化学方法保存的样品,均需用去离子水漂洗3次; 第三, 样品研磨成均匀粉末, 避免研磨过程中的交叉污染; 第四, 样品装载到锡杯过程中, 对应编号并记录装载量[8]。
5 总体建议
在运用稳定同位素技术研究水域生态系统时,首先要制订科学的采样计划(图 3)。根据采样计划对收集样品的工具进行处理(酸化或预烧, 消除收集样品工具可能带来的误差)。使用处理后的工具收集相关样品, 对于采集到的初级生产者, 需要根据大小和种类进行分类, 然后进行镜检、纯化和均一化, 初级生产者样品在测定碳同位素时需要对容易产生误差的样品进行酸化处理(如滤膜样品、表层沉积物样品等); 对于采集到的浮游动物和底栖动物样品, 需要根据种类、生活史和大小进行分类,然后进行镜检、纯化和均一化, 接下来是排除肠含物;对于采集到的鱼类样品, 经过鉴定和组织分离后,对于需要去脂的样品进行去脂处理。对于需要保存的样品, 直接采集的样品可以首先经过60℃烘干或冷冻干燥, 然后保存在有干燥器的容器中待测;也可以在-20℃冷冻保存至样品处理。博物馆等化学保存的样品, 需要设计相关方法学实验计算出相关的校正系数, 以便于得出准确的结果。样品进入质谱前, 需要将样品60℃烘干至恒重, 然后在经过酸化或者预烧过的工具中对样品进行研磨, 等待测试; 在这个过程中, 必须尽量防止对样品的污染(包括样品间的交叉污染)。

图3 建议在稳定同位素生态学中对水生生物样品收集、处理和保存的步骤图Fig. 3 Diagram of the logical steps suggested for sample collection, handling and preservation of aquatic organisms in stable isotope ecology
5.1 关于样品采集的总体建议
(1)所有样品采集装置及样品容器使用前必须进行酸洗或高温预烧;
(2)初级生产者样品采集需依据研究目的进行分类、清洗和鉴定, 并确保均一性;
(3)小个体消费者样品采集需依据研究目的进行分类、清洗和鉴定, 并确保均一性; 大个体消费者采集需区分样品的生活史以及组织器官。
5.2 关于样品处理的总体建议
(1)肠含物对小个体生物稳定同位素可能存在一定影响, 因此采集后的小个体样品需进行肠道排空处理。
(2)由于有机样品采集过程中易受到碳酸盐的潜在影响, 因此需要对易受此类影响的样品, 包括沉积物有机物、悬浮颗粒有机物、有机碎屑和大型水生植物等, 进行酸化处理。
(3)生物组织中脂类δ13C值相对于其他生物化学物质较低, 因此, 在分析样品同位素之前在分析之前对样品进行脂类提取。
5.3 关于样品保存的总体建议
(1)在样品采集和处理与运输的过程中冷冻、冷冻干燥和烘干保存是现阶段最理想的方法;
(2)对于已经用化学方法保存的样品, 应进行保存方法的预试验研究, 确定同位素变异的大小; 对于稳定变异的保存, 可以通过预试验获得短期或长期保存的校正系数。
致谢:
感谢华中农业大学水产学院与湖北大学资源环境学院部分实习学生帮助本文中部分资料的收集与整理。
