胸腔积液诊断纵隔弥漫性大B细胞淋巴瘤的细胞病理学特征分析
2020-10-15覃玲艳郭凌川顾冬梅尤志群
覃玲艳,郭凌川,顾冬梅,虞 杰,尤志群,何 璐
1.苏州大学附属第一医院病理科,江苏 苏州 215006;2.苏州大学附属第一医院影像科,江苏 苏州 215006
原发性纵隔(胸腺)大B细胞淋巴瘤[primary mediastinal (thymic) largeB-celllymphoma,PMLBCL],发生于纵隔B淋巴细胞,属于非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL),最早定义于1980年[1]。最新世界卫生组织(World Health Organization,WHO)(2016版)淋巴瘤分类中将其仍归于B 细胞淋巴瘤,为弥漫性大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)的特殊亚型[2]。PMLBCL主要发生于年轻女性,中位年 龄3 5 岁,占NHL的2%~3%,DLBCL的6%~10%[3],肿瘤具有独特的临床、免疫表型和分子遗传学特征。PMLBCL易伴发器官转移[4],传统治疗为单独化疗或放化疗相结合,PMLBCL患者平均5年生存率约85%,但年龄超过40岁的患者生存率明显降低[5]。本文通过对2例伴发胸腔积液的PMLBCL患者进行报道,复习相关文献,探讨PMLBCL在胸腔积液细胞学涂片及细胞块免疫组织化学表型中的特点,以提高浆膜腔积液诊断淋巴瘤的水平。
1 资料和方法
1.1 资料
收集苏州大学附属第一医院2015—2017年诊断的2例PMLBCL患者的病历资料。例1患者,男性,28岁,因“反复干咳伴胸闷1月余”入院。胸部CT示:纵隔占位,右侧胸膜多发结节,块状增厚,右侧大量胸腔积液(图1)。全身正电子发射计算机断层显像(positron emission tomography/computed tomography,PET/CT)示:右颈部、纵隔多发肿大淋巴结,右上肺多发结节,胸膜多处伴葡萄糖代谢增加,符合淋巴瘤表现,右侧胸腔积液(图2)。实验室检查示:铁蛋白1 220.28 ng/mL↑,CA125 113.5 U/mL↑,NSE 126.1 ng/mL↑。例2患者,女性,74岁,因“胸闷、气喘2月余”入院。胸部CT示:两侧胸腔积液伴左下肺膨胀不全,左纵隔占位伴纵隔淋巴结增大。全身PET/CT示:左肺门局部、纵隔淋巴结肿大,葡萄糖代谢增加,考虑恶性病变,左侧胸腔积液。实验室检查示:CA125 238.9 U/mL↑。上述2例患者完善术前检查后在CT定位下行纵隔穿刺术,B超定位下行胸腔穿刺术,各引流出淡黄色胸腔积液1 000 mL,术后标本行常规病理活检及胸水脱落细胞学检查。

图1 例1胸部CTFig.1 Case 1's chest CT image
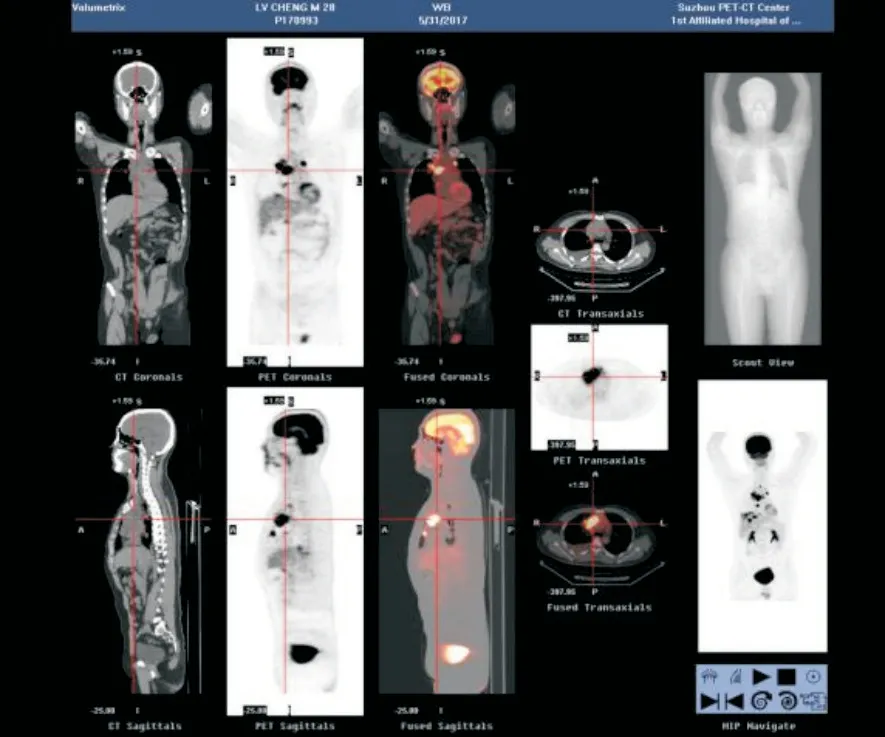
图2 例1全身骨扫描PET/CTFig.2 Case 1's whole body bone scan using PET/CT
1.2 方法
送检胸腔积液500 mL,取10 mL于离心管2 500 r/min离心5 min,弃上清,沉淀物去除红细胞后再次离心,取沉淀物涂片2张,H-E染色、镜检观察。剩余标本全部按上述方法离心,取沉渣石蜡包埋处理。穿刺组织均经4%甲醛溶液固定,石蜡包埋,3 μm厚切片,分别行常规H-E及免疫组织化学EnVision两步法染色。免疫组织化学试剂盒及抗体均购自北京中衫金桥生物技术有限公司。具体操作及判读标准详见试剂盒说明。TBS代替一抗作为阴性对照,用已知阳性切片作为阳性对照。
2 结果
2.1 细胞学与组织学形态
眼观:例1(细胞学)淡黄色胸腔积液500 mL。例1(组织学)纵隔肿块穿刺活检:纵隔灰白色穿刺组织4条,长度1.2~1.5 cm,直径为0.4 cm。
镜检:例1(细胞学)肿瘤细胞量丰富,呈散在或单一分布的异型大淋巴细胞群。肿瘤细胞体积大,有一定的细胞质,灰白或透亮,核质比明显增加,部分细胞质空泡状,出现细胞质内包涵体(图3)。细胞核呈圆形或卵圆形,部分细胞核可见一个大核仁呈免疫母细胞样,也可见2~4个核仁呈中心母细胞样(图4)。背景可见含吞噬小体的巨噬细胞、小的成熟淋巴细胞及间皮细胞。例1(组织学)前纵隔穿刺组织内见异型瘤细胞弥漫浸润性生长,被纤细的硬化纤维条索分隔,伴灶性纤维化(图5)。瘤细胞中等至大细胞,细胞质丰富淡染空泡状,核圆形或卵圆形(图6)。
2.2 细胞学与组织学免疫表型
免疫表型:例1(细胞学)肿瘤细胞LCA、CD20(图7)、CD23(图8)、CD79a(图9)、MUM1(图10)、PAX5呈阳性表达,CD30散在个别细胞阳性(图11),Lambda散在阳性,Bcl-2(75%,+),C-myc(15%,+),Ki-67(80%,+)(图12)。其他标志物:CD2、CD3、CK、CK7、MOC-31、Calretinin,CK5/6,Vimentin、Napsin A、TTF-1、CD10、BCL6、CD15、EMA、CD35、CDla、CD19、S100、CD56、CD138、Vs38c、Kappa、CgA、Syn等均阴性(根据目前文献报道[6],以50%以上肿瘤细胞表达Bcl-2蛋白计为Bcl-2表达阳性;以40%以上肿瘤细胞表达C-myc蛋白计为C-myc表达阳性)。
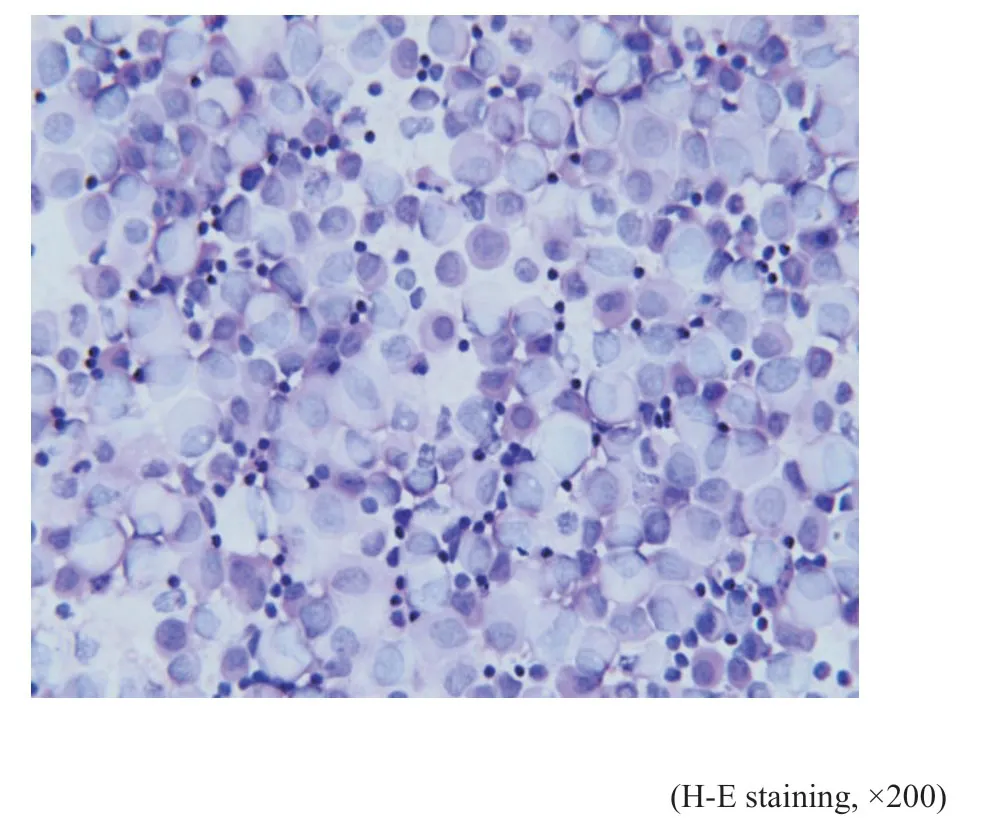
图3 例1胸水Fig.3 Case 1's pleural effusion
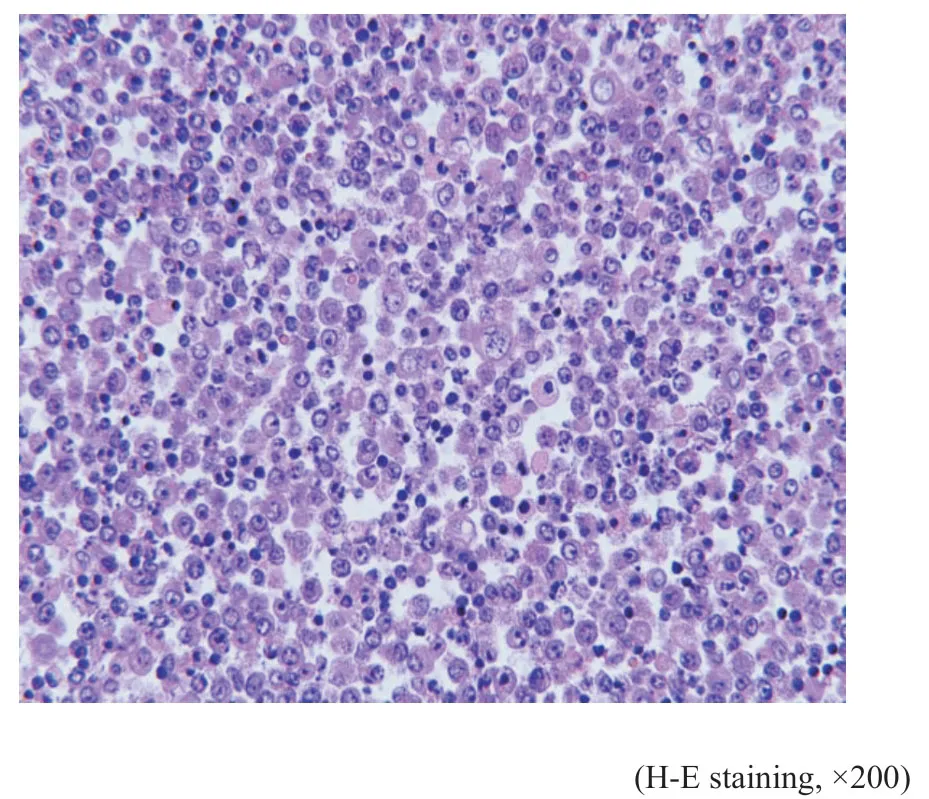
图4 例1胸水细胞块Fig.4 Case 1's pleural effusion cell block
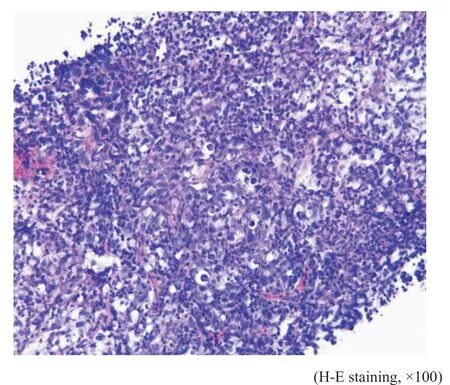
图5 例1穿刺组织条Fig.5 Case 1's puncture tissue strip
例1(组织学)肿瘤细胞LCA、CD20、MUM1、PAX5均阳性表达,CD30、CD23、CD79a均灶性阳性,BCL2(75%,+),C-myc(20%,+),Ki-67(80%,+)。其他标志物:CK、CK18、PLAP、CD117、CD3、CD10、BCL6、S100、vimentin、EMA均阴性。
例2(细胞学)肿瘤细胞LCA、CD20、CD79a、CD23、Pax5均阳性,Lambda散在阳性,MUM1灶性阳性,Bcl-2(60%,+),Ki-67免疫染色(85%,+),反应性T细胞CD2、CD3、CD43均灶性阳性,BCL6、CD10、C-myc、CD30、MPO、TDT、GB、CD56、CD138、Vs38c、Kappa、CK7、CK、vimentin、MOC-31、CgA、Syn、TTF1、CK5/6、Calretinin等均阴性。
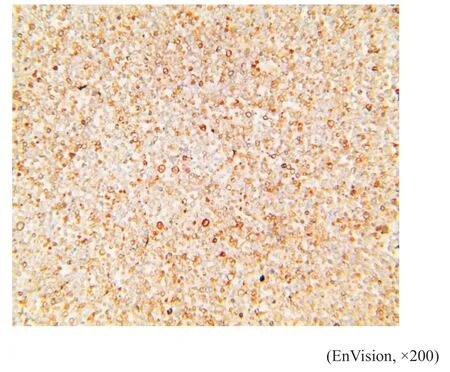
图9 例1肿瘤细胞CD79a呈细胞膜阳性Fig.9 Case 1's tumor cell was CD79a positive
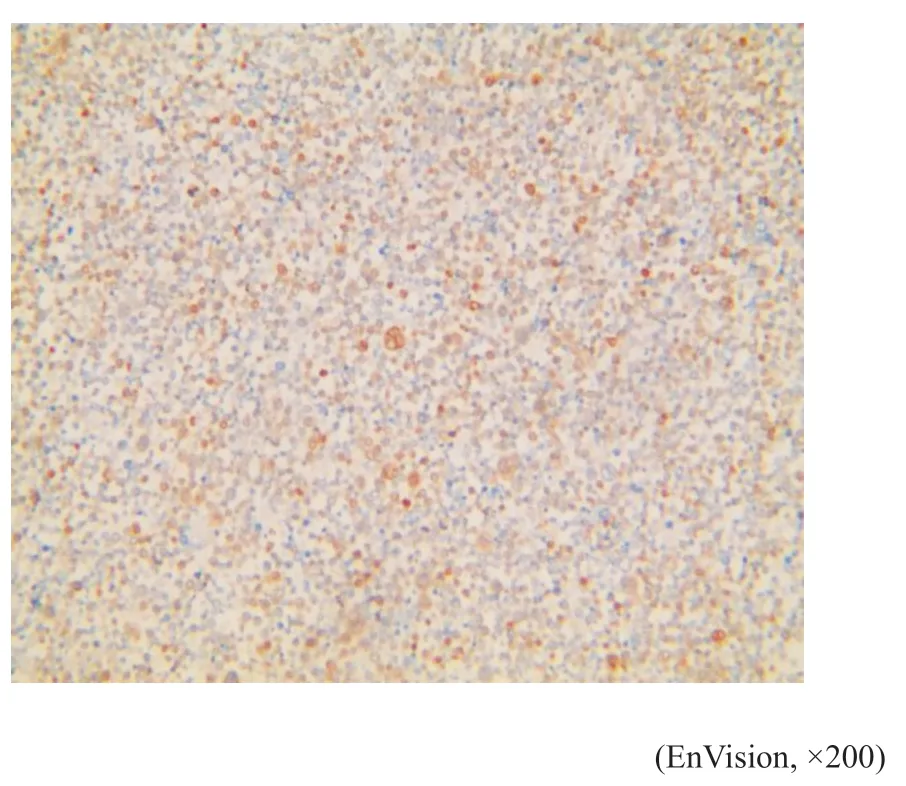
图10 例1肿瘤细胞MUM1呈细胞核阳性Fig.10 Case 1's tumor cell had MUM1 positive nucleus
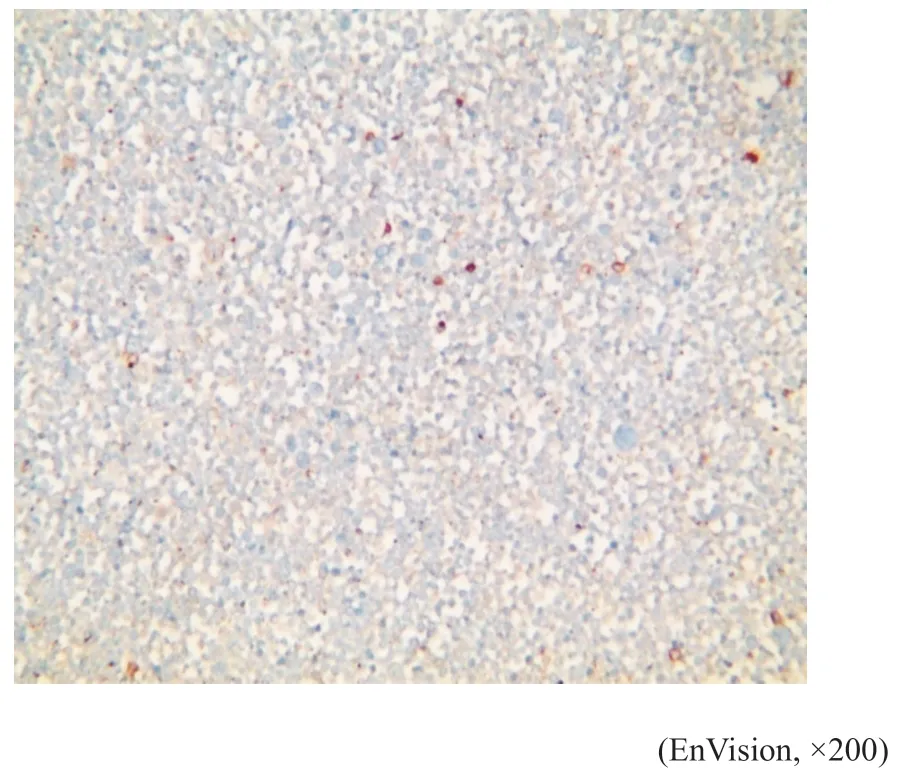
图11 例1肿瘤细胞CD30呈细胞膜阳性Fig.11 Case 1's tumor cell was CD30 positive
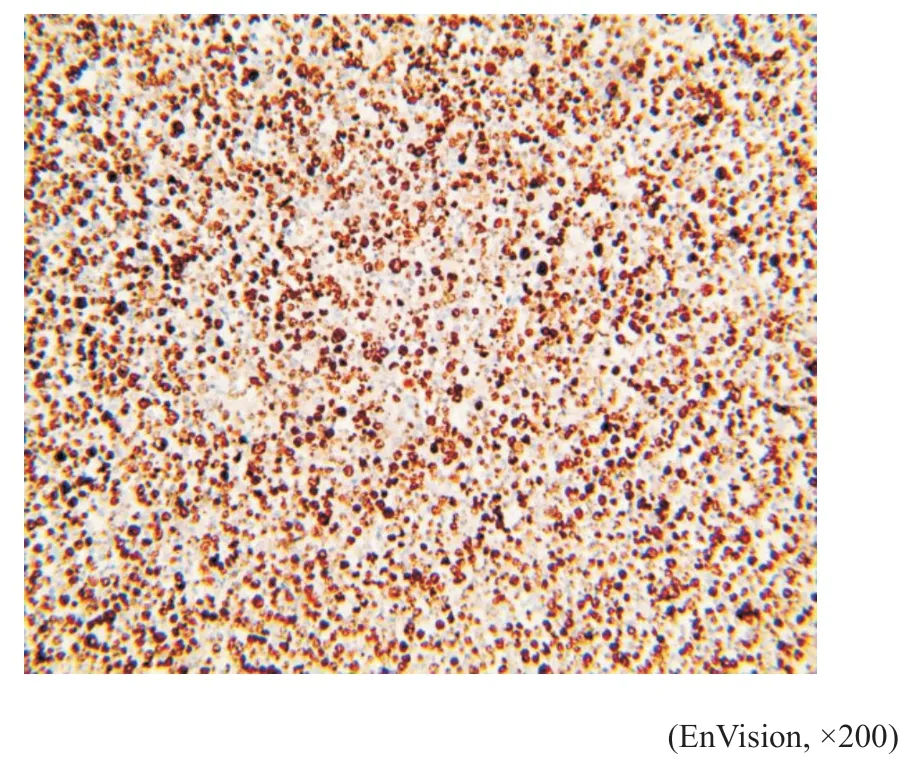
图12 例1肿瘤细胞Ki-67呈细胞核阳性Fig.12 Case 1's tumor cell had Ki-67 positive nucleus
例2(组织学)肿瘤细胞LCA、CD20、CD79a、CD23、MUM1、Pax5均阳性,BCL2(65%,+),Ki-67(85%,+),CD2、CD3、CD5、CD10、CD30、CD43、CD99、BCL6、C-myc、MPO、TDT、GB、CD56、CK、CK20、CgA、Syn、CD10、S100、EMA、vimentin均阴性。
2.3 细胞学与组织病理学诊断
例1(细胞学)异型小圆细胞,结合免疫组织化学结果,诊断为纵隔DLBCL。(组织学)纵隔DLBCL。
例2(细胞学)小圆细胞性恶性肿瘤,结合临床及免疫组织化学结果,诊断为纵隔DLBCL。(组织学)纵隔DLBCL。
2.4 随访
2例患者确诊后行周期性化疗,例1行R-EPOCH方案+DHAP方案化疗,门诊规律复查,随访至今,患者一般状况良好。例2行R-CHOP方案+利妥昔单抗单药化疗,随访2年后失访。
3 讨 论
PMLBCL属于DLBCL的特殊亚型,是一种较少见的NHL,肿瘤细胞来源于胸腺髓质星状(AID阳性)的B淋巴细胞[4],PMLBCL具有一定的侵袭性,患者通常只表现局部与前纵隔肿块有关的临床症状:咳嗽、呼吸困难、胸痛和上腔静脉综合征等[7]。肿瘤可在部分器官如胃、肾、肾上腺、肝、中枢神经系统中发生转移,很少累及骨髓[8]。PMLBCL的预后等同或好于其他DLBCL,5年生存率约85%,死亡风险与患者年龄和肿瘤临床分级相关,年龄大于60岁的患者是年龄18~39岁患者死亡风险的3.5倍,晚期Ⅲ~Ⅳ级肿瘤死亡风险增加80%[9]。本研究的例1为年轻患者,随访2年一般状况良好。
病理学检查中细胞涂片可见丰富的肿瘤细胞呈散在或单一的大淋巴细胞群分布。瘤细胞体积大,有一定的细胞质,灰白或透亮,核质比明显增高,部分细胞质空泡状,出现细胞质内包涵体,细胞核呈圆形或卵圆形,部分细胞核可见一个大核仁呈免疫母细胞样,也可见2~4个核仁呈中心母细胞样,背景可见含吞噬小体的巨噬细胞、小的成熟淋巴细胞及间皮细胞。本研究的2例患者胸腔积液与细胞块H-E涂片中均有其特点,但缺乏肿瘤组织及间质的形态特征。组织学镜检瘤细胞弥漫增生,通常被纤细的硬化纤维条索分隔,瘤细胞中等至大细胞,细胞质丰富淡染空泡状,核圆形或卵圆形[5]。本研究的2例患者穿刺活检H-E染色特征与之相一致。
PMLBCL免疫表型为免疫球蛋白(immune globulin,Ig)阴性,瘤细胞表达B细胞抗原:CD19、CD20、CD22、CD79-a,部分表达PAX5及CD45,80%的瘤细胞CD30弱阳性,CD15偶尔阳性,75%的病例瘤细胞IRF4/MUM1阳性,70%的病例CD23阳性,55%~80%的病例BCL2阳性,45%~100%的病例BCL6阳性,8%~23%的病例CD10阳性[5,7-10]。本研究的2例患者LCA、CD20、CD79a、CD23、MUM1、Pax5、BCL2呈不同强度的阳性表达,CD30差异性表达,BCL6、CD10及C-cmy均阴性表达。
PMLBCL具有特异的基因表达谱,表现为Ig克隆性基因重排、伴超体细胞突变、无进行性突变活性。扩增的代表基因有PMLBCL(JAK2)、PD-L1、PD-L2(9p)、REL、BCL11A(2p)、MAL。PMLBCL有独特的与CHL共享的转录标记,持续性激活NF-kB和JAK-STAT信号通路可抑制SOCS1突变[11-12]。在未来浆膜腔积液细胞学诊断中将完善基因检测进而行系统性诊断。
鉴别诊断中本研究的2例患者胸水H-E染色呈现的是细胞质偏位的核大异型细胞,需与转移性低分化癌相鉴别,结合患者临床资料,影像学表现,免疫组织化学检测CK7、MOC-31阴性,LCA及B细胞相关标志物阳性可鉴别诊断。本研究的2例患者CT均提示纵隔占位,需与胸腺瘤相鉴别。胸腺瘤常发生在前上纵隔,影像学检查与PMLBCL均可表现为纵隔肿块,但胸腺瘤常伴有重症肌无力等临床表现。转移性胸腺瘤的胸水H-E涂片可见小淋巴细胞背景上散在上皮细胞,免疫表现CK7、MOC-31阳性,LCA阴性。当胸腺瘤恶变为胸腺癌时,必须结合临床及组织活检(癌细胞巢状浸润)综合诊断。传染性单核细胞增多症脱落细胞学涂片中见到大片的反应性免疫母细胞时,可能被误诊为DLBCL,流式细胞术分析阴性,EBV阳性,结合相应的临床症状即可做出正确的诊断。NSCHL与PMLBCL脱落细胞学特点存在相似之处,仅从细胞学形态难以明确诊断,需结合免疫组织化学及组织活检。PMLBCL瘤细胞表达LCA及全B细胞相关抗原,而NSCHL的瘤细胞LCA及CD20通常失表达。组织学中PMLBCL纤维化分割的是瘤细胞巢,NSCHL纤维化分割的是淋巴细胞结节[13]。
肿瘤对化疗敏感,但扩散至胸腔出现胸腔积液或心包积液,伴机体状态差者预后不良,因此临床肿瘤周期治疗的方案选择和联合用药对提高患者生存率至关重要[14]。本研究的2例患者均采用多方案联合用药,其中例1行周期性化疗,随访2年,预后较好。随着肿瘤靶向治疗的飞速发展,PMLBCL治疗方案由传统的放化疗转向程序性死亡[蛋白]-1(programmed death-1,PD-1)抑制剂治疗,疗效较显著[15-16]。
胸腔积液细胞学诊断具有简单易行、快速实用、微创、可重复检查等优点,对以胸腔积液症状为首发或胸腔积液转移的晚期患者的预后监测具有重要的指导作用。在胸腔积液细胞涂片中发现异型细胞,难以鉴别是增生的间皮细胞、间皮瘤或转移性恶性肿瘤时[17],应将沉渣包埋制成细胞蜡块行免疫组织化学辅助分析及鉴别诊断。本研究的2例PMLBCL患者胸腔积液细胞学具有一定的特征,但仅凭细胞学形态诊断还存在一些困难,需将胸腔积液细胞涂片与细胞蜡块免疫组织化学检查相结合以明确诊断。
