基于TLR4/NF-κB信号通路探讨托里消毒散治疗放射性直肠炎的作用机制
2020-10-15祝朝富安佰平黄洪婕吴勇俊雷冬梅李世杰
祝朝富,安佰平,黄洪婕,杜 驰,吴勇俊,蓝 兰,李 丹,雷冬梅,李世杰,敖 睿
放射性直肠炎(radiation-induced proctitis,RIP)是接受放射治疗患者最常见的临床问题[1]。放射治疗后肠道功能障碍的人数持续增加,报道[2]显示接受前列腺癌放射治疗的患者中有75%以上发生急性RIP。目前对RIP的治疗是反应性的,通常只在RIP发作后才给药。治疗方法如硫糖铝、5-氨基水杨酸等经常不能显著改善患者的生活质量,甚至在极少数情况下被证明会加重疾病。在利用外科干预如激光消融、电灼、硬化注射等方面,都具有发病率和死亡率的重大风险[3]。因此,需要一种非侵入性预防性治疗,以防止RIP的发生或将症状改善到不会影响患者生活质量的水平。中医药在治疗放射性直肠损伤中的作用更加突出,在预防和治疗方面更能体现其不可比拟的优越性[4]。因此,该研究考察托里消毒散对放射性直肠炎的作用效果及机制,为放射性直肠炎的治疗提供依据。
1 材料与方法
1.1 材料
1.1.1动物与分组 成年雌性SD大鼠48只,体质量(210±10)g,购于成都达硕实验动物有限公司,使用许可证号:SYXK(川)2014-189。饲养于恒温(20~25 ℃)、恒湿(50%±5%)环境中,自然采光,自由饮水,饲以条杆状动物饲料。大鼠适应性饲养3 d后随机分为6组:空白组(未放疗+生理盐水)、模型组(放疗+生理盐水)、蒙脱石散联合地塞米松组(放疗+蒙脱石散+地塞米松)、托里消毒散低剂量组(放疗+托里消毒散低剂量)、托里消毒散中剂量组(放疗+托里消毒散中剂量)、托里消毒散高剂量组(放疗+托里消毒散高剂量),每组8只,本研究选择在大鼠放疗前12 h禁食。
1.1.2试剂 地塞米松(国药准字H41021255)购自天津药业集团;蒙脱石散(国药准字H20000690)购自博福-益普生天津制药有限公司;干扰素-γ(interferon-γ,IFN-γ)(货号:ZC-36294)、肿瘤坏死因子-α(tumornecrosisfactor-α,TNF-α)(货号:ZC-37624)、白细胞介素-4(interleukin-4,IL-4)(货号:ZC-36402)、IL-10(货号:ZC-36379)、表皮生长因子(epidermal growth factor,EGF)(货号:ZC-36425)、免疫球蛋白A(immunoglobulin A,IgA)(货号:ZC-37000)、IgM(货号:ZC-37006)、IgG(货号:ZC-37002)试剂盒购自上海茁彩生物科技有限公司;TRIzol 试剂RNA提取试剂盒(批号:14105)购自美国Invitrogen公司;PCR扩增试剂盒(批号:AK9906)购自日本TaKaRa公司;TLR4(货号:ab217274)、Myd88(货号:ab2064)、IκBα(货号:ab7217)相关抗体购自英国Abcam公司;NF-κB p65(批号:10745-1-AP)购自美国Proteintech公司;β-actin(批号:MABT825)购自德国Merckmillipore公司;蛋白定量试剂盒(BCA法)购自美国R&D公司。
1.2 大鼠放射性直肠炎模型构建参照文献[5]采用盆腔局部单次大剂量照射的方法建立放射性直肠炎大鼠动物模型。除空白组外的其余大鼠腹腔内注射戊巴比妥钠(50 mg/kg)麻醉。待大鼠肌浅反射消失,完全松弛后,以仰卧体位固定在自制塑料板上,以6MV-X线直线加速器照射。照射范围自耻骨联合至肛门,放射野面积30 cm×20 cm,两侧放空,放疗区覆盖0.5 cm厚补偿膜,源皮距100 cm,开机剂量1 600 mu。照射完毕,等待动物全部苏醒后,送返实验中心继续饲养。空白组小鼠置于相似环境中,但不予照射。以造模后大鼠出现稀便、黏液便或柏油样便判定造模成功。
1.3 药物的制备托里消毒散:生晒参15 g、黄芪30 g、当归15 g、川芎15 g、白芍15 g、炒白术15 g、茯苓30 g、白芷15 g、皂角刺15 g、金银花15 g,炙甘草6 g。方剂来源明代陈实功所著《外科正宗》[6],所有中药均由成都中医药大学附属医院中药房统一采供招标,所有中药均符合国家药典要求。因采用灌肠方式,遂将散剂制备成浓缩汤剂,按组方称取药材,先加372 ml蒸馏水,浸泡30 min,后使用砂锅将其大火煮开,进行第一次煎煮,大火10 min,后小火煮50 min,冷却,过滤,留取滤液;再将煎煮过的药渣放入砂锅,加入930 ml蒸馏水,进行第二次煎煮,大火煮开,持续10 min,后小火煮50 min,冷却,过滤,留取滤液;将第一次煎的滤液和第二次煎的滤液合并放入烧杯,小火加热,进行浓缩,浓缩至93 ml,即含生药2 g/ml溶液。同理,制备含生药1 g/ml和4 g/ml 溶液。冷却,装入密封袋中,4 ℃冷藏备用。地塞米松(天津药业集团,国药准字H41021255)加入蒸馏水稀释至1 mg/ml,蒙脱石散(博福-益普生天津制药有限公司,国药准字H20000690)加入蒸馏水溶解为0.2 g/ml。
1.4 给药方法造模成功后大鼠正常喂养3 d后,开始灌肠,每天灌肠1次,连续10 d。空白组、模型组:生理盐水(0.9% NS)2 ml灌肠;蒙脱石散联合地塞米松组:蒙脱石散(0.2 g/ml)联合地塞米松(1 mg/ml)2 ml灌肠;托里消毒散低剂量组:托里消毒散低剂量(含生药1 g/ml)2 ml灌肠;托里消毒散中剂量组:托里消毒散中剂量(含生药2 g/ml)2 ml灌肠;托里消毒散高剂量组:托里消毒散高剂量(含生药4 g/ml)2 ml灌肠。
1.5 样本采集血样采集:尾静脉抽取4 ml,3 000 r/min低温离心15 min,分离血清,-80 ℃冰箱保存。直肠组织采集:处死所有大鼠,离断大鼠直肠,将直肠分为2部分,距肛门2 cm~1 cm段直肠浸泡于4%的多聚甲醛液体,用于做HE染色检查。距肛门1 cm以下段直肠放入DEPC处理过的1.5 ml EP管中,冻存于-80 ℃冰箱,留待做炎症因子的Wester blot及qRT-PCR检测。
1.6 观察指标
1.6.1体质量变化 给药开始后所有大鼠每隔2 d测体质量1次,观察体质量变化。
1.6.2大鼠直肠直径的检测 大鼠处死后以游标卡尺检测大鼠距肛门1 cm以上大鼠的直肠直径。
1.6.3组织病理学观察 将固定的直肠组织按常规方法制备石蜡切片,HE染色,镜检观察。采用打分法记分放射性直肠炎腺体减少,以大鼠直肠黏膜腺体减少的程度作为评判炎症严重程度的指标:腺体正常为0分,腺体减少<25%为1分,腺体减少≥25%~50%为2分,腺体减少≥50%~75%为3分,腺体减少>75%为4分。
1.6.4ELISA检测血清因子 按照试剂盒说明操作,采用ELISA试剂盒(上海茁彩)检测血清IFN-γ、TNF-α、IL-4、IL-10、EGF水平,检测血清免疫球蛋白IgA、IgM、IgG水平。
1.6.5Western blot检测 用RIPA裂解液从直肠组织中提取总蛋白,以BCA法进行蛋白质定量,并用蛋白上样缓冲液(5×)变性样品,样品于-20 ℃保存备用。使用等量蛋白质上样,选择10%的SDS-PAGE进行分离,分离后的蛋白质转移至PVDF膜上,用5%的脱脂奶粉封闭1 h,封闭结束后按照实验目的结合一抗TLR4、Myd88、IκBα,NF-κB p65,β-actin均按1 ∶500稀释,4 ℃孵育过夜后TBST清洗,然后根据一抗来源选择合适的二抗(1 ∶5 000),室温孵育1 h,TBST清洗,ECL暗室显色。显色后的蛋白使用Bio-Rad全功能成像系统采集图像,Image-ProPlus分析光密度,以β-actin为内参,阴性对照组目标蛋白质相对含量为1,计算各组蛋白质的相对表达量,实验重复3次。
1.6.6qRT-PCR检测 qRT-PCR检测各组直肠组织中TLR4、Myd88、NF-κBp65、IL-6、IL-10 mRNA表达,采用RNA提取试剂盒提取直肠组织总RNA,测定A260和A280吸光度值,电泳确定RNA的完整性后,依据mRNA反转录试剂盒说明,合成cDNA,采用SYBR GreenⅠreal-time PCR的方法检测mRNA的相对表达量,U6作为内参。PCR循环条件为95 ℃、30 s;95 ℃、5 s;60 ℃、30 s;40个循环。记录Ct值,并采用2-ΔΔCt法分析直肠组织TLR4、Myd88、NF-κBp65、IL-6、IL-10 mRNA相对表达水平。
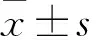
2 结果
2.1 大鼠体质量变化模型组第1、5、7、10天的体质量均低于空白组(P<0.01),与模型组相比,托里消毒散中、高剂量组大鼠体质量明显升高(P<0.05)。见表1。
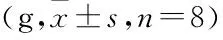
表1 大鼠体质量变化
2.2 大鼠直肠变化
2.2.1大鼠直肠病理组织观察 与空白组比较,模型组直肠组织结构出现不同程度病变,黏膜被覆上皮不同程度变性、脱落、坏死,血管扩张充血、出血,黏膜下层内大量炎性细胞浸润。与模型组比较,蒙脱石散+地塞米松组直肠组织结构较模糊,正常肠腺减少,黏膜下层及肌层细胞坏死,血管充血扩张,伴有轻度出血。托里消毒散低剂量组黏膜上皮缺失,固有层内部分肠腺坏死,结构模糊,间质内毛细血管轻微充血。托里消毒散中剂量组直肠组织结构较完整,黏膜表面被覆单层柱状上皮,固有层内肠腺结构基本正常,排列较稀疏。托里消毒散高剂量组直肠组织结构较完整,固有层内大肠腺排列较为密集,杯状细胞数量正常,间质内少量嗜酸性粒细胞浸润,未见其他明显病理改变。染色结果见图1。

图1 大鼠直肠组织HE染色 ×400A:空白组;B:模型组;C:蒙脱石散+地塞米松组;D:托里消毒散低剂量组;E:托里消毒散中剂量组;F:托里消毒散高剂量组
2.2.2大鼠直肠组织病理炎症评分及直肠直径变化 与空白组相比,模型组直肠炎症评分、直肠直径升高(P<0.01);与模型组相比,托里消毒散中、高剂量组可降低直肠炎症评分及直肠直径(P<0.05)。见表2。
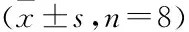
表2 放射性直肠炎炎症评分及直肠直径统计结果
2.3 大鼠血清IFN-γ、TNF-α、IL-4、IL-10、EGF水平与空白组比较,模型组IFN-γ、TNF-α水平升高,IL-4、IL-10、EGF水平降低(P<0.01);经不同处理干预,与模型组比较,托里消毒散高剂量组大鼠血清EGF、IL-4、IL-10水平升高,托里消毒散高剂量组大鼠血清IFN-γ、TNF-α水平降低(P<0.01)。见表3。
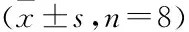
表3 大鼠血清IFN-γ、TNF-α、IL-4、IL-10、EGF水平
2.4 大鼠血清免疫球蛋白IgA、IgM、IgG含量与空白组比较,模型组大鼠血清IgA、IgM、IgG水平降低(P<0.01);经不同处理干预,与模型组比较,托里消毒散高剂量组大鼠血清IgA、IgM、IgG水平升高(P<0.05)。见表4。
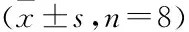
表4 大鼠血清免疫球蛋白IgA、IgM、IgG含量
2.5 大鼠直肠组织TLR4、Myd88、NF-κB p65、IκBα表达Western blot结果显示,模型组较空白组TLR4、Myd88、NF-κB p65、IκBα蛋白表达均升高(P<0.01),经不同处理组干预治疗,托里消毒散中、高剂量组TLR4、Myd88、NF-κB p65、IκBα蛋白表达较模型组均降低(P<0.01)。见图2。
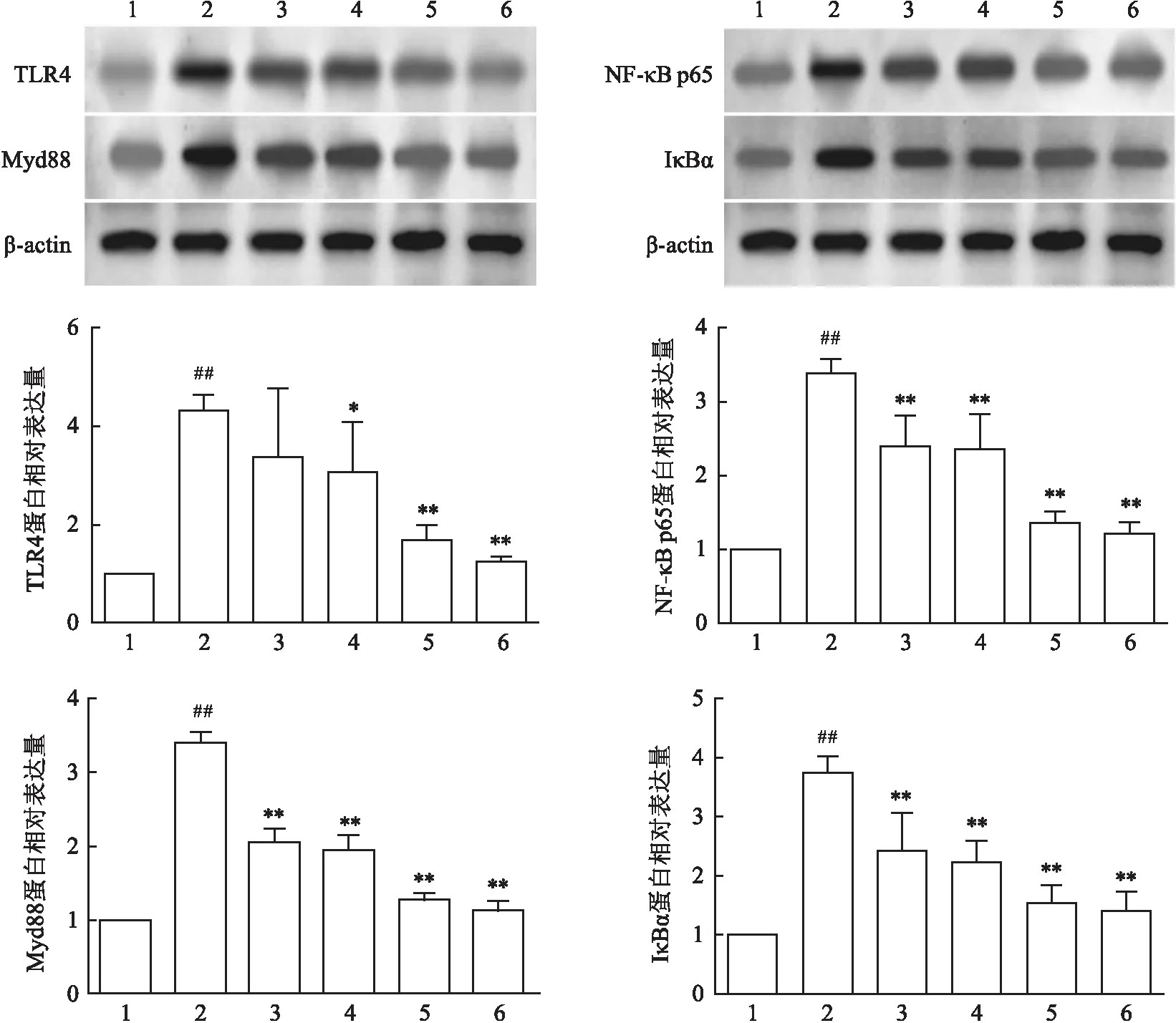
图2 大鼠直肠组织TLR4、Myd88、NF-κB p65、IκBα蛋白表达1:空白组;2:模型组;3:蒙脱石散+地塞米松组;4:托里消毒散低剂量组;5:托里消毒散中剂量组;6:托里消毒散高剂量组;与空白组比较:##P<0.01;与模型组比较:*P<0.05,**P<0.01
2.6 大鼠直肠组织TLR4、Myd88、NF-κB p65、IL-6、IL-10 mRNA表达qRT-PCR结果显示,模型组较空白组TLR4、Myd88、NF-κB p65、IL-6 mRNA表达升高,IL-10 mRNA表达降低(P<0.01);经不同处理组干预治疗,仅托里消毒散高剂量组TLR4、Myd88、NF-κBp65、IL-6 mRNA表达较模型组均降低,IL-10 mRNA表达升高(P<0.01)。见表5。
表5 大鼠直肠组织TLR4、Myd88、NF-κB p65、IL-6、IL-10 mRNA表达
3 讨论
RIP极大地降低了接受前列腺癌、子宫颈癌、直肠癌或膀胱癌放射治疗患者的生活质量,目前的治疗往往不能减轻与RIP相关的疼痛和不适。中药副作用及刺激性较小,可集中治疗放射损伤和炎症后的RIP,保护胃肠道,将显着提高患者的生活质量[7]。
淋巴细胞是受照射组织在急性期和慢性期白细胞侵袭的常见成分。已有研究表明结肠中可见的活化T细胞的持续浸润与黏膜损伤相关,T细胞能够分化为不同的效应T细胞亚群(Th1/Th2/Th17和Treg),Th1/Th2亚群的免疫失衡已被证明在许多炎症性肠道疾病中起决定性作用,并可能参与放射性损伤的慢性化。然而,几乎没有可用于表征局部照射后T细胞亚群的数据[8]。已经证明定位于结肠直肠的分次照射诱导Th2特异性转录因子的表达。此外,在缺乏Th1的环境中进行肠道照射会加速纤维化过程的发生[9]。同时,研究[10]显示Th1细胞主要产生的促炎因子IFN-γ能够调节肠上皮细胞表面受体功能,抑制Th2细胞的增殖,引起组织损伤;而Th2细胞主要分泌的抑炎因子IL-4和IL-10,可抑制Th1细胞的增殖,使炎症局限化,因此,Th1/Th2的平衡是调控细胞免疫和体液免疫之间的平衡的关键。EGF可促进细胞生长及对表皮细胞和成纤维细胞趋化作用,使其迁移到受损部位,在创面愈合过程中起着重要的作用。免疫球蛋白IgG、IgM在机体出现炎症及损伤时是介导体液免疫反应的主要因子,在机体抵抗疾病的过程中发挥着至关重要的功能,其含量的高低是衡量机体防御功能的重要指标[11]。因此,IgA、IgM、IgG含量的检测可以作为判断病情的有力证据。本实验结果显示,与空白组比较,模型组大鼠TNF-α、IFN-γ、IgA、IgM、IgG含量增加,而IL-4、IL-10、EGF含量呈降低(P<0.01);干预治疗后,仅托里消毒散高剂量组TNF-α、IFN-γ、IgA、IgM、IgG含量降低,IL-4、IL-10、EGF含量增加(P<0.05)。表明托里消毒散高剂量可使Th1/Th2平衡向Th1方向移动,并影响免疫球蛋白表达从而影响炎症损伤。
TLR4/NF-κB信号通路与炎症反应密切相关。TLR4在天然免疫中识别病原微生物和控制获得性免疫反应中起着重要的作用,TLR4被激活后衔接蛋白MyD88进行信号传导,促使一些细胞因子产生,加重肠道炎症[12]。研究[13]证实TLR4基因缺陷小鼠的结肠固有层中有少量的炎症浸润,而未敲除TLR4基因的小鼠则有严重的肠道炎症,当细胞质中的TLR4结构域与MyD88羧基端结合引起MyD88大量募集下游蛋白后,NF-κB炎症通路被激活,NF-κB的激活是肠道炎中炎症反应激活和增殖的关键步骤。此外,大量临床研究也表明应用 NF-κB p65寡核苷酸可明显降低黏膜中NF-κB p65和细胞因子的表达,改善临床症状的严重程度,因此,NF-κB在炎症发展中起着关键性的作用。激活NF-κB信号通路会促进大量的炎症介质如 TNF-α、IL-6等表达,而这些炎性介质又进一步活化 NF-κB,形成一个正反馈循环,使炎症反应不断放大,加重肠道炎症反应和黏膜的损伤[14]。IL-6是由各种细胞产生的促炎细胞因子并发挥多效性作用[15]。本试验结果显示,模型组较空白组有大量的TLR4、Myd88、NF-κB p65、IL-6表达,给予托里消毒散治疗后,托里消毒散中、高剂量组TLR4、Myd88、NF-κB p65、IL-6表达降低(P<0.05)。表明托里消毒散可减轻局部炎症反应表现,通过抑制NF-κB的激活,进一步降低炎性介质IL-6的表达。
综上,托里消毒散随剂量增加可改善放射性直肠炎大鼠的直肠组织病理学改变,对TLR4/NF-κB信号通路相关因子及炎性细胞因子的表达均具有一定作用,表明托里消毒散对放射性直肠炎的作用机制可能与TLR4/NF-κB有关。
