二维斑点追踪评估急性心肌梗死患者经皮冠状动脉介入术后左室收缩功能
2020-10-15陈媚聪马静丽陈文忠黄灿辉
陈媚聪 马静丽 陈文忠 黄灿辉 尚 利
急性心肌梗死(acute myocardial infarction,AMI)是冠状动脉内不稳定斑块脱落形成血栓造成的急性心肌缺血、坏死,患者主要表现为持续性胸痛,极易发生心源性休克,进而发生猝死或严重预后不良事件[1]。及时治疗能恢复冠状动脉血管通畅,有效缩小梗死面积,帮助恢复心肌功能。经皮冠状动脉介入(percutaneous coronary intervention,PCI)是AMI患者最有效的心肌再灌注治疗手段,能迅速开通梗死血管、重建血运,改善心肌缺血缺氧状态,逐渐恢复收缩功能,进而提高整体心功能,改善患者临床症状和预后[2]。早期准确识别AMI患者梗死心肌治疗后的变化和心室整体收缩功能的改变对评估患者心功能和预后均有重要价值。二维斑点追踪(two-dimensional speckle tracking echocardiography,2D-STE)技术能准确反映患者心肌运动变化和心肌收缩功能改变,不易受心肌运动和周围组织牵拉的影响,是一种较好的定量分析方法[3]。本研究应用2D-STE 检测AMI 患者PCI 术后心肌应变参数,探讨其在AMI 患者左室收缩功能和预后评估中的应用价值。
资料与方法
一、研究对象
选取2018 年1 月至2019 年8 月在我院接受急诊PCI 治疗的AMI 患者84 例,男53 例,女31 例,年龄41~70岁,平均(58.16±11.83)岁;其中糖尿病32例,高血压病46例;单支病变38例,双支病变32例,三支病变14例;所有患者均经冠状动脉造影证实狭窄程度>75%。纳入标准:①均经临床、冠状动脉造影及心肌酶学确诊为AMI并明确冠状动脉闭塞部位;②初诊为AMI,既往无AMI 病史或合并其他心脏瓣膜、先天性心脏病;③临床诊治及随访资料完整,超声图像质量满意。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.仪器:使用GE Vivid E 9 彩色多普勒超声诊断仪,S5-1探头,频率l~5 MHz。
2.方法:所有患者均于发病12 h 内行PCI,包括经皮冠状动脉腔内成形术和支架置入术,并于PCI 术后3 d、1 个月、3 个月、6 个月行2D-STE。患者取仰卧位,常规连接心电图,于胸骨旁左室长轴切面测量左室舒张末期内径(LVDd)和左室收缩末期内径(LVDs),于心尖部四腔心切面测量左室舒张末期容积(LVEDV)和左室收缩末期容积(LVESV),采用双平面Simpon 法测量左室射血分数(LVEF);所有参数均测量3 次取平均值。然后在静息状态下点击动态采图,记录心尖四腔、心尖三腔、心尖两腔观3 个连续、稳定的心动周期动态图像。应用ECho PAC BT12工作站脱机分析左室基底段、中间段、心尖段的纵向应变(LS)-时间曲线、径向应变(RS)-时间曲线及圆周应变(CS)-时间曲线。根据冠状动脉造影结果及冠状动脉供血与室壁节段的关系,记录罪犯血管支配的梗死节段心肌的LS、RS 及CS,所有测值取3 个心动周期的平均值。
所有患者均随访6 个月,随访内容包括心功能检查指标和不良结局情况,随访终点为不良预后事件发生,包括PCI 后再发AMI、再发心力衰竭或死亡。根据是否发生预后不良事件分为预后良好组51 例和预后不良组33例,比较两组患者临床及超声检查资料。
3.重复性检验:从84 例患者中随机选取10 例,由两位医师分别进行心肌应变参数分析,计算观察者间变异系数。1周后,由其中1位医师再次进行心肌应变参数分析,计算观察者内变异系数。
三、统计学处理
应用SPSS 22.0统计软件,计量资料以xˉ±s表示,组间两两比较行t 检验;计数资料以例表示,行χ2检验。心肌应变参数差值(ΔLS、ΔRS、ΔCS)与LVEF 的相关性采用Pearson 相关分析法。采用多因素Logistic 回归分析影响患者预后的不良因素。重复性检验采用组内相关系数分析。绘制受试者工作特征(ROC)曲线计算LS、RS、CS评估AMI不良预后的曲线下面积(AUC)。P<0.05为差异有统计学意义。
结 果
一、AMI患者PCI术后各超声心动图指标比较
AMI 患者PCI 术后1 个月、3 个月、6 个月LVDd、LVDs、LVEDV、LVESV 均低于术后3 d(均P<0.05),且术后3 个月、6 个月LVEDV 和LVESV 均低于术后1 个月(均P<0.05)。LVEF 在PCI术后各时间点逐渐升高,差异均有统计学意义(均P<0.05)。见表1。
二、AMI患者PCI术后各应变参数比较
AMI 患者LS、RS、CS 在PCI 术后各时间点均逐渐升高,差异均有统计学意义(均P<0.05)。见表2和图1。

表1 AMI患者PCI术后不同时间超声心动图指标比较(x±s)

表2 AMI患者PCI术后不同时间应变参数比较(x±s) %

图1 AMI患者术后不同时间2D-STE图
三、AMI 患者各应变参数差值与LVEF 的相关性分析
Pearson 相关分析显示,ΔLS、ΔRS、ΔCS 与LVEF均呈正相关(r=0.759、0.682、0.762,均P<0.05)。
四、预后良好组与预后不良组临床及超声检查资料比较
84 例患者中,预后良好组51 例,预后不良组33 例(包括死亡3例,再发AMI 16例,再发心力衰竭14例)。两组冠状动脉病变范围、LVEDV、LVESV、LVEF、LS、RS、CS比较,差异均有统计学意义(均P<0.05)。见表3。
五、Logistic回归分析
多因素Logistic 回归分析显示,冠状动脉病变范围、LVEF、LS、RS、CS均是患者不良预后的独立影响因素(均P<0.05)。见表4。

表3 预后良好组与预后不良组临床及超声检查资料比较
六、ROC曲线分析
LS、RS、CS 评估AMI 患者不良预后的诊断效能见表5和图2。
七、重复性检验
观察者间与观察者内LVDd、LVDs、LVEDV、LVESV、LVEF、LS、RS、CS的变异系数见表6。

表4 影响AMI患者不良预后的多因素Logistic回归分析
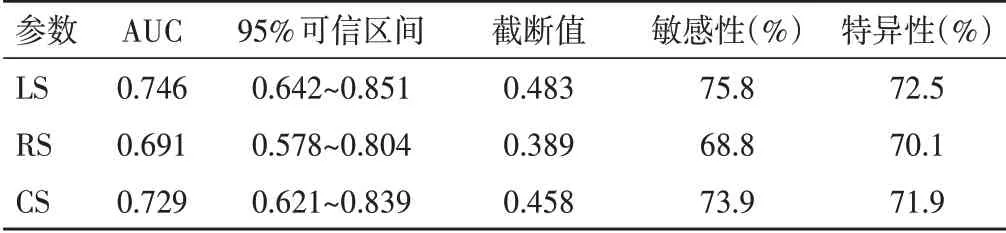
表5 各应变参数对AMI不良预后评估的诊断效能

图2 各应变参数评估AMI患者不良预后的ROC曲线图
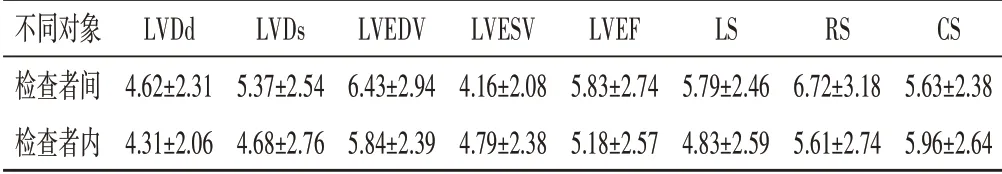
表6 检查者间与检查者内各超声检查参数的变异系数 %
讨 论
AMI 是由于冠状动脉急性、持续性缺血缺氧所引起的心肌坏死,属于急性冠状动脉综合征的一种严重类型,是导致患者猝死的重要原因[4]。AMI 患者发病时相应心肌运动功能急剧下降,最终导致整体心功能下降,而冠状动脉急性闭塞至心肌完全坏死需一定时间,在该时间段内及时再通血管,可有效挽救濒死的缺血心肌[5]。PCI 是AMI 患者最有效的心肌再灌注治疗方式,能快速改善发生狭窄或梗死的血管状态,重建血运,改善心肌缺血和微循环灌注,有效控制梗死范围[6]。
心肌纤维呈现多重交织层叠的特殊排列结构,与左室心肌运动和收缩功能密切联系[7]。心肌收缩运动时,不仅基底部至心尖部心肌纤维缩短、心外膜至心内膜心肌纤维增厚,且圆周层面心肌会缩短,产生旋转运动和扭转运动[8]。2D-STE 通过对应变-时间曲线进行梗死心肌节段,综合评价心肌纵向、圆周、径向的变形运动能力[9]。本研究结果显示,AMI 患者PCI术后LS、RS、CS 均逐渐升高,差异均有统计学意义(均P<0.05)。原因可能是心肌梗死发生后心肌缺血缺氧导致心肌形变能力下降,经PCI 治疗后AMI 患者血运重建,部分冬眠或顿抑心肌逐渐恢复,心肌节段纵向、径向及圆周运动同步性恢复,患者的心肌收缩运动和心功能得以改善。同时也说明2D-STE 能有效评价左室收缩功能变化[10-11]。 Woo 等[12]研究显示,AMI 患者在PCI 术后圆周、径向等容收缩期加速度较术前明显升高,认为心脏室壁节段性运动异常的恢复是心肌缺血缺氧状态改善和心肌收缩功能恢复的早期敏感指标,与心室整体收缩功能恢复的一致性良好。本研究中,AMI 患者术后3 d、1 个月、3 个月、6 个月的各应变参数差值ΔLS、ΔRS、ΔCS 与LVEF 均呈正相关(均P<0.05),提示2D-STE 中LS、RS、CS 参数对评估左室整体收缩功能的恢复及心功能的改善均有较高价值,有望成为评估AMI 患者不良预后的指标。
AMI 患者行PCI 术后,心肌缺血缺氧的状态可以改善,使原先因低血流灌注状态下而表现为冬眠或顿抑的心肌被重新唤醒利用,逐渐恢复收缩功能,进而提高整体心功能、改善患者的临床症状及预后[13]。2D-STE 克服了组织成像技术的角度依赖性,可自动追踪二维图像同一部位心肌回声斑点的运动轨迹,并通过软件计算出斑点的运动参数,能准确反映心肌运动速度和变化,定量检测患者左室各节段心肌的收缩功能,无需几何形态假设,可更全面地评价心脏收缩功能变化[14]。本研究通过重复性检验证实应用2DSTE 测量LS、RS、CS 应变参数的组间和组内变异系数均较小,可重复性较好。
本研究还对影响AMI患者PCI术后发生不良预后的因素进行分析,发现冠状动脉病变范围、LVEF、LS、RS、CS均是患者预后的独立影响因素。进一步对2DSTE 各应变参数行ROC 曲线分析显示,LS、CS 的AUC均>0.7,提示其是评估AMI 预后的较好指标,与洪玮等[15]研究结论一致,表明LS、CS 应变参数有助于全面、准确评价AMI患者PCI术后左室收缩功能的变化,并能有效预测患者预后,对评估术后疗效和预后有重要临床意义。
综上所述,2D-STE 可客观反映AMI患者PCI术后左室收缩功能的变化,能为患者预后评估提供重要依据,具有较好的临床应用价值。
