载10-羟基喜树碱液态氟碳靶向纳米粒的制备及体外双模态成像
2020-10-15程武松陈洪波游玉峰
程武松 陈洪波 游玉峰
近年来,多功能超声分子对比剂的研究发展迅速,因其可携带针对肿瘤位点的分子探针及药物对肿瘤进行精准定位、靶向释药,提高病灶局部的药物浓度,实现多种模式下的成像,如超声、CT、MRI、PET 等,为解决肿瘤早期显像、靶向治疗及肿瘤耐药等关键问题提供了新的思路。本实验拟制备一种载羟基喜树碱(10-HCPT)化疗药物的高分子纳米粒,其内包裹液态氟碳(PFOB),同时表面连接cRGD 肽,靶向人卵巢癌SKOV-3 细胞,旨在探讨纳米分子探针的体外靶向性及超声/CT 双模态成像效果,为卵巢癌的早发现、早诊断及精准治疗探索一种新的方法。
材料与方法
一、主要实验试剂
羧基端乳酸/羟基乙酸共聚物(PLGA-COOH,分子量为12 000,聚合比50∶50,济南岱罡生物工程有限公司);全氟溴辛烷(PFOB,日本TCI 公司);10-HCPT(成都兰贝植化科技有限公司);绿色荧光染料(FITC)标记环八肽cRGD(中国强耀生物有限公司);EDC/NHS、DiI、DAPI染色剂(美国Sigma公司);MES缓冲液(美国Sigma 公司);二氯甲烷(成都市科隆化学品有限公司);聚乙二醇(PVA,美国Sigma 公司);异丙醇(重庆川东化工有限公司);人卵巢癌SKOV-3 细胞株(武汉普诺赛生命科技有限公司细胞库);磷酸缓冲盐溶液(PBS,重庆惠利生物科技有限责任公司)。
二、主要实验仪器
光学显微镜(IX71,日本Olympus 公司);透射电子显微镜(H 7600,日本日立公司);扫描电子显微镜(JEOLEM 7800 F,日本JEOL 公司);共聚焦显微镜(A1R,日本Nikon 公司);流式细胞仪(美国贝克曼库尔特公司);马尔文粒径分析仪(Zeta Sizer 3000,英国Malvern 有限公司);紫外分光光度计(UV 2550,日本Shimadzu 公司);声振仪(美国Sonics Materials 公司);百胜MyLab 90 彩色多普勒超声诊断仪,LA523 线阵探头,频率4~10 MHz;CT 成像系统(荷兰Philips 公司);DFY 型超声图像定量分析诊断仪(重庆医科大学超声影像学研究所)。
三、实验方法
1.PLGA@10-HCPT-PFOB 非靶向纳米粒的制备:采用乳化法称取PLGA-COOH 100 mg、10-HCPT 4 mg置于50 ml 离心管,加入2 ml 二氯甲烷和2 ml 甲醇(分散相),常温震荡至完全溶解,然后置于超声波清洗仪中充分混均,加入200 μl PFOB 再次震荡混匀。在冰浴条件下声振仪声振6 min(100 W,间歇5 s 模式),加入10 ml 4%PVA 溶液(连续相)在旋涡器中震荡数秒,声振仪声振4 min(60 W,间歇5 s 模式),加入2%异丙醇溶液10 ml,将上述溶液移至放有磁珠的50 ml 烧杯中,室温下搅拌4 h,使二氯甲烷及甲醇充分挥发,经去离子水离心、洗涤3 次(8000 r/min,8 min),获得PLGA@10-HCPT-PFOB 非靶向纳米粒。制备过程中全程避光,在制备上述纳米粒时加入DiI 荧光标记物,制备非靶向荧光标记的载药纳米粒。使用上述相同方法制备PLGA@10-HCPT和PLGA@PFOB纳米粒。
2.cRGD-PLGA@10-HCPT-PFOB靶向纳米粒的制备:通过碳二亚胺法连接cRGD肽,将PLGA@10-HCPTPFOB 纳米粒分散溶解于适量MES 缓冲液(0.1 mol/L,pH 值5.5),以EDC与NHS质量比1∶3、PLGA 与EDC摩尔比1∶10先后加入零长度偶联活化剂EDC/NHS,冰浴条件下震荡孵育40 min,多次洗涤、离心后复溶于MES缓冲液(0.1 mol/L,pH 值8.0);加入一定量cRGD 肽(cRGD 与PLGA 摩尔比为1∶1),冰浴条件下震荡孵育过夜;多次离心、洗涤,获得靶向纳米粒cRGD-PLGA@10-HCPT-PFOB,溶于2 ml去离子水中,4℃保存。
3.cRGD-PLGA@10-HCPT-PFOB 靶向纳米粒的表征观察:使用光学显微镜、扫描电子显微镜及透射电子显微镜观察靶向载药纳米粒的大小及分布情况;将稀释后的纳米粒混悬液置于硅片干燥过夜,使用扫描电子显微镜观察纳米粒的外部形态;将样品滴于铜网上,自然干燥成膜,使用透射电子显微镜观察靶向纳米粒的内部结构;马尔文粒径分析仪测量cRGD-PLGA@10-HCPT-PFOB纳米粒的粒径大小和表面电位。
4.cRGD 肽与纳米粒连接情况的检测:制备靶向纳米粒时加入DiI 荧光标记物获得红色荧光标记的靶向纳米粒,使用共聚焦显微镜检测红色荧光染料标记的纳米粒与FITC 标记的cRGD 的连接情况;流式细胞仪测 量PLGA@10-HCPT-PFOB、cRGD-PLGA@10-HCPT-PFOB纳米粒FITC荧光强度。
5.10-HCPT 包封率和载药量测定:配置不同浓度的10-HCPT 溶液,以紫外分光光度计测量其吸光度并绘制标准曲线,通过标准曲线计算包封率和载药量。
6.体外评估cRGD-PLGA@10-HCPT-PFOB 纳米粒的靶向性:体外培养人卵巢癌SKOV-3 细胞,取对数生长期细胞,以每孔1×105的密度接种于共聚焦培养皿,培养24 h,分为靶向纳米粒组、非靶向纳米粒组及拮抗组,纳米粒浓度均为1 mg/ml。靶向纳米粒组:每个培养皿加入1 ml 经DiI 染色标记的靶向纳米粒;非靶向纳米粒组:每个培养皿加入1 ml 经DiI 染色的非靶向纳米粒;拮抗组:每个培养皿加入足量游离cRGD 肽后,再加入1 ml 经DiI 染色标记的靶向纳米粒,将3 组纳米粒与SKOV-3 细胞在37℃孵箱内分别孵育1 h、2 h、4 h,用4%多聚甲醛1 ml 固定15 min,PBS 冲洗3次,加入DAPI 染色剂对细胞核进行染色。15 min 后PBS 冲洗3次,于共聚焦显微镜下观察3 组纳米粒与细胞的结合情况。在上述共聚焦培养皿中加入0.25%胰酶对细胞消化后收集到15 ml 的EP 管中,低温离心机离心5 min(1000 r/min)。使用PBS 将离心后的细胞稀释至500 μl,使细胞悬浮于其中送流式细胞仪检测DiI 的荧光强度。
7.体外超声及CT 成像:①体外超声成像。将cRGD-PLGA@10-HCPT-PFOB靶向纳米粒配制成浓度为100.00 mg/ml、75.00 mg/ml、50.00 mg/ml、25.00 mg/ml、12.50 mg/ml、6.25 mg/ml的溶液(实验组),各取200 μl加入SKOV-3细胞悬浮液中,然后将其置于琼脂凝胶模型中,以PBS为对照组,观察各组二维超声图像。②体外CT成像。将cRGD-PLGA@10-HCPT-PFOB 靶向纳米粒配制成浓度为100.00 mg/ml、75.00 mg/ml、50.00 mg/ml、25.00 mg/ml、12.50 mg/ml、6.25 mg/ml 的溶液(实验组),各取200 μl 置于EP 管中,以PBS 为对照组,在CT成像系统中成像,并利用自带软件测量各组纳米粒的CT 值。
四、统计学处理
应用SPSS 24.0统计软件,符合正态分布的计量资料以±s 表示,不同浓度纳米粒实验组和对照组的声强值及CT值比较采用单因素方差分析,两两比较采用SNK法。P<0.05为差异有统计学意义。
结 果
一、cRGD-PLGA@10-HCPT-PFOB 靶向纳米粒的表征
靶向纳米粒外观呈黄色混悬液,稳定性好;光学显微镜下形态规则、大小均一(图1A);扫描电镜下纳米粒外观呈球形,表面光滑(图1B);透射电镜下纳米粒呈核壳结构(图1C);其平均粒径为(322.03±5.34)nm,平均表面电位为(-1.55±0.10)mV。
二、cRGD 肽与PLGA@10-HCPT-PFOB 非靶向纳米粒的连接情况
共聚焦显微镜下FITC 标记的cRGD 肽呈绿色荧光(图2A),DiI染色标记的纳米粒呈红色荧光(图2B),两者融合呈橙黄色荧光(图2C);流式细胞仪检测PLGA@10-HCPT-PFOB 非靶向纳米粒FITC 绿色荧光强度为0.78%,cRGD-PLGA@10-HCPT-PFOB 靶向纳米粒FITC绿色荧光强度为80.76%。

图1 cRGD-PLGA@10-HCPT-PFOB靶向纳米粒的表征

图2 共聚焦显微镜下cRGD肽与PLGA@10-HCPT-PFOB非靶向纳米粒的连接情况(×400)
三、10-HCPT的包封率和载药量测定
绘制10-HCPT标准曲线,在波长为268 nm、372 nm处出现吸收峰,将波长设定在372 nm,10-HCPT 的包封率为(81.34±2.28)%,载药量为(13.24±1.24)%。
四、纳米粒的体外靶向性
纳米粒经DiI 染色后呈红色荧光,SKOV-3 细胞核经DAPI 染色后呈蓝色荧光。靶向纳米粒组显示SKOV-3 细胞周围见大量红色荧光,即经过DiI染色后的纳米粒被SKOV-3 细胞靶向结合并吞噬;而非靶向纳米粒组和拮抗组仅见少量红色荧光与细胞结合,荧光强度明显低于靶向纳米粒组,且随着孵育时间的延长,靶向纳米粒组荧光强度增强更明显(图3)。流式细胞仪检测示靶向纳米粒组DiI 荧光强度明显高于非靶向组和拮抗组,且随着孵育时间的延长,靶向纳米粒组DiI荧光强度明显增强,而非靶向纳米粒组和拮抗组随着孵育时间的延长荧光强度无明显变化(表1)。
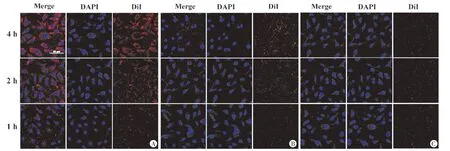
图3 共聚焦显微镜下靶向纳米粒组(A)、非靶向纳米粒组(B)及拮抗组(C)不同孵育时间的连靶情况(×400)
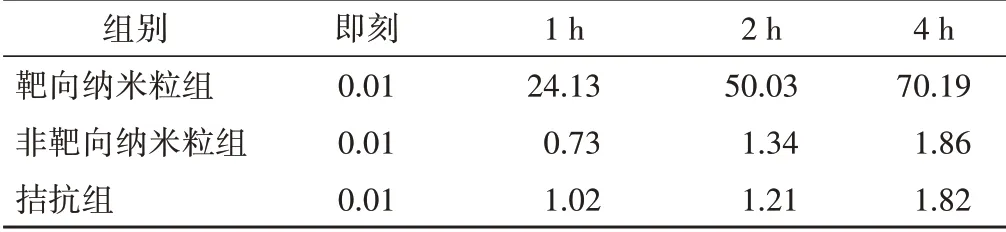
表1 流式细胞仪检测各组不同孵育时间人卵巢癌SKOV-3细胞DiI的荧光强度
五、cRGD-PLGA@10-HCPT-PFOB 靶向纳米粒的体外超声/CT成像
随着靶向纳米粒浓度增加,实验组二维超声图像声强值均逐渐增强,对照组的回声均低于不同浓度纳米粒实验组(图4)。6.25 mg/ml、12.50 mg/ml、25.00 mg/ml、50.00 mg/ml、100.00 mg/ml 的靶向纳米粒声强分别为(6.28±0.12)dB、(11.36±0.21)dB、(17.21±0.16)dB、(28.64±0.28)dB、(58.26±0.19)dB,组间比较差异有统计学意义(P<0.001),不同浓度靶向纳米粒各实验组声强值均高于对照组(均P<0.05),且各实验组间两两比较差异均有统计学意义(均P<0.05)。
随着靶向纳米粒浓度增加,实验组CT 成像的CT值均逐渐增强,对照组的CT值均低于不同浓度纳米粒各实验组(图4)。6.25 mg/ml、12.5 mg/ml、25.00 mg/ml、50.00 mg/ml、100.00 mg/ml 的 纳 米 粒CT 值 分 别 为(42.16±2.16)Hu、(73.27±3.23)Hu、(100.20±1.98)Hu、(135.87±3.12)Hu、(217.53±2.29)Hu,对照组CT 值为(3.23±0.24)Hu,组间比较差异有统计学意义(P<0.001),不同浓度纳米粒各实验组CT值均高于对照组,差异均有统计学意义(均P<0.05),且各实验组间两两比较差异均有统计学意义(均P<0.05)。
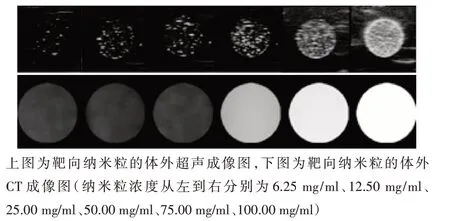
图4 靶向纳米粒的体外超声和CT成像图
讨 论
多模态多功能超声造影剂的制备已成为当前肿瘤诊疗一体化的研究热点,以超声成像优势为基础,联合CT、MRI、PET 及光学等成像优势,可准确获取病变部位的医学生物学信息,在医学可视化成像下实现局部靶向释药[1]。虽然目前诊疗一体化造影剂的研究取得了新的进展,但向临床转化仍存在很多亟需解决的问题[2]。因此,提高纳米粒的靶向性是诊疗一体化造影剂的基础,在此基础上可实现多模态成像下不同治疗方式的联合治疗。本实验选择靶向效率相对较高的主动靶向性,采用临床常见的超声和CT成像模式在PFOB 改善肿瘤缺氧微环境下进行化学治疗,实现高效的诊疗一体化造影剂的制备。
研究[3]表明,整合素αvβ3 在卵巢癌新生血管内皮细胞和肿瘤细胞上均呈高表达,而在正常血管内皮细胞和组织中无表达或呈极低表达。因此,整合素αvβ3是人卵巢癌SKOV-3 细胞理想的靶点之一。cRGD 肽是一种能够与整合素αvβ3 受体特异性结合的环状八肽[4]。本实验通过碳二亚胺法将cRGD 肽的氨基与PLGA 的羧基通过稳定的肽键相连,在共聚焦显微镜下观察标记绿色荧光的cRGD 肽与标记红色的PLGA纳米粒两者融合为橙黄色,流式细胞仪测定PLGA@10-HCPT-PFOB 非靶向纳米粒表面cRGD 肽连接率达80.76%,表明cRGD 肽成功连接到PLGA@10-HCPTPFOB 非靶向纳米粒表面。在体外靶向实验中,共聚焦显微镜下靶向纳米粒组有大量cRGD-PLGA@10-HCPT-PFOB 靶向纳米粒被卵巢癌SKOV-3 细胞识别并摄取,即使经过PBS 反复冲洗,仍可紧密结合,红色荧光强度明显高于非靶向纳米粒组和拮抗组,且随着孵育时间的延长,荧光强度增强。流式细胞仪也得出类似结果,表明人卵巢癌SKOV-3 细胞对cRGDPLGA-10-HCPT-PFOB 靶向纳米粒有较高的靶向结合能力。
应用高分子聚合物制备的纳米粒外壳抗压性强,在较高机械指数下仍然很稳定,延长了血液循环时间[5]。使用PLGA-COOH 制备的纳米粒通过稳定的化学键与其特异性配体(如抗体、肽类等)连接,形成具有主动靶向能力的纳米粒。本实验通过碳二亚胺法将cRGD 肽侧链的上氨基与PLGA-COOH 羧基形成稳定的肽键,从而使纳米粒具有靶向性。PFOB 是全氟化碳化合物中的一种,其化学性质稳定,具有良好的携氧能力,故其在新型造影剂、靶向药物载体、临床治疗等领域已广泛应用[6-8]。由于PFOB 的沸点较高,不易发生相变,其实现超声分子成像的原理主要通过聚集显影,当纳米粒在病灶处大量聚集时,靶区会产生明显增强的回声信号,信噪比提高[9]。在本实验体外实验中,靶向纳米粒加入人卵巢癌SKOV-3 细胞混悬液后,通过聚集显影明显增强超声成像。也有研究[10-11]证实,PFOB 不仅可作为超声造影剂,还能作为CT/MRI造影剂,从而实现多模态成像。本实验发现随着纳米粒浓度的增加,其CT 值不断增强,进一步证明了PFOB 被包裹于纳米粒中。实体肿瘤微环境往往处于缺氧状态,被认为是限制肿瘤治疗效果的重要原因之一[12]。Zhang 等[7]研究团队成功制备PFOB@LIPIR780 纳米粒,不仅能增强CT 成像,还能利用PFOB 良好的携氧能力改善肿瘤缺氧微环境,从而提高IR780的光动治疗和光热治疗的疗效。Song 等[12]制备的PFOB 纳米粒在超声作用下促进PFOB 携载氧气的释放,改善了肿瘤的缺氧环境,增强了放射治疗和光动力治疗效果。Huang 等[13]研究认为,通过增加局部氧供能够有效缓解肿瘤组织缺氧,提高化疗药物的疗效,有助于减轻缺氧诱导相关的化疗药物耐药。因此,在纳米粒中引入PFOB不仅增强了多模态成像,还可以改善肿瘤缺氧的微环境,从而提高抗肿瘤治疗效果。
本实验选择的广谱抗肿瘤化疗药物10-HCPT 作用机制是通过抑制拓扑异构酶Ⅰ,抑制肿瘤细胞DNA的复制[14],但其半衰期短、细胞毒性大、羟基内酯环结构不稳定,临床应用受限[15]。但是,10-HCPT 可被包裹于高分子PFOB 纳米粒中,且单次注射量远低于其他抗肿瘤化疗药物,增加了靶向释药的可控性和安全性[16]。PLGA 包裹10-HCPT 后能够保护其内酯环结构,从而提高药物活性[17]。本实验将10-HCPT成功地携载于PFOB 纳米粒中,药物包封率较高,为(81.34±2.28)%,既克服了10-HCPT 自身稳定性和水溶性差、毒副作用大、半衰期短等缺点,又解决了载药纳米粒靶向治疗中剂量限制的问题。
综上所述,本实验成功制备cRGD-PLGA@10-HCPT-PFOB 靶向纳米粒,其形态规则,大小为纳米级,能够穿过肿瘤血管内皮细胞间隙,且具有较高的10-HCPT 包封率和载药量;在体外寻靶实验中,该靶向纳米粒对人卵巢癌SKOV-3 细胞具有良好的主动靶向性,可增强超声/CT 双模态成像。但本实验未评价该纳米粒的体外安全性和治疗作用,本课题组后期将进一步行相关实验以为体内可视化治疗提供理论依据。
