黄芪甲苷改善人内皮祖细胞生物学功能的实验研究
2020-10-14蔡昫邹晓玲王禹萌余亦程兰宏伟郭娟王婷婷熊武
蔡昫 邹晓玲 王禹萌 余亦程 兰宏伟 郭娟 王婷婷 熊武

〔摘要〕 目的 探讨黄芪甲苷(Astragaloside IV,AS-IV)对人内皮祖细胞(endothelial progenitor cells,EPCs)生物学功能的影响,为深入研究AS-IV调节EPCs介导的血管新生的作用机制奠定基础。方法 取足月健康新生儿脐带血,采用密度梯度离心法分离得到单个核细胞,经传代培养,采用CD31抗体联合DAPI核染以及FITC-UEA-I和 Dil-ac-LDL双荧光染色法鉴定EPCs 。将鉴定成功的EPCs随机分为实验组和对照组,实验组采用100 mg/L的AS-IV干预,对照组用等容量的PBS液处理,两组细胞培养24 h后,通过CCK-8细胞增殖检测试剂盒、黏附能力测定试验、细胞划痕试验及Matrigel体外成血管试验观察AS-IV对EPCs增殖、黏附、迁移和成管功能的影响。结果 与对照组相比,实验组细胞增殖的OD值增大,细胞黏附数增多,细胞遷移宽度增加(即细胞迁移率增大),体外成管数增多,差异均有统计学意义(P<0.05)。结论 黄芪甲苷能改善体外人EPCs的生物学功能,具有调节EPCs介导血管新生的潜能。
〔关键词〕 黄芪甲苷;内皮祖细胞;生物学功能;血管新生
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.01.008
〔Abstract〕 Objective To explore the effects of Astragaloside IV (AS-IV) on the biological function of human endothelial progenitor cells (EPCs), and to lay a foundation for further study of the mechanism of AS-IV regulating EPCs-mediated angiogenesis. Methods Umbilical cord blood was collected for full-term healthy newborns, and the mononuclear cells were separated by density gradient centrifugation method. After subculture, CD31 antibody combined with DAPI staining identification, and double staining identification of FITC-UEA-I and Dil-ac-LDL were adopted to identify EPCs. The successfully identified EPCs were randomly divided into an experimental group and a control group. The experimental group was treated with 100 mg/L Astragaloside IV and the control group was treated with the same amount of PBS solution. After 24 hours of cell culture, the effects of AS IV on EPCs proliferation, adhesion, migration and tube formation were observed by CCK-8 cell proliferation kit, adhesion ability assay test, cell scratch test and Matrigel angiogenesis test in vitro. Results Compared with the control group, the OD value of cell proliferation, the number of cell adhesion, the width of cell migration (namely cell migration rate) and the number of tubes formed in vitro increased in the experimental group, with significant difference (P<0.05). Conclusion Astragaloside IV can improve the biological function of human EPCs in vitro and has the potential to regulate the angiogenesis mediated by EPCs.
〔Keywords〕 Astragaloside IV; endothelial progenitor cells; biological function; angiogenesis
内皮祖细胞(endothelial progenitor cells,EPCs)是一类具有游走特性的能自我增殖更新和分化为血管内皮细胞的定向干细胞。1997年Asahara等[1]利用免疫磁珠细胞分选法从人外周血中成功分离得到EPCs。随着对EPCs分离、培养、鉴定、功能和应用方面的研究的广泛开展,为难治性缺血性疾病的治疗提供了新思路。而这与EPCs增殖、黏附、迁移和成管等生物学功能密不可分,如何通过药物或物理疗法诱导EPCs以提高其生物学功能将有助于EPCs发挥血管新生作用。黄芪甲苷(Astragaloside IV,AS-IV)是中药黄芪中最主要的活性成分,具有血管药理活性,能诱导血管新生[2]。本团队前期研究表明AS-IV能提升EPCs的细胞活性,且发现AS-IV促人EPCs增殖的最适浓度为100 mg/L[3]。本研究是在前期研究基础上进一步探讨AS-IV对EPCs增殖、黏附、迁移和成管等生物学功能的影响,将为深入研究AS-IV作用于EPCs介导的血管新生奠定基础。
1 材料
1.1 主要药品试剂
ECM(上海中乔新舟公司);ECGS、胎牛血清、 M199培养基、PBS液(美国Gibco公司);胎牛血清(美国Gibco公司);胰蛋白酶(美国Amresco公司);细胞培养箱(美国Thermo Scientific公司);黄芪甲苷(纯度98%,批号:110781-201813上海吉至公司);Anti-CD31抗体(ab28364)、山羊抗兔IgG H&L (FITC,ab6717)均购于英国Abcam公司;DAPI溶液(北京中科瑞泰公司);Dil-ac-LDL(澳大利亚Molecular Probes公司);FITC-UEA-I(美国Sigma公司); CCK-8试剂盒(日本同仁化学研究所);Matrigel基底膜基质胶(上海前尘公司)。
1.2 主要仪器
奥林巴斯显微镜(SZX7)、荧光显微镜(Olympus-BX51)均购于北京同舟同德公司。
2 方法
2.1 EPCs的培养
取足月健康新生儿脐带血,经密度梯度离心分离得到单个核细胞。将脐血单个核细胞应用M199培养基(20%胎牛血清,VEGF10 mg/L,青霉素100 kU/L,链霉素100 kU/L),在37 ℃、5%CO2、饱和湿度的培养箱中培养4 d;取贴壁细胞,换培养液继续培养7 d;再取贴壁细胞,用胰酶消化细胞按1∶3进行传代。
2.2 EPCs的鉴定
参考CD31免疫磁珠分选法[4]及FITC-UEA-I和 Dil-ac-LDL双荧光染色法[5]共同对人内皮祖细胞进行鉴定。
CD31抗体联合DAPI核染鉴定:P3代细胞用4%多聚甲醛固定15 min;0.5%Triton X-100(PBS配制)室温通透20 min;PBS浸洗后滴加山羊血清,室温封闭30 min;滴加Anti-CD31抗体并放入湿盒,4 ℃孵育过夜。PBST浸洗后滴加山羊抗兔IgG(H&L)抗体,20~37 ℃湿盒孵育1 h;再用PBST浸洗后滴加DAPI,避光孵育5 min进行染核,PBST洗去多余的DAPI,加50%甘油,在荧光显微镜下观察采集图像。
FITC-UEA-I和 Dil-ac-LDL双荧光染色鉴定:将P3代细胞接种于盖玻片上使细胞爬片,加入2.4 g/L的Dil-ac-LDL,于37 ℃避光孵育1 h,使用20 g/L多聚甲醛固定10 min,PBST浸洗后加入10 g/L的FITC-UEA-I,于37 ℃避光孵育1 h,PBST洗涤,在荧光显微镜下观察采集图像。
2.3 实验分组
将获得的EPCs随机分为实验组和对照组,实验组加入100 mg/L的AS-IV进行培养,对照组用等容量的PBS液处理。
2.4 AS-IV对EPCs生物学功能的影响
2.4.1 EPCs增殖实验 取对数期EPCs,胰酶消化,调整细胞悬液浓度,分于96孔板,1×105个/孔;置于37 ℃、5%CO2温箱培养24 h,使细胞贴壁;取指数生长期的细胞接种到96孔板上,配制成100 μL的细胞悬液;将培养板在37 ℃、5% CO2的培养箱中预培养24 h;实验组加入100 mg/L AS-IV进行培养,对照组加等容量PBS液。将培养板在培养箱孵育24 h后加入10 μL CCK8溶液,继续孵育1 h。用酶标仪测定细胞在450 nm处的吸光度值;同时设置对照孔,每组设定3复孔。
2.4.2 EPCs黏附实验 用胰酶消化贴壁EPCs,使细胞脱落,形成500 μL的细胞悬液并计数,然后将同等数量EPCs铺在24孔板,在37 ℃、5% CO2孵育培养1 h后,分别用100 mg/L AS-IV和PBS液进行干预,培养8 h后,将同等数目的EPCs接种在包被有大鼠纤维连接蛋白培养板,在37 ℃下培养30 min,2个随机200倍视野计数EPCs。
2.4.3 EPCs迁移实验 先用Marker笔在6孔板背后每隔1 cm划横线一道,横穿过孔。每孔至少穿过5条线。取对数生长期的EPCs,在孔中加入约5×105个细胞,预培养1 d后用无菌200 μL枪头在培养孔底部中央划一道痕迹,用PBS洗去划下的细胞。分别用含有100 mg/L AS-IV和PBS液的无血清M199完全培养基,在37 ℃、5% CO2培养箱中培养。选择2个不同视野,用显微标尺,分别测量0 h和24 h的划痕创面边距并拍照。细胞迁移能力用迁移率表示。
细胞迁移率=(0 h划痕的平均边距-24 h划痕的平均边距)/0 h划痕的平均边距×100%。
2.4.4 EPCs體外成管实验 用M200无血清及生长因子的培养基1∶1稀释Matrigel基质胶,50 μL/孔加入12孔板,37 ℃孵箱放置30 min。当EPCs长到80%~90%时,胰酶消化,用含10% FBS的DMEM重悬,调整细胞密度为1×105个/μL,待细胞贴壁加入含有PBS的M199培养基,其中一半的孔板用100 mg/L AS-IV进行干预,另一半用PBS液处理,重复三孔。37 ℃孵箱孵育,于24 h后在倒置显微镜下观察并拍照。每孔随机选取4个视野计算小管数,取平均值。
2.5 统计学方法
采用SPSS 18.0 统计软件对实验数据中的计量资料进行t检验,采用均数“x±s”表示;P<0.05为差异有统计学意义。
3 结果
3.1 EPCs的培养及鉴定
第7天培养细胞呈现典型集落形态,中央细胞呈圆形,周边细胞呈梭形(见图1)。细胞膜结合CD31免疫荧光抗体呈绿色,细胞摄取DAPI后核染呈蓝色,融合图像显示膜染绿色荧光,核染蓝色荧光(见图2);同时细胞结合FITC-UEA-I呈绿色,细胞摄取Dil-ac-LDL呈红色,两者双染呈橙黄色改变的细胞即为正常分化的EPCs(见图2-3)。
3.2 黄芪甲苷对EPCs增殖、黏附、迁移、体外成管功能的影响
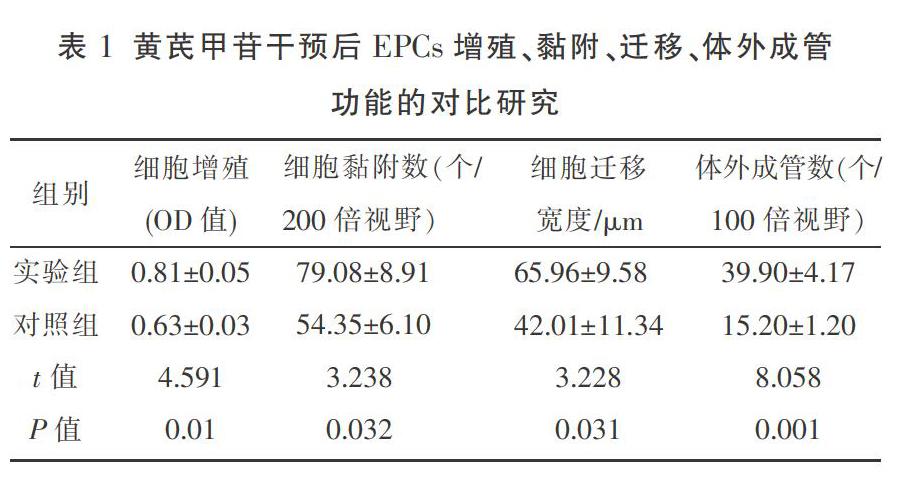
与对照组相比,在AS-IV最佳浓度(100 mg/L)干预下,实验组细胞增殖的OD值增大;200倍视野下细胞黏附数增多;24 h细胞迁移宽度增加,实验组细胞迁移率为68.39%,对照组细胞迁移率为43.79%;100倍视野下体外成管数增多,且差异均有统计学意义(P<0.05)。见表1。
4 讨论
EPCs在人体出生后损伤血管修复和血管新生中发挥重要作用,尤其在缺血性病变的组织修复中,需要重建血运,离不开EPCs从骨髓中动员、迁移到病损部位发挥血管新生作用。虽然人体固有的EPCs能对自身分泌的血管生长因子起反应,发挥一定的血管新生作用,但由于病变躯体拥有的EPCs存在功能缺陷或数量不足,限制了EPCs在病损组织中发挥血管新生的程度。为此国内外学者寻找物理治疗手段和药物来改善EPCs的生物学功能。有研究表明制成的生物活性纳米纤维支架可通过上调HIF-1a/VEGF/SDF-1a信号通路,能高效地促进EPCs增殖、迁移和成管,以维持和促进EPCs的生物活性和血管生成能力[6]。可见改善EPCs的生存环境有利于提高其生物学功能。糖尿病患者体内EPCs生存环境遭到破坏,细胞功能受损,血管发生病变,远端供血障碍,易出现足溃疡。另有研究表明姜黄素能促进糖尿病体缺血小鼠中VEGF-A和Ang-1的分泌,并通过调节EPCs以增强其活力,降低衰老EPCs的数量,逆转受损EPCs的增殖、迁移和体外成管能力[7]。该研究进一步提示病变的机体或受损的EPCs,需要借助药物或生物活性材料来改善EPCs的生物学功能以更好地发挥血管新生的作用。
AS-IV是补益类中药黄芪的主要活性成分,目前研究发现AS-IV在心脑血管梗死后的血管新生方面发挥重要作用,而在下肢缺血性皮肤溃疡方面的基础和临床应用研究相对缺乏。有学者研究发现AS-IV可通过调节JAK-STAT3信号通路促进血管新生以缓解结扎左冠状动脉诱导的大鼠心衰模型[8]。为研究黄芪(AS-IV)对糖尿病足溃疡创面愈合的影响,本团队前期用黄芪注射液全身静脉滴注加局部创面外敷换药用于糖尿病足溃疡创面,与贝复济组相比,发现AS-IV能快速诱导创面血管新生,促进肉芽组织生长,加速创面愈合[9]。然而AS-IV促糖尿病足溃疡创面血管新生的作用机制尚不明确,可能通过改善EPCs的生物学功能而发挥作用。
本团队前期研究发现AS-IV能增强人脐带血来源的EPCs活性和促进EPCs增殖,且通过绘制增殖曲线发现AS-IV促人EPCs增殖的最佳浓度为100 mg/L[3]。本研究在前期研究基础上用100 mg/L的AS-IV对人EPCs增殖、黏附、迁移及体外成管等生物学功能进行研究。研究结果显示AS-IV能明显改善内皮细胞的增殖、黏附、迁移、体外成管等生物学功能,这与国内学者陈声荣等[10]用5、25、75 mg/L的AS-IV干预EPCs后其增殖能力、黏附细胞数、血管数、迁移细胞数均明显增加的研究结果相吻合。但陈声荣的研究采用的是外周血提取的EPCs,实验依据有所欠缺,且研究中未找到AS-IV发挥作用的最佳浓度。而陈军等[11]通过人脐血提取EPCs研究AS-IV对3,4苯并芘介导EPCs损伤的保护作用机制中发现AS-IV对预保护可呈浓度依赖性地提高EPCs增殖、黏附及迁移能力。上述学者从不同从侧面研究了不同浓度的AS-IV能改善EPCs的生物学功能,有力佐证了本研究结果的可靠性。本研究结果发现最佳浓度AS-IV能显著改善EPCs的生物学功能,为深入探讨AS-IV通过EPCs介导的促进血管新生的作用机制奠定了坚实的基础,为进一步开发以AS-IV为主要成分的促皮肤溃疡血管新生的药物制剂提供了实验依据。
参考文献
[1] ASAHARA T, MUROHARA T, SULLIVAN A, et al. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science, 1997, 275(5302):964-967.
[2] 付卫云,刘 暖,王延柯,等.黄芪甲苷通过调控PKD1-HDAC5-VEGF通路促进心肌梗死大鼠血管新生[J].中国病理生理杂志, 2018,34(4):643-649.
[3] 熊 武,陈四红,王禹萌,等.黄芪甲苷对人内皮祖细胞活性及增殖功能的影响[J].中国医师杂志,2019,21(8):1152-1155.
[4] 汤文燕,杨印祥,汪兆艳,等.CD31免疫磁珠分选人脂肪内皮祖细胞的培养及鉴定[J].中国组织工程研究,2017,21(29):4722-4727.
[5] 李 丽,王新玲,刘素新,等.镁对子痫前期患者内皮祖细胞增殖、黏附和凋亡的影响[J].中国组织工程研究,2019,23(21):3371-3377.
[6] WANG C, WANG Q, GAO W, et al. Highly efficient local delivery of endothelial progenitor cells significantly potentiates angiogenesis and full-thickness wound healing[J]. Acta Biomaterialia, 2018, 69: 156-169.
[7] YOU J, SUN J, MA T, et al. Curcumin induces therapeutic angiogenesis in a diabetic mouse hindlimb ischemia model via modulating the function of endothelial progenitor cells[J]. Stem Cell Research & Therapy, 2017,8(1):182.
[8] SUI Y B, WANG Y, LIU L, et al. Astragaloside IV alleviates heart failure by promoting angiogenesis through the JAK-STAT3 pathway[J]. Pharmaceutical Biology, 2019, 57(1):48-54.
[9] 熊 武,全文娟,尹初长,等.黄芪注射液静脉滴注加创面外敷治疗糖尿病足临床疗效评价[J].中国医师杂志,2018,20(6):916-918.
[10] 陈声荣,吕作陪,甘艳艳.黄芪甲苷对内皮祖细胞生物学功能影响的实验研究[J].江苏中医藥,2014,46(3):76-77.
[11] 陈 军,夏武杰,薛杨静,等.黄芪甲苷对3,4苯并芘介导内皮祖细胞损伤的保护作用及机制[J].浙江医学,2016,38(4):237-240,267.
(本文编辑 苏 维)
