利用酵母双杂交系统筛选与人RIPK1互作的牛分枝杆菌蛋白
2020-10-14徐翩翩唐亦然孟祥苗毕斯琪胡燕萍宋厚辉
徐翩翩,唐亦然,孟祥苗,毕斯琪,胡燕萍,杨 杨,宋厚辉
(浙江农林大学 动物科技学院/动物医学院,浙江 杭州 311300)
牛分枝杆菌(Mycobacteriumbovis,M.bovis)主要引起牛结核病,同时也是常见的人结核病的病原,严重危害动物健康和人类食品安全[1]。和结核分枝杆菌一样,牛分枝杆菌栖息和繁殖的主要细胞是巨噬细胞,同时巨噬细胞也是宿主抵御分枝杆菌感染传播的重要屏障。决定感染结果的一个关键机制是牛分枝杆菌诱导和改变肺泡巨噬细胞死亡途径的能力[2]。为了控制牛分枝杆菌复制,肺泡巨噬细胞试图启动细胞凋亡[3],从而导致细菌繁殖的抑制、细菌杀灭的增加、炎症的减轻和抗原提呈的增强[4]。然而,强毒株如结核分枝杆菌和牛分枝杆菌能够触发坏死样细胞死亡,这种死亡常与分枝杆菌的大量复制、严重炎症反应以及疾病的发展有关[5]。 有研究表明强毒株的这种将细胞凋亡转变成细胞坏死能力与TNF-α信号通路有关,但是目前强毒株对TNF-α通路的调控机制并不清楚[6]。
RIPK1是一种多结构域蛋白, 包含一个N端激酶结构域、中间结构域和C端死亡结构域(death domain,DD)。C端死亡结构域可与死亡结构域相关蛋白(FADD)和其他含DD的蛋白质相互作用,招募Caspase-8蛋白,引起细胞凋亡[7]。在TNF-α信号下,N端激酶结构域与TRAF2互作,参与NF-κB激活。中间结构域中包含1个RHIM结构,可与PIRK3结合,引起坏死样细胞死亡[8]。因此,RIPK1在TNF-α信号通路中起着重要作用,决定着细胞存活、凋亡还是死亡。本研究运用酵母双杂交技术,以RIPK1蛋白为诱饵,筛选牛分枝杆菌基因组文库,寻找可与RIPK1互作蛋白,为进一步深入探索牛分枝杆菌通过RIPK1调节细胞凋亡的作用机制提供基础。
1 材料与方法
1.1 菌株、质粒及细胞株大肠杆菌DH5α、p3×Flag-CMV-7.1、pCMV-myc真核表达载体、人HEK293T细胞均由本实验室保存;酵母菌Y2H Gold及Y187、酵母双杂交相关质粒pGADT7、pGBKT7、pGBKT7-p53、pGBKT7-Lam均购自Clontech公司。
1.2 主要试剂2×Phanta Max Master Mix购自南京诺唯赞生物科技有限公司;DNA Marker、 GoldenView核酸染料、质粒小提试剂盒、PCR纯化试剂盒购自天根生化科技(北京)有限公司; Ligation high Ver.2购自TOYOBO公司;蛋白Marker、抗生素及胎牛血清购自Thermo Fisher公司;限制性内切酶NcoⅠ、EcoRⅠ、HindⅢ、XbaⅠ、KpnⅠ购自NEB公司;酵母试验相关试剂,如酵母选择缺陷培养基、X-α-gal、AbA、酵母转化试剂盒、酵母质粒提取试剂盒均购自Clontech公司;鼠源抗Flag单克隆抗体、兔源抗myc单克隆抗体购自Sigma公司。
1.3 人RIPK1基因的扩增根据NCBI发布的人RIPK1基因序列,利用Vector NTI设计特异性引物(表1)。以人HEK293T细胞的cDNA为模板,PCR扩增RIPK1基因序列,反应体系如下: cDNA 1 μL,2×Phanta Max Master Mix 25 μL,上下游引物各1 μL,ddH2O补足至50 μL。设置PCR反应条件如下:预热94℃ 3 min;变性94℃30 s,退火60℃ 1 min,延伸68℃ 30 s,循环35次;总延伸68℃ 7 min。经1%琼脂糖核酸电泳验证PCR产物。
1.4 诱饵质粒pGBKT7-RIPK1的构建使用限制性内切酶NcoⅠ和EcoRⅠ酶切质粒pGBKT7和纯化后的PCR产物,37℃孵育4 h。纯化回收酶切产物,用DNA连接酶16℃连接2 h后,转到大肠杆菌DH5α感受态细胞中,并涂布于含卡那霉素(Kana)抗性的LB平板上过夜培养。挑取单菌落,经菌落PCR筛选阳性克隆,扩大培养后提取质粒,经双酶切验证正确后,将重组质粒送至浙江有康生物科技有限公司测序。
1.5 重组酵母菌的构建用PEG/LiAc转化法将构建成功的诱饵质粒pGBKT7-RIPK1和空载体pGBKT7分别转入到酵母菌Y2H Gold感受态细胞中,涂布于SD/-Trp(SDO)平板上,30℃培养3~5 d,将2种重组酵母菌分别命名为Y2H Gold_ RIPK1和Y2H Gold_ Vec。挑取酵母菌Y2H Gold_ RIPK1菌落接种于5 mL SD/-Trp液体培养基中,30℃,200 r/min过夜培养后,转接入50 mL YPAD培养液中继续培养,直至D600值达到0.4~0.6。收集菌液,用Urea/SDS法提取酵母菌蛋白。使用兔源Myc单克隆抗体经Western blot检测RIP1蛋白表达情况。
1.6 筛选与RIPK1互作的牛分枝杆菌蛋白扩大培养酵母菌Y2H Gold_ RIPK1菌液至D600值至0.8,与1 mL牛分枝杆菌基因组文库共同转接于含有kana的2×YPDA中,在30℃低转速培养20~24 h。菌液离心弃上清后,10 mL 0.5×YPDA重悬。每200 μL菌液涂于SD/-Trp/-Leu/X-α-gal/AbA(DDO/X/A)平板上,30℃培养3~5 d后在平板上挑取蓝色阳性克隆,接种到在筛选更严格的营养缺陷培养基SD/-Trp/-Leu/-His/-Ade/X-α-gal/AbA(QDO/X/A)平板上,30℃培养3~5 d后阳性克隆挑取菌落扩大培养,保菌并提取酵母质粒。
1.7 阳性克隆的互补验证及测序为排除所筛选到的牛分枝杆菌基因能够自激活而造成假阳性的可能,进行了回补试验复筛。将提取的pGADT7-X质粒分别和pGBKT7-RIP1及空载体pGBKT7两两组合转化到酵母菌Y2H Gold中,菌液涂于DDO/X和QDO/X/A的平板中,30℃培养3~5 d后,观察菌落颜色及生长情况。将回补验证中正确的阳性克隆质粒送至测序公司测序,所得基因序列在BLAST上与牛分枝杆菌基因组对比,找出有意义的基因序列。
1.8 免疫共沉淀法验证蛋白的互相作用
1.8.1真核表达载体的构建 根据NCBI提供的牛分枝杆菌的基因序列以及人RIPK1的基因序列,分别设计相应引物(表1)。扩增目的片段,分别重组到真核载体p3×Flag-CMV-7.1和pCMV-myc。扩增方法及质粒构建步骤参考1.3。
1.8.2免疫共沉淀法 HEK 293T细胞以8×105个/孔接种于6孔板,使用Lipofectamine 2000转染试剂转染相应质粒。转染24 h后,加入300 μL NP40裂解细胞,收取细胞总蛋白,检测蛋白浓度,取50 μL作为input使用。取400 μg细胞蛋白加入结合Flag抗体的protein G beads,翻转孵育4℃ 2 h,PBS缓冲液清洗5 次后,加入蛋白上样缓冲液煮沸5 min,作为IP使用。通过Western blot检测蛋白互作情况。
2 结果
2.1 构建含有RIPK1基因的诱饵质粒以293T细胞的cDNA作为模板,利用PCR技术扩增RIPK1的基因片段,扩增获得的片段大小为2 010 bp(图1),符合预期大小。经酶切酶连后转入大肠杆菌DH5α中,挑选单菌落克隆,经菌落PCR验证,得到2个阳性克隆(图2)。将阳性克隆扩增,提取质粒进行双酶切验证,所得2条目的条带大小与预期一致(图3)。经测序结果显示与已公布的基因序列完全相同,表明诱饵质粒pGBKT7-RIPK1构建成功。

表1 引物序列

图1 RIPK1目的片段PCR扩增 M.DL15000 DNA Maker;1~6.RIPK1基因片段温度梯度55~65℃
图2 重组质粒pGBKT7-RIPK1的PCR鉴定 M.DL2000 DNA Maker;1~4.pGBKT7-RIPK1;5.阴性对照

图3 重组质粒pGBKT7-RIPK1酶切验证 M.DL15000 DNA Maker;1~3.质粒pGBKT7-RIPK1
2.2 诱饵蛋白RIP1在酵母菌中的表达情况收集重组酵母菌Y2H Gold_ RIPK1,破裂菌体后Urea/SDS法提取酵母蛋白,经Western blot检测发现RIPK1可在酵母菌中表达,蛋白大小为97 500(图4),说明重组酵母菌Y2H Gold_ RIPK1构建成功。
2.3 筛选牛分枝杆菌基因组文库使用重组酵母菌Y2H Gold_RIPK1与牛分枝杆菌基因组文库混合培养24 h后,涂于DDO/X/A平板上。30℃培养5 d后在DDO/X/A平板上共发现52个蓝色菌落。将这52个蓝色菌落涂布于QDO/X/A中进行再次筛选,30℃培养5 d后发现16个蓝色菌落,确定为阳性克隆。

图4 Western blot检测RIPK1在酵母菌中的表达情况 1.Y2H Gold_RIPK1;2.阳性对照;3.阴性对照
2.4 回补验证阳性克隆将所获得的pGADT7-X质粒和pGBKT7-RIPK1及空载体pGBKT7两两组合转染到酵母菌Y2H Gold中,分别涂布于DDO/X和QDO/X/A平板上。若pGADT7-X和pGBKT7-RIP1互作则共转后在DDO/X和QDO/X/A平板上均长出蓝色菌落,而pGADT7-X和空载体pGBKT7共转后在DDO/X和QDO/X/A长出白色菌落或不长菌,则说明所筛选获得的阳性克隆不会自激活,是能够与RIP1互相作用的(图5)。回补验证筛选共得到9个阳性克隆。经测序以及BlAST比对后,共获得翻译正确的7个牛分枝杆菌蛋白,分别为Mb0869c、Mb0383c、Mb2314、Mb1465、Mb04-46c、Mb0667和Mb0949。

图5 阳性克隆互补验证 A.pGADT7-X和pGBKT7-RIPK1在DDO/X平板生长;B.pGADT7-X和pGBKT7-RIPK1在QDO/X/A平板生长;C.pGADT7-X和pGBKT7在DDO/X平板生长;D.pGADT7-X和pGBKT7在QDO/X/A平板生长
2.5 真核表达载体的构建以牛分枝杆菌基因组作为模板, PCR扩增上述7个分枝杆菌基因片段,经酶切酶连将其分别插入到真核表达载体p3×Flag-CMV-7.1上(图6)。同样,以HEK293T细胞cDNA为模板,扩增RIPK1基因片段,将其插入到真核表达载体pCMV-Myc上(图7)。
2.6 免疫沉淀法验证分枝杆菌候选蛋白与RIPK1互作情况将构建好的重组质粒转入HEK 293T细胞中,转染24 h后,运用免疫共沉淀技术验证7个牛分枝杆菌蛋白与RIPK1的互作情况。结果发现,在7个蛋白中有3个蛋白可以在HEK 293T中与RIPK1互作,分别为Mb0869c、Mb0383c和Mb2314(图8)。
3 讨 论
在分枝杆菌感染的巨噬细胞中,来自分枝杆菌细胞壁的多种成分可以通过TLR2介导的信号途径刺激TNF-α产生[9]。TNF-α作用于细胞膜表面TNF受体,并进一步诱导宿主发生Caspase-8介导的外源性细胞凋亡[10]。细胞凋亡的发生可降低分枝杆菌传播[11]。由凋亡分枝杆菌感染的巨噬细胞产生胞外小泡携带抗原,可被未感染的树突状细胞吞噬。MHC-I和CD1将这些抗原进一步呈现给CD8+T细胞,从而激活T淋巴细胞并触发适应性免疫[12]。有研究表明,结核分枝杆菌H37Rv等强毒株诱导的巨噬细胞凋亡比无毒或弱毒的分枝杆菌菌株少,可能是通过激活膜表面TNFR2,来逃避TNF-α依赖性凋亡[13],并通过增加Bcl-2家族成员MCL-1蛋白的表达来抑制内源性细胞凋亡[14]。Bcl-2家族蛋白,位于线粒体膜可阻断线粒体释放细胞色素C。此外,多种分枝杆菌基因可抑制宿主细胞凋亡。例如,在结核分枝杆菌中,NuoG编码一个Ⅰ型NADH脱氢酶亚单位,可抑制M.kanssii导致的人和小鼠巨噬细胞凋亡[15]。
图6 含有牛分枝杆菌基因的真核表达载体PCR验证
图7 含有RIPK1基因真核表达载体PCR验证 M.DL2000 DAN Marker;1~9.PIPK1基因插入真核表达载体PCMV-Myc;10.阴性对照
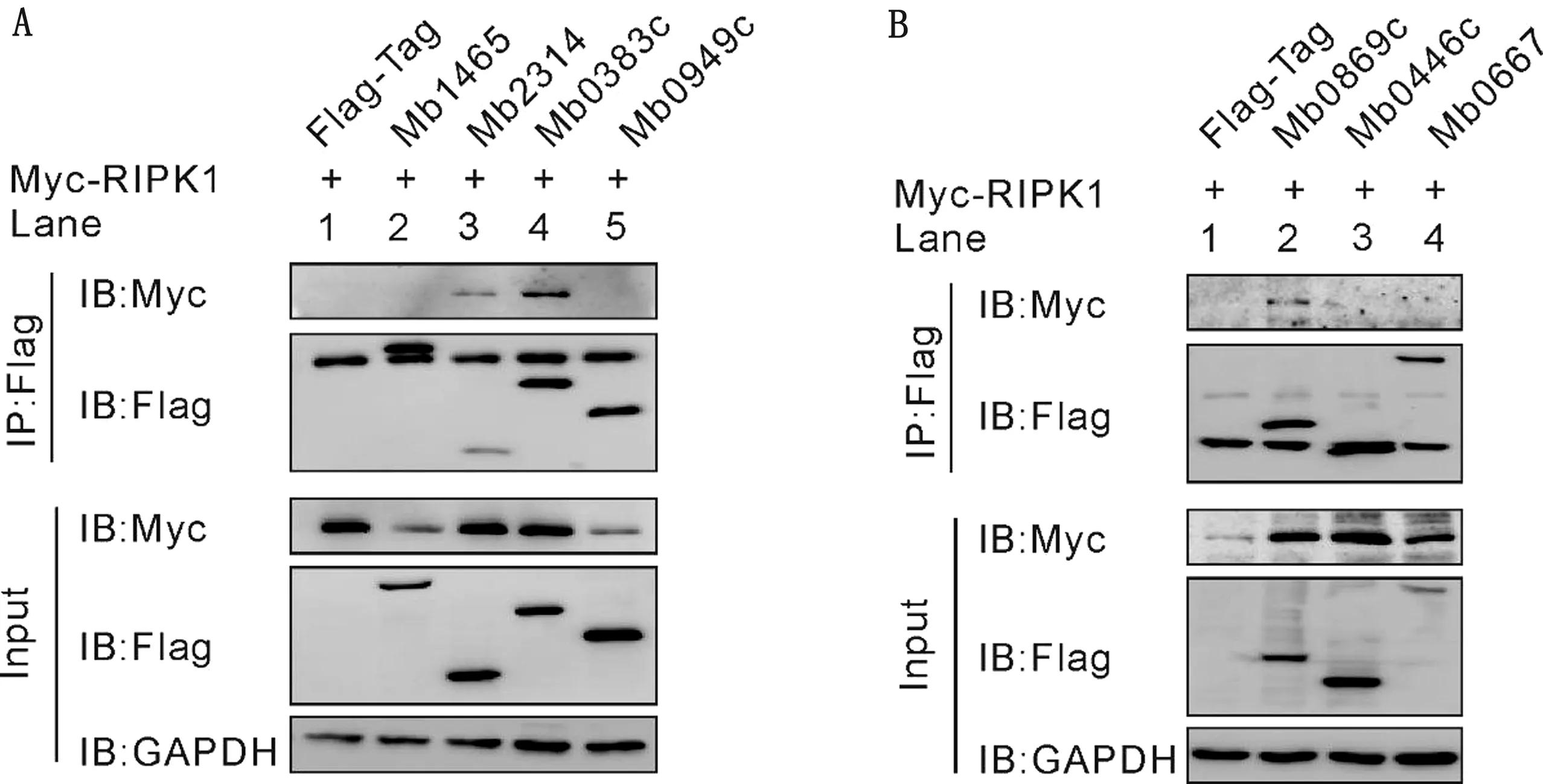
图8 Co-IP对RIPK1与牛分枝杆菌候选蛋白互作验证
TNF-α也被认为是线粒体活性氧的有效诱导物。高浓度TNF-α通过RIPK1-RIPK3- MLKL诱导PGAM5- DRP-1依赖性细胞死亡。在感染初期,ROS增加巨噬细胞杀微生物活性的同时,也可迅速导致感染分枝杆菌的巨噬细胞坏死,将分枝杆菌释放到有利于生长的细胞外环境中[16]。坏死样细胞死亡也是一种程序性坏死,可作为细胞凋亡的后备或竞争者。最近一项研究发现,抑制RIPK3或MLKL不能保护细胞免于死亡,而是将TNF-α诱导的坏死样细胞死亡转变为依赖于RIPK1的延迟性凋亡[17]。在TNF-α刺激TNFR1后,TRADD与RIPK1、TRAF2/5和cIAP1/2形成膜近端超分子结构复合体Ⅰ(ComplexⅠ)[18]。cIAPS引起RIPK1或TRAF2的多泛素化,从而导致NF-κB转移到细胞核,诱导其靶基因转录。RIPK1脱氨或抑制cIAPS蛋白的活性则促进ComplexⅠ 向ComplexⅡa转化,ComplexⅡa含有RIPK1、FADD、Caspase-8和TRADD[18]。在ComplexⅡa中,Caspase-8被激活并启动凋亡。如果Caspase-8的活性被抑制,RIPK1和RIPK3与FADD和Caspase-8在ComplexⅡb中组装,其中RIPK1磷酸化RIP3,并进一步招募MLKL,导致坏死样细胞死亡[19]。无毒或弱毒性的分枝杆菌菌株倾向于诱导细胞凋亡,而强毒的分枝杆菌菌株倾向于将细胞凋亡转变为坏死样细胞死亡,这有利于病原体并有助于分枝杆菌传播[20]。因此推断在感染的某些阶段,强毒株可能分泌一种毒力因子作用于TNF-α信号通路的某个分子上,来阻断ComplexⅡa的生成,从而抑制细胞凋亡。
鉴于RIPK1是TNF-α信号通路中决定细胞命运的重要因素,因此,本研究尝试寻找牛分枝杆菌上是否存在可与RIPK1互作的某些蛋白,从而调节细胞凋亡的发生。构建诱饵质粒pGBKT7-RIPK1,通过酵母双杂交筛选和免疫共沉淀验证最终确定了3个能和RIPK1互作的牛分枝杆菌蛋白,分别为Mb0869c、Mb0383c和Mb2314。Mb0869c在序列上与结核分枝杆菌Rv0846c同源性高达99.8%,Rv0846c被报道参与结核分枝杆菌对铜的代谢[21]。虽然在Uniprot数据库中可搜索到Mb0383c和Mb2314,但未见任何关于这两个蛋白功能的报道。因此,该试验为后续深入研究牛分枝杆菌通过RIPK1调控细胞凋亡的作用机制提供了参考数据。
