河北地区猪源克雷伯菌Ⅰ型整合子-基因盒的捕获与耐药基因携带情况及其致病性
2020-10-14王梦佳孟宪华宣国彦彭志豪范京惠左玉柱李清艳
王梦佳,孟宪华,宣国彦,刘 莹,韩 磊,彭志豪,范京惠,左玉柱*,李清艳*
(1.河北农业大学 动物医学院/科教兴农中心, 河北 保定 071001;2.河北省畜牧总站,河北 石家庄 050035;3.沧州市新华区农业农村局,河北 沧州 061000 )
克雷伯菌在临床中是一种重要的非条件性医源性致病菌[1]。该菌常寄生于人和(或)动物的呼吸道、消化道、生殖道等部位,易诱发支气管炎、肺炎、泌尿系统创伤感染等疾病,甚至会引发败血症等相关疾病[2]。广谱类抗生素药品的滥用导致克雷伯菌的耐药率逐渐升高[3],而耐药性一旦产生便可通过可移动元件水平传播耐药基因使细菌产生多重耐药性[4-5]。整合子-基因盒与细菌耐药性及多重耐药性的产生和传播息息相关,是细菌染色体或质粒上的可移动DNA分子,可用来表达细菌的耐药性,自身编码的整合酶获得外源基因并使之进行表达。整合子的捕获、整合作用及耐药基因盒的表达,致使耐药基因在同菌属和(或)不同种菌属间进行传播导致细菌耐药性的扩散。细菌既可单独携带整合子亦可同时携带多种耐药基因盒而使细菌产生多重耐药[6]。
近年来,国内外已有许多关于从不同地区、不同动物源分离得到的克雷伯菌中发现整合子-基因盒的报道[7-10],但还未见关于猪源克雷伯菌的整合子-基因盒的相关报道。本试验针对河北地区分离到的1株猪源克雷伯菌进行整合子-基因盒的检测及菌株的耐药性分析。将分离得到的菌株感染试验小鼠并建立克雷伯杆菌感染动物模型,同时对感染小鼠进行剖检并取其组织制备病理切片,观察该菌的致病性及其对机体损伤的病理变化,为该菌株的致病性研究奠定基础。
1 材料与方法
1.1 病原及试剂发病猪场采集死亡猪脏器;引物购自生工生物工程股份有限公司; DNA Marker购自宝生物(北京)有限公司;营养琼脂培养基购自北京奥博星生物技术有限责任公司。
1.2 细菌的分离培养及鉴定将病死猪脏接种于血清营养琼脂培养基培养24 h后观察菌落的生长情况并进行革兰染色镜检。根据克雷伯保守基因khe基因设计1对引物送至公司合成。对分离菌与实验室保存其他菌种进行对比扩增,反应体系20 μL:模板2 μL,2×Taq PCR Mix 10 μL,上、下游引物各1 μL,ddH2O 6 μL。反应条件:94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。PCR产物经10 g/L 的琼脂糖凝胶电泳,根据产物条带大小鉴定。
1.3 克雷伯菌的血清分型根据参考文献[11-12]设计引物对该菌进行血清型分析。
1.4 整合子检测及耐药基因筛选对该菌进行药敏试验以确定其耐药表型,同时对分离株克雷伯菌进行整合子检测,并设立阴性对照组。PCR体系同1.2,反应条件为94℃预变性5 min;94℃变性30 s,54℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min。将Ⅰ型整合子可变区PCR产物经琼脂糖凝胶电泳,用琼脂糖凝胶回收试剂盒回收纯化目的片段PCR产物,将回收产物连接至pMD19-T载体上,转入感受态细胞送至生工生物工程测序。测序结果用DNAStar软件进行分析,与 GenBank中已收录的序列进行同源性比对及分析得到整合子可变区所含耐药基因盒的种类。
1.5 小鼠致病性试验分离菌接种液体LB培养基振摇后继续传代3次,离心收集培养物,建立生长曲线并选择合适的含菌浓度,利用平板计数法计算实际感染的细菌量。对菌液进行1∶100倍比稀释后,分为A、B、C和D组,分别为1×109,1×107,1×105和1×103CFU/mL。对照组为生理盐水。每组5只,每只腹腔注射0.2 mL稀释菌液,第1天,每小时进行1次记录,后期每天进行1次记录。取发病死亡小鼠新鲜脏器于无菌环境中涂片进行革兰染色镜检及分离培养,同时将新鲜组织块冰冻、包埋、切片和H.E染色,进行观察。

表1 引物信息
2 结果
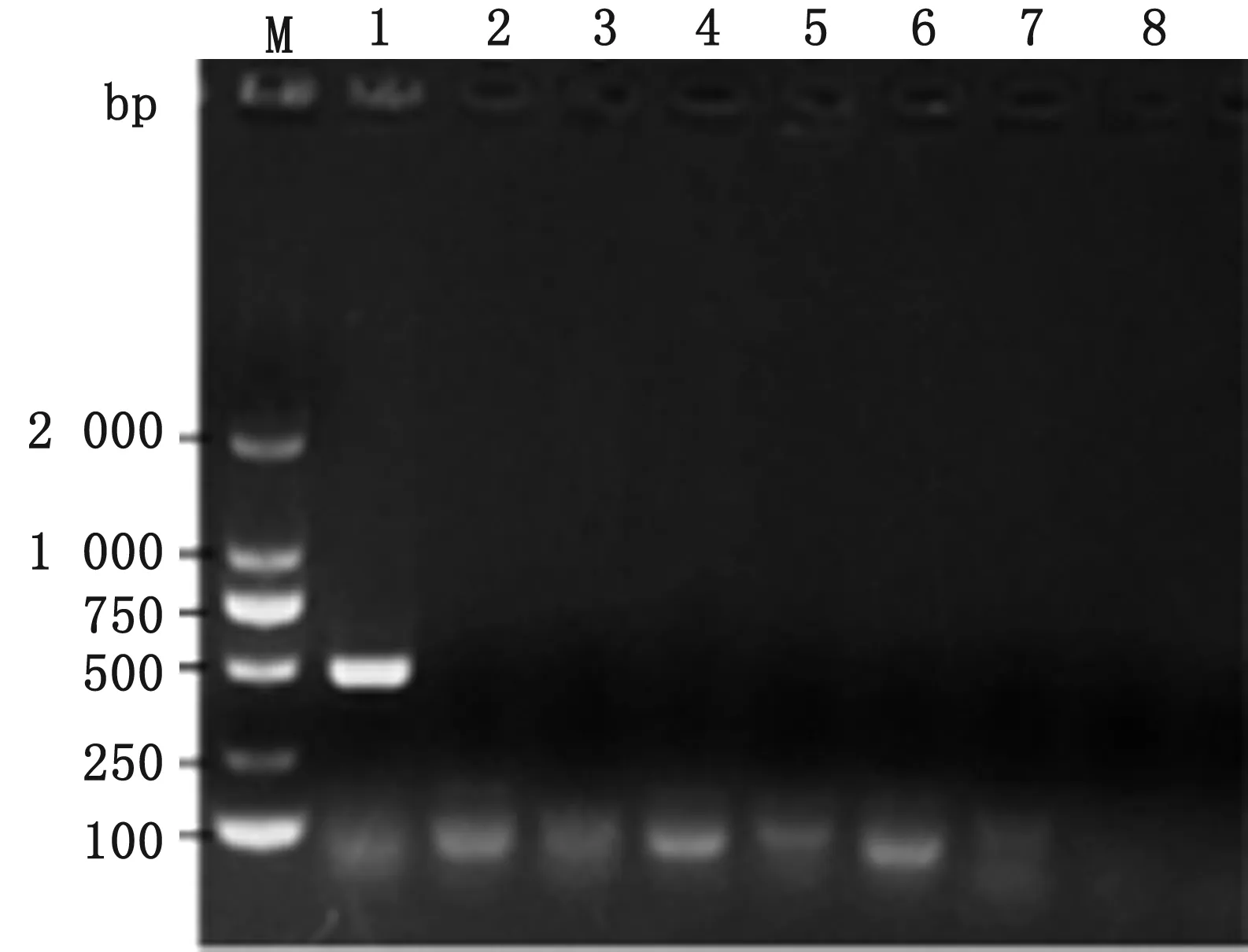
2.1 细菌鉴定及血清分型结果以分离菌和实验室所保存菌种分别作为模板对比扩增得到分离菌PCR产物,大小约425 bp(图1),与设计理论值相符,而对照细菌的扩增结果均为阴性,说明该菌为克雷伯菌且引物特异性良好。该分离菌在K1血清型扩增片段位置与设计值相符,而K2、K3、K5、K20、K54和K57血清型检测均呈阴性,由此证明该株分离菌为K1血清型克雷伯菌(图2)。
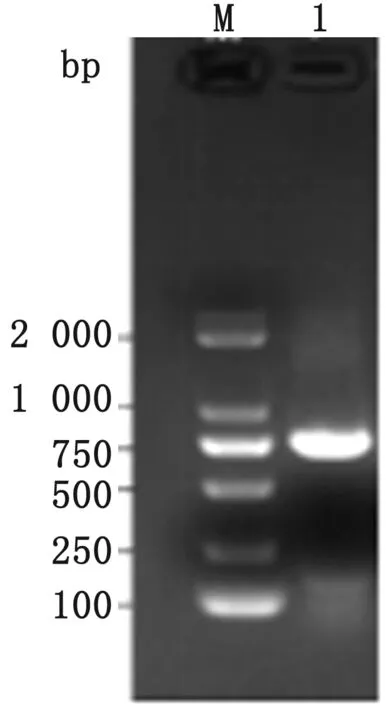
2.2 整合子检测及耐药基因筛选结果分离株克雷伯菌Ⅰ类整合子处扩增出1条大小为768 bp片段(图3),与预期相符。Ⅰ型整合子可变区扩增出1条约为2 500 bp片段(图4),在GenBank上进行BLAST比对分析,结果显示含有CatB3、DfrA17、DfrA12、Dfra16、pst-1、BlaP/b、Aad2和Cm/A1等耐药基因,主要以介导甲氧苄啶类耐药的drfA为主,与其药敏试验耐药表型一致。
2.3 小鼠致病性试验结果
2.3.1小鼠剖检结果观察 小鼠接种该分离菌后5 h 内开始出现临床症状,主要表现为精神萎靡,进食减少;眼睑周围出现淡黄色的分泌物,难以睁眼(图5);而对照组小鼠未见异常。24 h内小鼠出现死亡,对其进行剖检,可见试验组小鼠肝脏明显淤血肿大;脾脏瘀血肿大且浆膜表面可见覆有一层淡黄色脓性分泌物;肺脏淤血、充血水肿;胸腔内积有胶冻样液体(图5)。
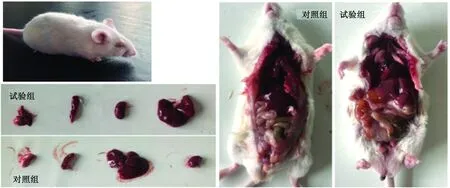
图5 小鼠致病性试验结果
2.3.2小鼠组织切片观察 由图6可见小鼠肺脏中肺泡上皮细胞增生,肺泡间隔变宽且其内部有大量的炎性细胞;肝脏内可见大量的炎性细胞浸润,胞浆内出现大小不一的空泡,血窦开放且其中含有少量的红细胞,整体呈肝充血病理变化;脾的病理切片可见淋巴小结增生,脾血窦开放,呈充血状态,脾索内浆细胞、单核巨噬细胞增多同时伴有大量中性粒细胞浸润及淋巴细胞增生。
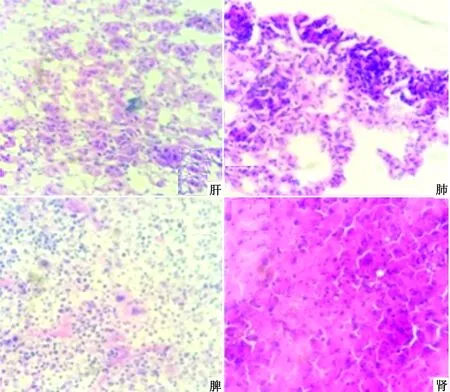
图6 小鼠组织病变观察结果(1 000×)
3 讨论
现已有相关文献证明整合子基因盒的表达对细菌耐药性的产生和传播具有重要影响[15]。克雷伯菌是获得性感染的主要流行菌和重要的条件致病菌,近年来广谱类抗生素的滥用导致克雷伯菌的耐药性与日俱增[16],最常见的Ⅰ类整合子包含了大部分的耐药基因[17]。
整合子是一种存在于细菌质粒和(或)染色体上的具有捕获、重排和表达耐药基因能力的遗传结构,该结构成为细菌多重耐药性产生和发展的重要因素之一[18]。整合子能够在整合酶的催化作用下通过位点专一重组系统来整合外来耐药基因而致使耐药基因不断增加而使细菌携带耐药性,然而整合机制带来的则是耐药基因的传播和扩散[19]。当前国内报道的Ⅰ类整合子较少,有研究报道由于细菌同时携带2种可移动耐药元件,Ⅰ类整合子在携带多种耐药基因的同时有可能会导致耐药性传播[20]。
本研究从河北某猪场急性死亡猪内脏中成功分离出1株克雷伯菌,通过细菌的分离鉴定、Khe基因扩增、血清分型、整合子捕获整合、动物感染模型构建及分析等方法对其生物学特性进行分析,从分离的猪源克雷伯菌中检测到CatB3、DfrA17、DfrA12、Dfra16、pst-1、BlaP/b、Aad2和Cm/A1等耐药基因,该K1型菌株主要以介导甲氧苄啶类耐药drfA为主,其结果与其耐药表型一致,这一结果也解释了为何有时对患肺炎克雷伯菌病感染猪使用多种抗菌药物均治疗效果不佳。为了减缓该菌耐药性,应当加强对兽用抗菌药物的监管力度,同时严防人药用于畜牧生产中。
克雷伯菌在进入机体后会产生一种附着于细胞壁表面的胶状物质—荚膜多糖,能够促进细胞表面的黏附作用也就是细菌与细菌之间作用而促进生物膜的形成而使细菌可在不同的坏境中生存[21]。生物膜的存在能够使细菌个体免受吞噬细胞的吞噬作用而使病原菌对人或动物进行侵袭产生致病作用。脂多糖是细胞壁中另外一种成分,类脂为脂多糖的重要组成部分,作为细菌的毒性中心能够引起动物的免疫反应[22]。本研究对分离菌进行梯度稀释接种于小鼠动物模型,结果显示该菌可导致小鼠死亡,致病小鼠的临床症状表现为萎靡不振、不喜进食,眼睑周围有淡黄色的干酪样分泌物而紧闭双目。对死亡小鼠进行剖检,结果显示小鼠各器官发生了不同程度的病变。肺脏主要表现为间质性肺炎病理变化,肺泡壁增厚导致肺泡表面活性物质减少,呼吸膜增厚引起肺换气障碍,支气管管壁内大量的炎性渗出物在管腔内造成堵塞进而导致堵塞性通气障碍,致使感染鼠呼吸困难。其发病过程中所表现出的呼吸道症状及其病理变化与国内有关报道较一致[23-24]。肝脾表面有脓性渗出物且肿大充血同时伴有大量的炎性细胞浸润,这一现象与YA等[25]报道一致。通过上述情况可推测克雷伯菌是凭借荚膜抗原对自身菌体的保护作用而不断侵袭机体,形成全身性感染并使受感染动物并发脓毒血症而导致动物死亡。这一研究给临床治疗药物筛选提供良好的动物模型,同时也为今后深入研究克雷伯菌的致病机理提供依据。
