应用高通量实时荧光定量PCR方法检测小檗碱对多药耐药大肠杆菌耐药基因的影响
2020-10-14张石磊翟向和王春光
张石磊,翟向和,王春光,贾 泽,张 铁*
(1.河北农业大学 动物科技学院,河北 保定 071001;2.河北农业大学 动物医学院/中兽医学院,河北 保定 071001)
大肠杆菌(Escherichiacoli,E.coli)是一类重要的能引起疾病的革兰阴性菌,常寄生于人和动物的肠道内,由于抗生素的不合理使用,大肠杆菌耐药谱的不断扩大[1]。耐药性的产生,使得抗菌药物的使用量逐年升高,治疗效果却逐年降低[2]。本实验室对华北地区2012年大肠杆菌抗生素耐药性进行检测,发现90.85%的菌株携带磺胺抗性基因,60.98% 携带氨基糖苷抗性基因,且耐药基因型与表型基本一致[3-5]。细菌耐药性的产生机制主要分为生物化学机制和遗传学机制两种[6]。细菌可以产生不同作用的酶,直接破坏或修饰抗菌药物而失活[7],还可以通过修饰抗生素作用的靶位或本身发生变异,导致对抗生素耐药[8]。
清热中药对细菌耐药性有一定的消除作用,但其机理尚不明确。本试验以清热中药黄连的主要有效成分小檗碱为研究目标,探究其对耐药大肠杆菌耐药基因的影响。现代药理学研究表明小檗碱具有显著抑菌效果[9-10],并且使用小檗碱处理后,细菌对抗生素变敏感[11]。小檗碱可以抑制细菌细胞膜上的双组份系统的功能,减少细菌细胞壁上脂多糖含量,从而产生抑菌作用[12],而细菌的这种变化对其抗生素耐药性也有消除作用[13]。
本研究旨在通过小檗碱作用前后的大肠杆菌耐药基因的变化,探讨小檗碱的耐药消除机制,为实际生产中小檗碱的使用提供理论依据。
1 材料与方法
1.1 试验材料多药耐药禽源大肠杆菌分离自临床;小檗碱购自四川珏康生物科技有限公司,纯度为98%;质控菌株大肠杆菌ATCC 25922购自广东省食品微生物安全工程技术研究开发中心;左氧氟沙星购自中国药品生物制品检定所;药敏片购自杭州天和药物技术开发公司;DNA样品提取试剂盒为SoilPure gene DNA Isolation Kit (Aidlab,中国);抗性基因检测试剂盒为Fast Start Universal SYBR Green Master (Roche Diagnostics GmbH,Germany);高通量实时荧光定量PCR检测仪器为 VIIA@7 (ABI,USA)。
1.2 菌株的鉴定和筛选细菌临床分离后,于麦康凯营养琼脂划线培养,观察菌落颜色和形态,初步确定菌种。
菌株基因型鉴定方法为:扩增细菌16S rDNA,产物大小1 456 bp,其上游引物 (5′→3′):AGAGTTTGATCCTGGCTCAG;下游引物 (5′→3′):GGTTACCTTGTTACGACTT。PCR产物经测序后,经NCBI BLAST确定结果。通过K-B纸片法和微量倍比稀释法检测细菌耐药性,使用影印法筛选耐药消除菌株。在影印法筛选细菌的过程中,为了提高筛选效率与准确率,选择牙签型影印柱[14],并对传统牙签影印柱进行改良,制备一种新型影印柱[15]。
影印柱筛选具体步骤如下:以含有250 mg/L(1/2 MIC)小檗碱的LB肉汤培养耐药大肠杆菌Coli0,每24 h传1代,共计培养72 h;取培养72 h后的菌液,稀释细菌浓度为1×105CFU/mL;取100 μL 的菌液涂布至LB培养基上,37℃,12 h;将影印柱与细菌接触的面朝上放置于超净台,把长有菌落的原始平板倒置于影印柱上,轻轻按压充分接触后,再将准备好的空白的LB琼脂培养基和含1/2 MIC左氧氟沙星LB琼脂培养基依次倒扣于影印柱上,使之充分接触;经培养后,将2个平板相同位置的菌落进行对比,如果在相同的位置,菌落能在不加抗生素的平板上生长,而不能够在抗生素板上生长,此菌落即为耐药消除菌落。
1.3 多药耐药大肠杆菌全基因组测序和注释用SDS法提取基因组DNA,用Covaris g-TUBE打断成构建文库所需大小的目的片段,经修复和纯化后构建SMRT Bell文库。构建好的文库经Qubit浓度定量,并利用Agilent 2100检测插入片段大小,随后用PacBio RSII平台对Coli0的基因组进行测序,过滤低质量数据后通过SMRT portal (Version 3.2.0)软件对reads进行基因组组装。耐药性分析使用VFDB (Virulence Factors of Bacterial Pathogens),ARDB (Antibiotic Resistance Genes Database)和CARD (Comprehensive Antibiotic Resistance Database) 3个数据库。
1.4 高通量实时荧光定量PCRPCR反应体系:Roche FastStart Universal SYBR Green Master 5 μL,ddH2O 3 μL, Primer F 0.75 μL,Primer R 0.75 μL, DNA Sample 0.5 μL,Total Volume 10 μL (DNA质量浓度为 5 mg/L,引物为0.1 mmol/L)。67个耐药基因的引物序列见表1。
PCR反应条件:95℃ 10 min;95℃ 30 s 40 循环;60℃ 30 s 40 循环。
熔解曲线分析:95℃ 10 s;65℃ 60 s,升温到95℃后以 0.2℃/s的速度降温至37℃
数据分析方法:试验数据录入SPSS19.0软件进行分析,结果以平均数表示,进行t检验。P<0.05 表示差异显著,P<0.01表示差异极显著。

表1 16S rDNA与67个耐药基因的荧光定量PCR引物序列

续表1
2 结果
2.1 菌株鉴定结果通过麦康凯琼脂培养结果和16S rDNA测序鉴定,所分离的细菌为圆形,边缘整齐,表面光滑的红色菌落(图1),且其16S rDNA序列与大肠杆菌有99%相似(图3),故本菌株为大肠杆菌,命名为Coli0。

图1 临床分离菌株麦康凯培养结果
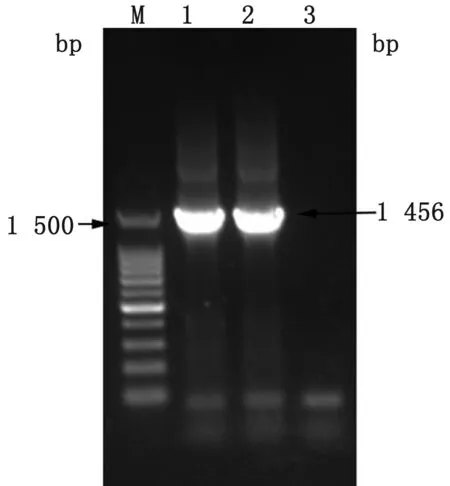
图2 大肠杆菌16S rDNA电泳图 M.DL2000 DNA Marker;1.Coli0;2.Coli1;3.阴性对照
2.2 耐药消除菌筛选鉴定药敏试验显示Coli0对左氧氟沙星、头孢菌素、庆大霉素、氨苄青霉素等9种抗生素耐药 (表2)。其中左氧氟沙星最小抑菌质量浓度(MIC) 最低,为16 mg/L (表3)。
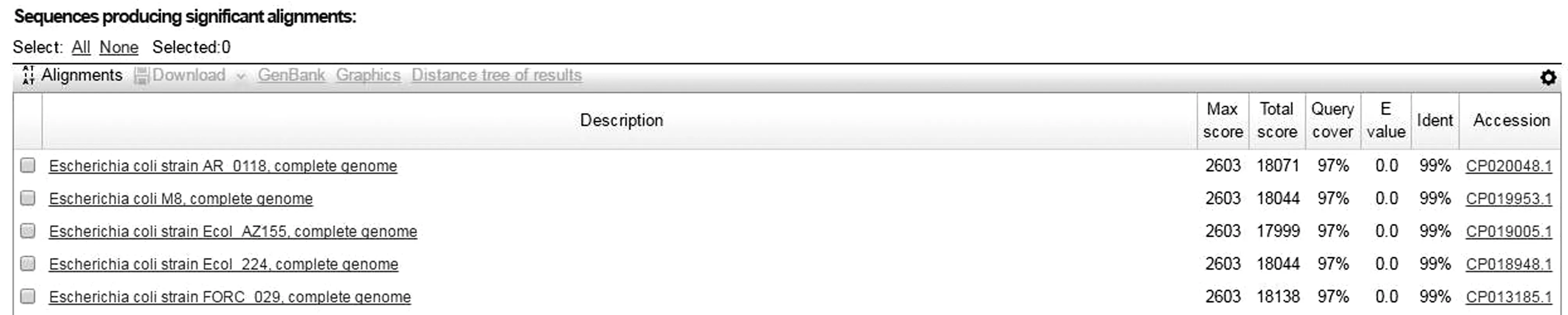
图3 NCBI BLAST结果
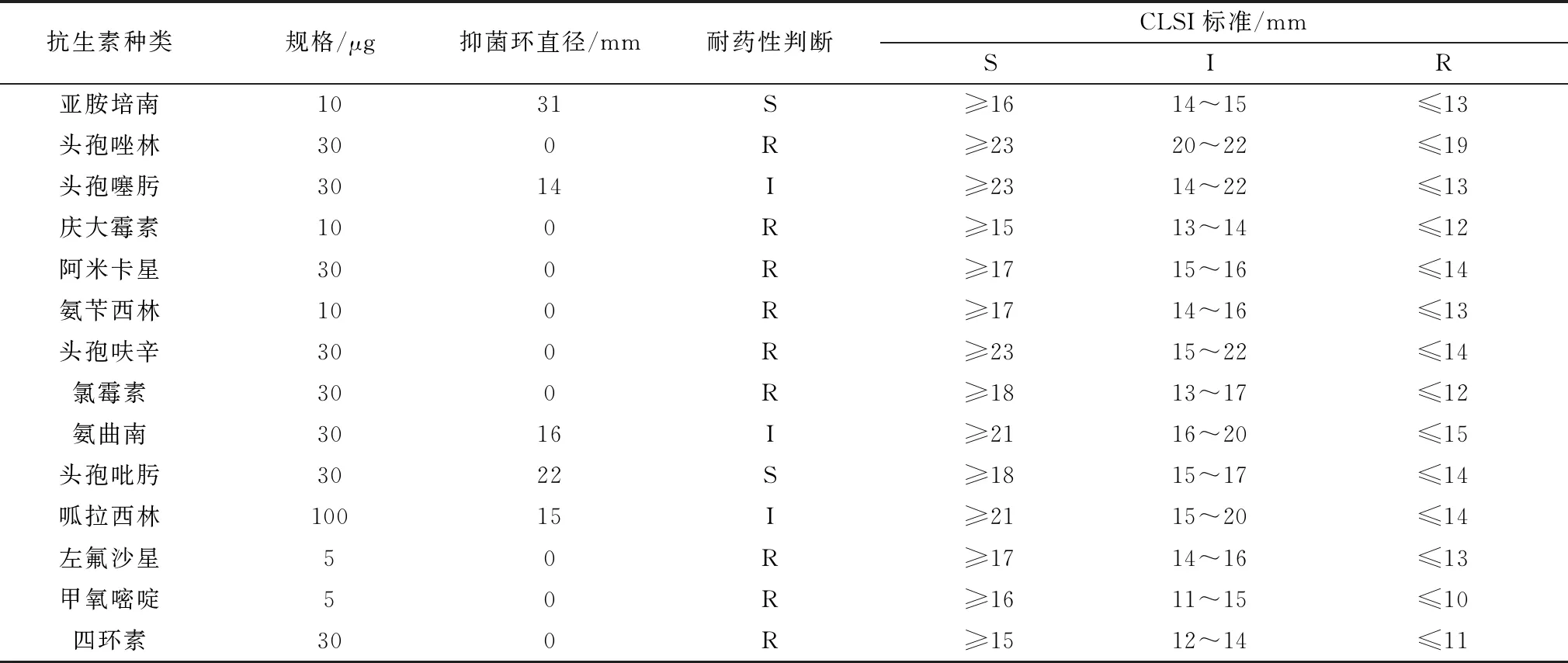
表2 Coli0 K-B法药敏试验
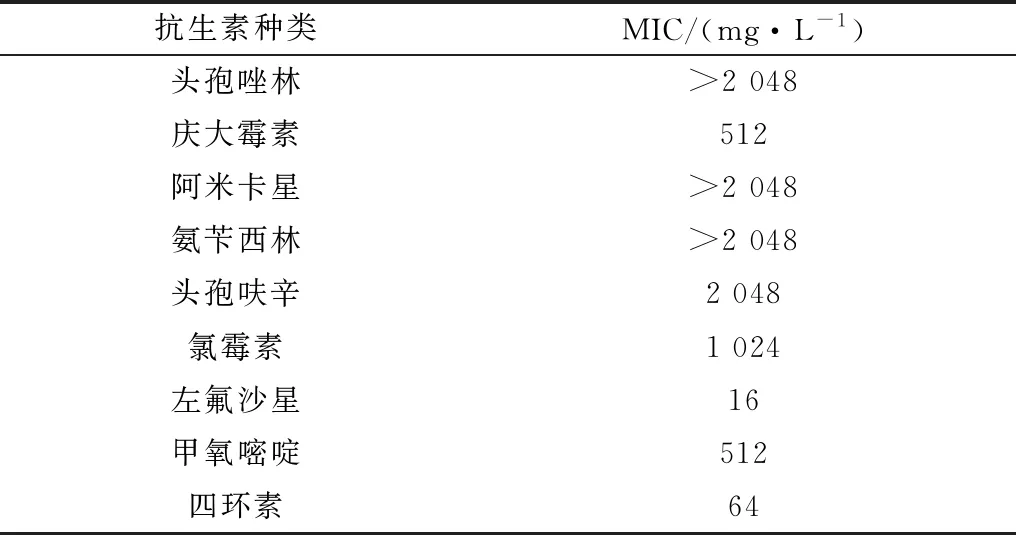
表3 Coli0微量倍比稀释法MIC测定
为了便于筛选耐药性消除菌株,使用MIC最小的左氧氟沙星进行耐药消除菌株筛选。经影印培养,MH琼脂平板耐药性消除前生长单菌落483个 (图4),消除后生长单菌落478个,得到耐药消除菌5株(命名为coli1~5),耐药消除率为1.04%(5/483)。并经K-B药敏试验和MIC试验鉴定证实耐药性得到消除(表4,5)。
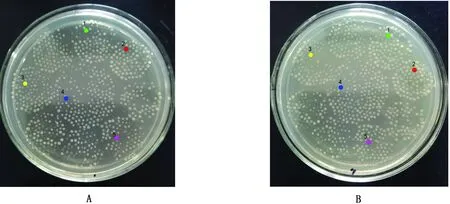
图4 大肠杆菌左氧氟沙星耐药性消除菌株影印筛选 A.空白LB平板生长菌落;B.含左氧氟沙星平板生长情况。注:相同颜色代表相同位置
2.3 Coli0全基因组测序及注释
2.3.1基因组测序及组装 本试验中,Coli0平均测序深度约150×平均测序读长9 961 bp(图5),N50长度为14 209 bp,contig中大片段较多,序列拼接结果良好,测序质量0.85(图6),符合PacBio RSII测序准确率。经过测序,得到Coli0基因组DNA Chr1和2个质粒Plas1、Plas3序列 以及1个3 346 bp的核酸片段 (表6,7)。
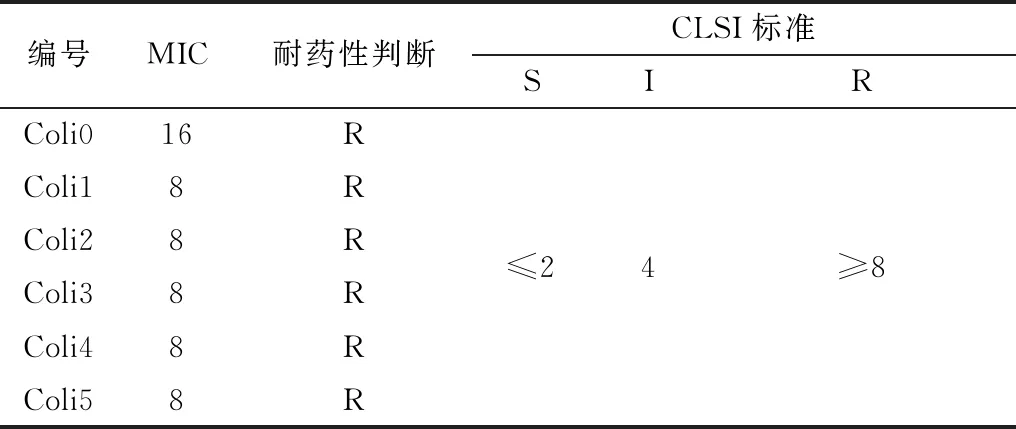
表4 Coli0和各耐药性消除菌株左氧氟沙星MIC测定 mg/L

表5 Coli0和各耐药性消除菌株左氧氟沙星K-B药敏试验 mm
2.3.2耐药基因注释 VFDB共得到注释基因221个,毒力因子集中于鞭毛、脂多糖,肠杆菌素、分泌蛋白等多个方面。ARDB共得到耐药基因53个,耐药种类包括氯霉素、红霉素、杆菌肽、大环内酯类、β-内酰胺类、链霉素、四环素、多黏菌素、氨基糖苷类、诺氟沙星等大部分抗生素,为多药耐药大肠杆菌。CARD共检测到78个耐药基因,其中有11个耐药基因在质粒Plas1上,67个耐药基因在染色体上,除去重复基因,共有67个耐药基因。
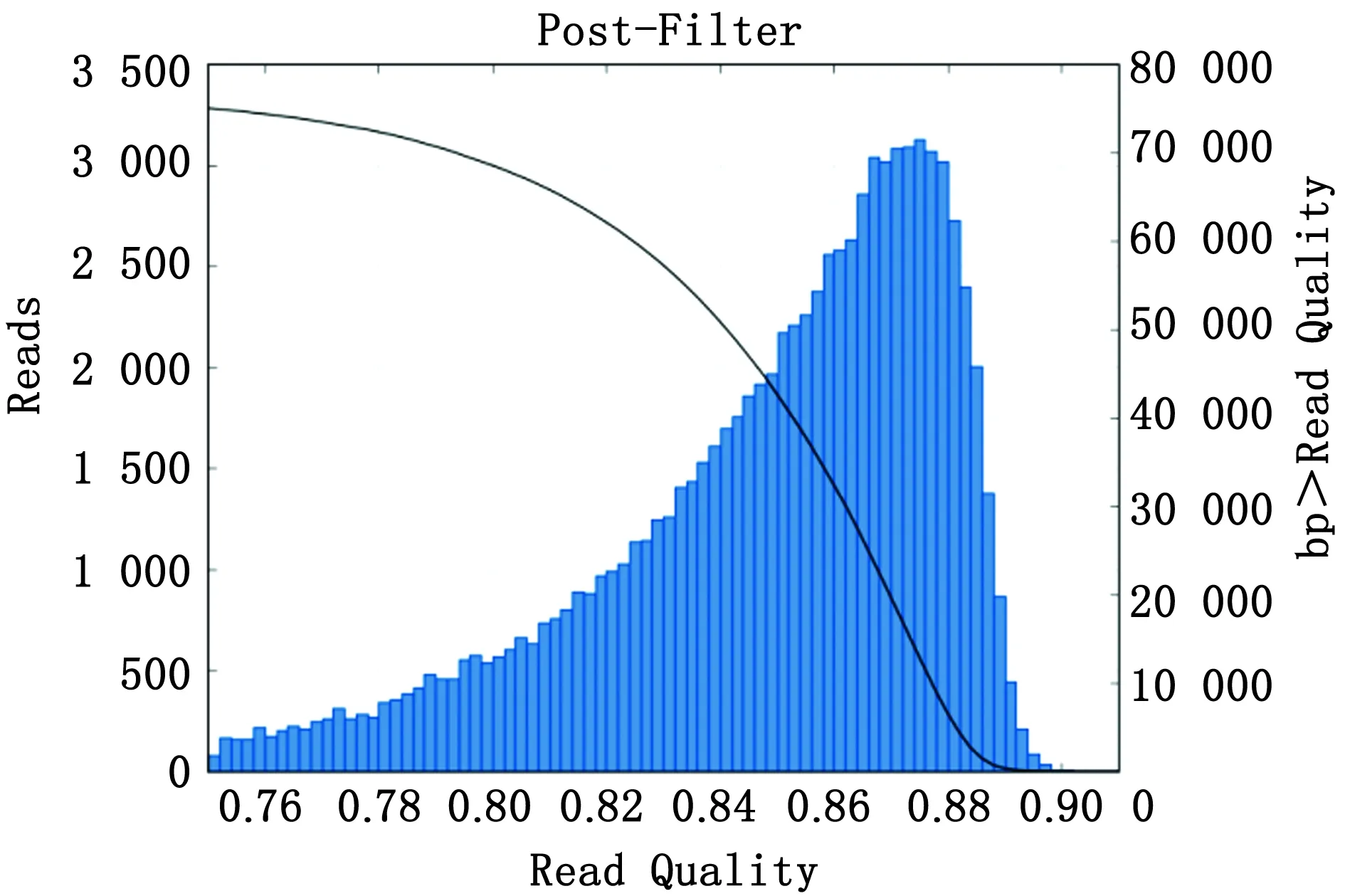
图6 Coli0文库的质量分布图 横坐标表示测序质量;柱形条对应左侧纵坐标;左侧纵坐标表示对应测序质量的reads个数;线性图对应右侧纵坐标;右侧纵坐标表示大于对应测序质量的读长
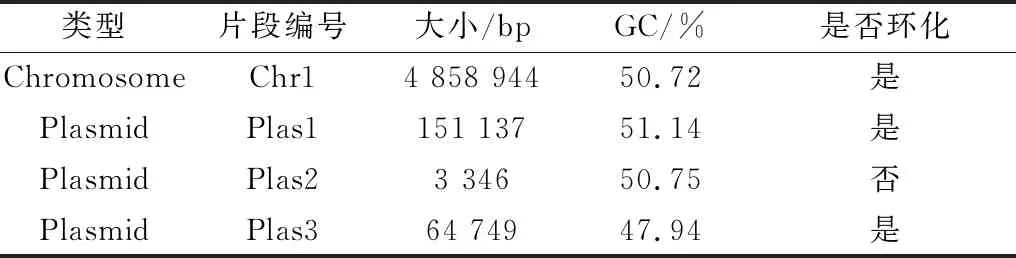
表6 Coli0基因组组装

表7 编码基因预测结果统计表
2.4 实时荧光定量PCR检测经小檗碱处理后,大肠杆菌的耐药基因发生了广泛的变化 (图7),共有18个耐药基因发生显著变化,其中acrR、mexE、sul2、mdtH、mdtL、cpxR、phoQ和pmrC显著下调;mdtE、gyrA、gyrB、macA和macB显著上调;bacA、acrE和emrK消失;mdtA和baeR新产生 (表8)。
3 讨论
Coli0对左氧氟沙星、头孢菌素、庆大霉素、氨苄青霉素等9种抗生素耐药,为了便于筛选,本试验选择了MIC最低的左氧氟沙星 (MIC为16 mg/L) 作为筛选药物。通过筛选得到耐药消除大肠杆菌Coli1、Coli2、Coli3、Coli4和Coli5,这证明小檗碱对大肠杆菌的左氧氟沙星耐药性的降低切实存在。药敏结果的差异意味着小檗碱可能通过多个方面对细菌耐药性的消除产生影响。选择抑菌环最大的Coli1 (14 mm) 作为待测菌株,与原始菌株Coli0进行测序及后续比对分析。通过对Coli0全基因组测序,获得了Coli0完整基因组序列,并上传至NCBI (NCBI登录号:CP020933),并使用3个数据库来预测耐药基因,分别是VFDB,ARDB和CARD,注释得到耐药基因67个,为研究小檗碱消除大肠杆菌耐药性提供数据。

图7 Coli0与Coli1耐药基因热图
大肠杆菌的多药物结合蛋白acrR是TetR家族的成员。KIML 等[16]研究证实acrR上调促进大肠杆菌鞭毛的形成,增强细菌逃离有毒环境的能力,acrR缺失菌株抗逆性则明显减弱。大肠杆菌染色体含有acrA和acrB的同源物,分别命名为acrE和acrF[17]。当acrEF过量产生时,acrEF赋予acrAB缺陷型细胞多药耐药性表型[18]。LAU等[19]发现只有acrEF基因缺失不影响细菌多药耐药性的水平。全基因组注释结果显示Coli0不含acrAB基因,由此可见acrE的消失会使得大肠杆菌对多种药物敏感。cpxR是cpxAR的双组分调节系统中的响应调节剂,cpxR通过激活应激基因的转录来介导反应的反应调节剂[20]。HIRAKAWA等[21]发现cpxR系统可以通过调节药物外排系统基因acrD来对细菌的抗药能力产生间接影响。本试验中acrD基因并没有显著差异表达,但acrR表达量显著减少而acrE消失,这表示cpxR很可能也调控acrR和acrE的表达,从而影响大肠杆菌抗药性。

表8 小檗碱处理后大肠杆菌差异显著基因
mdtA、mdtE、mdtH和mdtL 属于mdt多药外排系统。其中mdtH对诺氟沙星和依诺沙星具有过表达耐药性[22]。mdtL则可以导致细菌对卡那霉素、红霉素、氯霉素显著耐药[23]。PERRETEN等[24]证实mdtA基因的表达提高了乳酸乳球菌和大肠杆菌中大环内酯类,林肯酰胺,链霉素和四环素的易感性。KUNIHIKON 等[25]研究表示,mdtEF过表达使得大肠杆菌对苯唑西林、阿奇霉素、红霉素和结晶紫的抗性降低。baeR是双组份系统baeRS的响应调节器,属于质粒耐药基因,可以显著增加细菌对脱氧胆酸和新生霉素的抗性,并且对mdtABC和mdtEF的表达起到调控作用[21,26]。本次试验中,mdtH和mdtL显著降低, mdtA和mdtE显著升高同时baeR新产生,这证明mdt多药外排系统与小檗碱耐药消除作用有着重要关系。
emrK是多药耐药外排泵emrKY的膜融合蛋白,HIROYUKI 等[27]发现大肠杆菌在四环素、氯霉素或水杨酸盐的亚抑制浓度下emrKY表达增加。本次试验中emrK基因消失,表明小檗碱对大肠杆菌在四环素、氯霉素和水杨酸耐药方面可能有消除作用。
sul2是存在于细菌质粒上的磺胺抗性基因,可以赋予大肠杆菌磺胺类抗性[28]。研究显示sul2基因位于被称为SXT的共轭整合元件组的遗传元件簇的一部分。 SXT携带的抗性基因嵌入复合转座子样结构,因此sul2基因可能菌群内部和代间转移[29-30]。mexE是mexEF-oprN多药物外排系统的外膜融合蛋白,可以导致细菌对多种抗生素的抗性增加,属于质粒耐药基因,在细菌中被广泛存在[31]。
脂多糖是革兰阴性菌外膜的一个组分,由脂质A、核心多糖和特异多糖等3个部分组成。脂质A是一种糖磷脂,由4-氨基阿拉伯糖和磷脂组成,phoPQ双组份系统中的组氨酸激酶phoQ和脂质A磷酸乙醇胺转移酶pmrC表达量的减少使阿拉伯糖与外膜磷脂的结合受阻,脂质A合成受阻,细菌外膜完整性受损,导致细菌抗生素敏感[32-33]。十一烷基焦磷酸磷酸酶bacA是合成十一异戊二烯焦磷酸的关键酶,是细菌产生细胞壁c55脂质载体所必须的。TOUZE等[34]使用杆菌肽鳌合细菌体内的十一异戊二烯焦磷酸,使得脂质A磷酸化受到抑制,证明细菌细胞壁中脂质A磷酸化与十一异戊二烯焦磷酸合成直接相关。本次试验bacA基因缺失,证明经小檗碱作用后大肠杆菌细胞壁合成障碍,不仅影响细菌的耐药性,还对细菌的生长产生抑制作用。
DNA促旋酶是在异二聚体A2B2中由2个亚基gyrA和gyrB组成的良好的抗菌靶。 gyrA参与DNA断裂和团聚,gyrB催化ATP的水解。研究表明gyrB是生物素,新生霉素和5'-腺苷酰-β-γ-亚氨基二磷酸的靶位点[35],gyrA是链霉素靶位点[36]。gyrA和gyrB表达水平的显著升高会导致大肠杆菌对多种药物敏感。
macA是大环内酯转系统macAB的外膜融合蛋白,macB,也称为ybjZ是大环内酯外排转运蛋白复合物macAB的半型ABC蛋白质组分。 macA可以激活macB的ATP酶活性,增强大环内酯类抗生素的外排[37]。macAB的显著上调证明macAB外排泵可能对小檗碱有抵抗作用。
小檗碱通过抑制大肠杆菌mdt、acr和emr家族等多药耐药外排泵表达、下调phoQ、pmrC和bacA等细菌细胞壁合成关键基因影响细胞壁合成、消除质粒携带耐药基因sul2和mexE和上调抗生素靶蛋白表达等途径影响细菌抗药性。而macAB耐药外排泵活性增强可能是细菌抵抗小檗碱的反应,具体机制需进一步验证。
