HPLC-MS/MS法对琯溪蜜柚中吡唑醚菌酯残留的测定及套袋对残留量的影响
2020-10-13蔡恩兴
蔡恩兴
漳州市农业检验监测中心,福建 漳州 363000
吡唑醚菌酯是一种新型甲氧基丙烯酸酯类杀菌剂(由晓和井乐刚,2015),因其杀菌谱广、杀菌活性高、内吸性强(张梅凤和吕秀亭,2012),对植物病害有较好的防治效果(杨丽娟和柏亚罗,2012)。琯溪蜜柚Citrusmaxima(Burm.) Merr. cv. Guanxiyou是福建平和的主要经济作物,经济效益较高。近年来,随着蜜柚种植规模的不断扩大及单一化种植,蜜柚上的病害发生也日益突出,影响到蜜柚的品质和产量。吡唑醚菌酯作为蜜柚病害防治的主要农药品种之一,被当地果农广泛使用。
目前对吡唑醚菌酯的检测方法和残留代谢的研究主要集中在葡萄(李瑞娟等,2010)、杧果(刘艳萍等,2016)、苹果(兰丰等,2018)、辣椒(高志文等,2011)、铁皮石斛(许振岚等,2018)、花生(Zhangetal.,2012)、草莓(杨霄鸿等,2018)、香蕉(赵方方等,2015)等作物上,对蜜柚等柑橘类水果的研究报道较少。刘军等(2014)、李福琴等(2017)分别建立了检测柑橘中吡唑醚菌酯残留量的方法,Lesueuretal.(2008)采用高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrometry, HPLC-MS)方法测定柠檬中吡唑醚菌酯等多种农药残留,但是当前尚没有吡唑醚菌酯在蜜柚上的残留检测方法及残留动态相关研究的报道。
水果套袋因具有减少病虫害(王建武等,2003)、提高果实品质(刘建海等,2003;蔺经等,2009)、降低农药残留(陈合等,2006;刘蕾庆等,2011)等优点而被广泛推行。然而套袋对吡唑醚菌酯在蜜柚中的残留影响并未见相关报道。因此,本研究通过试验,确立高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry, HPLC-MS/MS)快速检测方法,对吡唑醚菌酯在蜜柚上的残留动态进行分析,同时研究套袋和无套袋2种处理对蜜柚中吡唑醚菌酯残留量的影响,旨在明晰吡唑醚菌酯使用的安全性及套袋对农药残留及其消解规律的影响,为果农合理使用农药及蜜柚产业化发展提供参考依据。
1 材料与方法
1.1 试验材料与仪器设备
供试作物:琯溪蜜柚。
试验材料:250 g·L-1吡唑醚菌酯乳油;吡唑醚菌酯标准品(纯度 99.4%,沈阳化工研究院);乙腈、甲醇、甲酸(均为色谱纯);无水MgSO4、NaCl(均为分析纯);N-丙基乙二胺(PSA,德国CNW)。
仪器设备:T-18 basic ULTRA TURRAX 高速匀浆机(IKA,德国);3-18K高速离心机(Sigma,德国);DIONEX Ultimate 3000-Thermo TSQ Quantum Ultra EMR高效液相色谱-串联质谱联用仪(ThermoFisher,美国)。
1.2 试验设计
田间试验于漳州市平和县小溪镇厝丘村蜜柚园中进行。参照NY/T 788—2004(中华人民共和国农业部,2004)设计田间试验,试验共设4个处理:2种施药剂量(表1),施药后设套袋和无套袋2种处理。每处理重复3次,每个处理选取6株蜜柚;设清水喷雾的无套袋处理为空白对照(CK)。

表1 吡唑醚菌酯在蜜柚上的施药及套袋处理Table 1 Spraying and bagging treatments of pyraclostrobin in C. maxima 'Guanxi miyou'
2018年7月8日,按常规方法对蜜柚整株进行均匀喷施农药(此时蜜柚已谢花约90 d),采用1次施药多次采样的方法,施药后2 d内无降雨过程。施药后待蜜柚果实表面的药液完全干燥才进行套袋处理。采样时间分别为施药后约2 h(0 d,此时果实表面药液已干),1、3、7、15和30 d;取距地面约1.4 m处树体中部位置,随机对称各采摘一个果实。采摘的蜜柚封装于塑料袋中,及时带回实验室用匀浆机匀浆后分装入洁净容器中冷冻保存,并进行检测。
1.3 分析方法
1.3.1 提取与净化 参考蔡恩兴(2017)建立的QuEChERS方法:称取搅碎均匀的蜜柚全果样品10 g(精确至0.01 g)于50 mL离心管中,加入20.0 mL乙腈、4.0 g无水MgSO4和1.0 g NaCl,用高速匀浆机匀浆2 min,4500 r·min-1离心5 min,取上清液2.0 mL转移至装有0.10 g PSA和0.30 g无水MgSO4离心管中,涡旋1 min,过0.22 μm有机滤膜供HPLC-MS/MS检测。
1.3.2 检测条件 色谱柱:Atlantis T3 Column(100 mm×2.1 mm×3 μm);流动相A为0.1 %甲酸水溶液,流动相B为甲醇;流速0.25 mL·min-1;进样量为2 μL;保留时间为6.55 min;流动相采用梯度洗脱,具体见表2。
质谱条件:电喷雾正离子源(ESI+);离子喷雾电压4000 V;雾化温度270 ℃;鞘气(N2)流速为3.62 L·min-1,辅助气(N2)流速为5.38 L·min-1,碰撞气(Ar)0.2 Pa。

表2 梯度洗脱条件Table 2 Gradient elution conditions
2 结果与分析
2.1 质谱条件的优化
选择电离(ESI+)模式,通过定量环进样对吡唑醚菌酯质谱检测参数进行优化。通过全扫描确定388 m·z-1为其母离子,选择反应监测(SRM模式)进行二级质谱自动优化,分析其质谱图及碰撞能量,最终确定吡唑醚菌酯的质谱检测参数(表3)。

表3 质谱检测参数Table 3 Parameters of mass spectrometry
2.2 线性关系和检出限
前处理采用QuEChERS方法,用提取净化得到的空白蜜柚基质配制标准工作溶液并进样分析,以吡唑醚菌酯色谱图峰面积为纵坐标、对应的质量浓度为横坐标绘制标准曲线。吡唑醚菌酯的标准曲线方程为y=60533x+148670,相关系数(r2)为0.9993,表明在1~500 μg·L-1浓度范围内线性关系良好,以3和10倍信噪比计算检出限和定量限,吡唑醚菌酯的检出限和定量限分别为0.7和2 μg·kg-1。图1为蜜柚中吡唑醚菌酯的SRM色谱图。

图1 蜜柚中吡唑醚菌酯的SRM色谱图Fig.1 SRM chromatogram of pyraclostrobin in C. maxima 'Guanxi miyou'
2.3 添加回收试验
称取蜜柚空白样品进行添加回收试验,分别加入3个水平(2、50和1000 μg·kg-1)的吡唑醚菌酯标准工作溶液,每个水平重复5次。按上述方法进行前处理和上机测定,试验平均回收率为83.8%~105.8%,相对标准偏差为2.9%~9.1%,由此表明,该方法测定吡唑醚菌酯残留准确度和精密度均较好,符合农药残留分析的要求(中华人民共和国农业部,2004)。
2.4 残留动态及消解规律
2.4.1 残留动态 对吡唑醚菌酯在蜜柚中的残留动态进行分析测定(表4),2种施药剂量处理的原始沉积量存在一定差异,推荐剂量(2000倍液)处理在蜜柚上的原始沉积量为0.5619~0.5952 mg·kg-1,而加倍剂量(1000倍液)处理为1.0732~1.1586 mg·kg-1。
在施药后1、3、7、15和30 d分别进行采样检测,套袋处理的消解率分别为27.1%~27.3%、45.3%~50.8%、71.8%、90.1%~91.9%和98.3%~98.4%,而无套袋处理的消解率分别为14.4%~16.9%、47.0%~54.1%、73.5%~80.0%、91.2%~93.6%和98.8%~99.0%。在同样的施药剂量和采摘时间下,套袋处理的消解率略低于无套袋处理(1 d的结果反过来),但在施药后30 d,4种处理的消解率均大于98%,最终趋于一致。
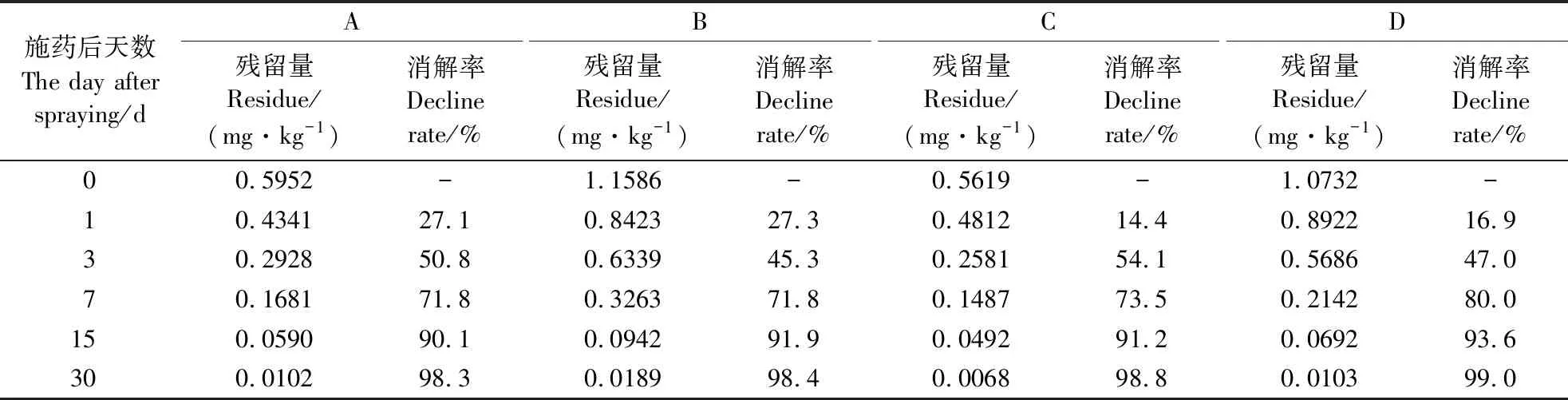
表4 吡唑醚菌酯在蜜柚中的残留消解动态Table 4 Residual degradation dynamics of pyraclostrobin in C. maxima 'Guanxi miyou'
2.4.2 消解动态及最终残留 经过回归分析,吡唑醚菌酯的残留消解动态(表5)符合一级动力学方程。套袋处理的半衰期(T1/2)为5.10~5.26 d,消解99%所需要的时间(T0.99)为33.8~34.9 d;无套袋处理的T1/2为4.48~4.79 d,T0.99为29.7~31.8 d。相同施药剂量,套袋处理的半衰期略长于无套袋的半衰期。吡唑醚菌酯在蜜柚中的4种处理,相关系数(r)在0.9918~0.9957之间,消解系数(k)在0.1317~0.1546之间,说明吡唑醚菌酯在蜜柚上半衰期相对较短。施药后65 d(此时蜜柚已成熟)测定吡唑醚菌酯的最终残留量,结果(表5)显示4种不同处理均未检出吡唑醚菌酯残留。

表5 吡唑醚菌酯在蜜柚中的消解动态方程Table 5 Degradation dynamics equation of pyraclostrobin in C. maxima 'Guanxi miyou'
3 讨论
本试验建立了高效液相色谱-串联质谱测定蜜柚中吡唑醚菌酯残留量分析方法,其中样品前处理采用QuEChERS方法,同时优化了HPLC-MS/MS的相关参数。该分析方法操作简单,灵敏度较高,检出限为0.7 μg·kg-1,定量限为2 μg·kg-1,添加回收率为83.8%~105.8%,相对标准偏差为2.9%~9.1%,适用于蜜柚中吡唑醚菌酯的残留测定。
吡唑醚菌酯在蜜柚中的残留消解动态符合一级动力学方程,套袋处理的消解半衰期为5.10~5.26 d,无套袋处理的消解半衰期为4.48~4.79 d;相同施药剂量下,套袋处理的半衰期略长于无套袋的半衰期,这可能与套袋后可以减少果实受外界环境影响有关,如光照、雨淋等(王建武等,2003),减缓农药的残留消解。吡唑醚菌酯在葡萄(李瑞娟等,2010)、辣椒(高志文等,2011)、草莓(杨霄鸿等,2018)和杧果(刘艳萍等,2016)植株中的残留消解半衰期分别为2.9~4.7、3.7~3.8、5.2~10.8和8.0~11.0 d,而在苹果(兰丰等,2018)、香蕉(赵方方等,2015)和铁皮石斛(许振岚等,2018)中的消解半衰期则较长,分别为13.5~23.6、16.7~17.2和38.1 d,这说明在不同植株间吡唑醚菌酯残留消解存在差异,上述植株除铁皮石斛外,其他消解半衰期均小于30 d。
GB 2763—2019《食品安全国家标准 食品中农药最大残留限量》(中华人民共和国国家卫生健康委员会等,2019)规定吡唑醚菌酯在蜜柚上的最大残留限量(maximum residue limit, MRL)为2 mg·kg-1,按照这个MRL计算,吡唑醚菌酯在蜜柚上的使用无安全间隔期问题。本研究的套袋方式与其他研究有所不同,已有的研究(陈合等,2006; 刘建海等,2003; 刘蕾庆等,2012)采用先套袋再多次施药,本研究结合当地蜜柚病虫害防治方式,采用1次施药多次采样检测的方法。先充分施药再进行套袋,不仅可以加快蜜柚果实转色上市,还可以减少农药的使用,确保吡唑醚菌酯在蜜柚上使用具有安全性。
