基于动物实验的环境健康风险评价模型在白洋淀水质监测中的应用
2020-10-13郝广民陈孟桥国洪宾周程艳
郝广民,姜 婧,陈孟桥,国洪宾,周程艳,刘 琳
(1.河北省保定环境监测中心,河北 保定 071000;2.河北大学 药学院,河北 保定 071002)
1 引言
据中华人民共和国生态环境部公布的《中国生态环境公报》,2000~2010年白洋淀一直处于非常严重污染状态(劣Ⅴ类),2011~2017年白洋淀水质稍有改善(Ⅴ类),2018年至今白洋淀水质比2000年有明显改善(Ⅳ类),但还未达到功能区要求(Ⅲ类)。白洋淀生态修复任重道远,白洋淀湿地对维持华北地区生态平衡和保持生物多样性发挥着生态安全屏障作用,同时白洋淀是雄安新区地标性的自然景观,也是雄安新区生态建设的重要依托,更是雄安新区“千年大计”的重要组成,故白洋淀的生态环境有着更高的要求[1,2]。目前常用的环境监测手段大多为关注单一物质或一类物质对人体健康的毒性和潜在危险性[3~6],但各种有害物质在实际生活中是并存且互影响的,共同作用于人类健康。白洋淀这种敏感重要的水域,急需一种综合评价的环境监测手段,以提供准确的环境质量及其变化趋势,为白洋淀生态修复筑牢坚实的基础。本研究对从王家寨采集的白洋淀样品进行综合分析。
药物研发和制造行业、纺织品行业,以及化妆品行业通常使用动物实验来综合评价产品对人类身体健康的安全性[7,8]。动物实验是通过观察实验动物的反应,探究其发生机制、发展规律,进而推用到人类。小鼠是动物实验常用的实验动物,因其对外来刺激敏感,并且与人类接触毒物所产生的毒性反应相似,同时具有易饲养、生长周期短等优点,广泛应用于各行业的安全性评价,但是在水质监测中的应用鲜有报道。健康风险评价( health risk assessment, HRA )将环境污染与人体健康相关联,通过估算人体接触有害因子后不良影响发生概率,把风险度分级作为目标结果,通过环境健康风险评价模型分析环境监测数据,推测出描述污染物对人体产生的危害,可为水源地水环境的健康风险管理和保护提供参考依据。常用的是于20世纪80年代由美国环保署(USE)所提出的评价方法及模型,但该模型同样关注单一物质或一类物质对人体健康的毒性和潜在危险性[9~13],需要建立一种能够综合评价健康风险的模型。
因此以白洋淀为例,尝试采用环境健康风险评价模型评价白洋淀水体环境质量现状对人体的健康风险,以期发挥动物实验在白洋淀水质监测中的作用。环境健康风险评价模型评价对象为白洋淀游客,白洋淀为5A级旅游景区,2017年旅游人数高达235万人次,游客在白洋淀游玩期间难免会接触甚至误吞白洋淀水体,若水体遭受有害物质污染,将威胁民众生命财产安全。虽然健康风险评价在20世纪80年代就已兴起,并针对白洋淀健康风险评价作出大量研究,但都是集中在研究白洋淀水体长期接触的当地居民的健康风险,鲜有研究白洋淀水体对游客的健康风险,风险识别是环境健康风险评价的第一步,也是应用基于动物实验的环境健康风险评价模型方法评价水体环境质量的精髓所在。目前常用的风险识别方式过程为:首先列出评价范围内对人体健康可能产生严重危害的物质,然后进行筛选识别,最终确定1~3个危害最大的物质。这种识别方式容易遗漏重要的污染物质,并忽视污染物之间的相互作用。基于动物实验的环境健康风险评价模型评价水体环境质量的方法,是通过建立动物实验模型,依据实验动物在接触水体后的生理反应以及病理变化,来综合识别水体中含有物质的浓度是否达到危害人体健康的程度。动物模型中的实验动物在接触到浓度足以危害人类健康的物质后,能够展现出生理反应及病理变化是基于动物实验的环境健康风险评价模型用来评价水体环境质量的前提。本研究以白洋淀水体为例,游客为对象,研究了使用基于动物实验的健康风险评价模型法评价水体环境质量的可行性。
2 研究区域概况
白洋淀(东经115°39′~116°11′,北纬38°48′~38°57′)位于雄安新区核心地带,属于海河流域大清河水系。白洋淀是华北平原唯一常年积水的浅水型淡水湖泊,也是第一大淡水湖泊湿地,素有“华北之肾”及“华北明珠”之美誉[14]。白洋淀共有国(省)控地表水点位9个,分别是枣林庄、王家寨、烧车淀、光淀张庄、南刘庄、鸪丁点、端村、圈头以及采蒲台。白洋淀点位分布见图1,本研究是从王家寨采集的白洋淀样品。
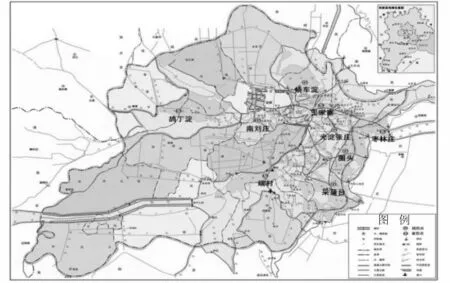
图1 白洋淀监测点位示意
3 实验材料仪器
SPF级昆明小鼠126只,雌雄各半,体重(20±2)g;普通级健康成年新西兰家兔8只,重2.5~3.0 kg,由北京维通利华生物技术有限公司提供。实验温度:22~25℃,相对湿度:55%~70%。实验期间光线12 h循环,自由饮水,进食。 实验动物许可证号:SYXK(冀)2017~0002。
2, 4-二硝基氯苯,配制1%为致敏浓度,0.1%为激发浓度;白洋淀水体(采集自白洋淀王家寨国控地表水点位);微囊藻毒素(纯度95%,瑞士Alexis 公司),配制成10 μg/L微囊藻毒素水溶液;白细胞介素-1β(IL-1β,批号:20190606)、白细胞介素-6(IL-6,批号:20190104)、肿瘤坏死因子-α(TNF-α,批号:20190104)、白细胞介素-17(IL-17,批号:20190916)酶联免疫检测试剂盒均由江苏酶标生物科技有限公司生产;Trizol(英杰公司,批号:15596-026);HiFi Script KT(批号:CW2582H)、UltraSYBR Mixture 荧光定量试剂盒(批号:CW0957H)、SuperReal PreMix Plus(批号:FP205)均购自天根生物科技有限公司;全自动酶标仪(美国伯腾); ABI7500 型荧光定量 PCR 仪(美国应用生物系统公司);BioPhotometer 型生物分光光度(德国艾本德);QL-902 型涡旋振荡仪(海门市其林贝尔仪器制造有限公司)。
4 研究方法
4.1 急性毒性试验
白洋淀水体中含有一些有害物质,游客误饮可致急性毒性反应,故建立急性毒性试验。 LD50预实验: 20只小鼠随机均衡分为4组,雌雄各半,适应饲养7 d后禁食不禁水12 h,按小鼠灌胃可承受的最大体积(40 mL/kg)分别灌胃给予白洋淀水样及其10、20、50倍浓缩液,自由进食和饮水,连续观察7 d,记录小鼠体征变化及死亡情况,拟算出半数致死量。若各组小鼠无死亡情况,则进行最大耐受量(MTD)试验。 MTD试验:40只昆明种小鼠随机均衡分为对照组和试验组,雌雄各半,禁食不禁水12 h后,按本品可以灌胃的最大浓度(白洋淀水体50倍浓缩液)及小鼠可承受的最大体积(40 mL/kg)灌胃给药,24 h内给药2次,间隔6 h,末次给药6 h后自由进食和进水,空白对照组给予等剂量生理盐水,连续观察7 d,记录7 d内受试小鼠体征变化、生理反应及死亡数,计算小鼠口服白洋淀水体最大耐受量。并于7 d后处死小鼠,取出并洗净脏器,以电子天平精密称重,记录各器官重量,重复3次,计算各脏器系数。
4.2 皮肤毒性试验
白洋淀水体中含有一定量的易敏物质,部分游客接触水体易造成皮肤过敏反应,故本研究建立皮接触途径毒性试验来评价水质。将36只SPF级昆明小鼠按照体重随机分为空白对照组、阳性对照组和试验组,分别涂抹生理盐水、2% 2, 4-二硝基氯苯及白洋淀水体。试验前24 h将小鼠腹部两侧剃毛来模仿人类皮肤。 致敏接触:将各受试物涂布于小鼠腹部左侧去毛区,随即覆盖塑料薄膜并固定,给药6 h后洗去,此后第7 d和第14 d同法操作。激发接触:末次给予受试致敏物后7 d,分别以10倍稀释后上述致敏物涂于小鼠右侧无毛区,6 h后将腹部清洗干净,观察并记录小鼠皮肤过敏反应情况。观察每次致敏后及激发接触后0 h、24 h、48 h和72 h皮肤红斑、水肿等异常反应。对激发接触后皮肤过敏反应进行评分并计算过敏率。 根据小鼠过敏平均积分及过敏率两种方式,对白洋淀水体致敏性进行具体评价。过敏反应评分标准及其发生的程度标准分别见表1、表2。

表1 皮肤过敏反应评分标准

表2 皮肤过敏反应程度评分标准
4.3 眼刺激试验
当白洋淀水体中含有一定量的刺激性物质时,水体溅入游客眼中易造成眼睛刺激性伤害,故建立急性眼刺激试验模型。选择眼部健康的8只家兔,雌雄各半,分为阳性对照组和试验组,分别取5%的溴氰菊酯溶液0.1 mL及0.1 mL白洋淀水体于左侧眼结膜囊内,使上、下眼帘被动闭合1 min,右侧眼睛用生理盐水作为阴性对照。于滴眼后1 h及每天观察和记录家兔眼结膜、虹膜、角膜损伤程度,直至眼部刺激消退。根据《化学品急性眼刺激性/腐蚀性试验方法》(GB/T 21609-2008)进行判定受试物对眼刺激或腐蚀作用的有无及强度。
4.4 口服毒性试验
若白洋淀水体含有有毒物质,游客误吞水体易产生中毒反应,故建立口服毒性模型,30只SPF级昆明小鼠适应性培养一周后按照体重随机分为空白对照组、阳性组及实验组,各组分别以生理盐水、10 μg/L微囊藻毒素溶液、白洋淀水体为饮用水,小鼠自由摄食、饮水,连续7 d。期间观察小鼠一般状态、摄食摄水等情况,记录小鼠是否出现相关不良反应及出现时间和程度,7 d后,各组小鼠禁食不禁水12 h,称重,眼眶取血,血液样品于室温下静置1 h后 3000 r/min 离心10 min,取上层血清,按试剂盒操作检测血清ALT、AST、LDH、Scr、Glucose、ALB水平;酶联免疫吸附法(ELISA)测定TNF-α,IL-1,IL-6,IL-17含量。
采血后用脊椎脱臼法处死动物,迅速采集各器官,清理干净后,以10 %中性福尔马林溶液固定24 h,梯度乙醇脱水,二甲苯透明,石蜡包埋后以手动轮转式石蜡切片机切4 μm薄片,H&E染色,在200倍光镜下进行观察。 Real-time PCR法检测胃组织中IL-1、IL-17,肝组织TNF-α、NF-κB和肾NF-κB、IL-6的mRNA表达,Trizol提取各组织样本中总RNA,检测RNA的浓度和质量;按照试剂盒说明书进行逆转录反应,将反应所得cDNA产物用于后续PCR。反应步骤如下:95 ℃ 15 min,95 ℃ 10 s,53~58 ℃ 30 s,72 ℃ 30 s,循环40次。以β-actin为内参基因,用荧光定量 PCR 仪测定样本CT值,用2-△△CT法进行相对定量分析表征基因相对表达水平。 引物序列及产物大小见表3。
4.5 综合性评价模型建立
参照《职业性接触毒物危害程度分级》(GBZ 230-2010)将急性毒性试验、皮接触途径试验、急性眼刺激试验、口服毒性试验的危害程度赋予不同权重,分别为0.1、0.2、0.2、0.5。根据上述权重情况对危害程度进行打分,公式为:综合危害程度分值=急性毒性试验得分×0.1+皮肤接触途径试验得分×0.2+急性眼刺激试验。

表3 引物序列及产物大小
试验×0.2+口服毒性试验×0.5,满分4分。急性毒性试验的危害程度评分标准为:出现小鼠死亡为4分;无小鼠死亡,且最大耐受量小于400 mL/100 g为2分;无小鼠死亡,且最大耐受量大于等于为0分。皮接触途径试验和急性眼刺激试验试验分别按照《中华人民共和国职业卫生国家标准》(GBZ/T 240.7-2006)、《化学品 急性眼刺激/腐蚀性试验方法》(GB/T 21609-2008)进行评分,极强致敏性者记4分;强致敏性者3分;中度致敏性者2分;轻度致敏性者1分;弱致敏性者0分。口服毒性试验总分为4:当出现老鼠死亡直接记为4分;没有老鼠死亡时,口服毒性模型公式为,口服毒性模型得分=是一般状态得分+脏器外观得分×0.25+脏器病理得分×0.25+脏器生化指标得分×0.25+血液生化指标得分×0.25,满分3分。当小鼠行为、外观、饮食(水)量出现异常,口服毒性模型一般状态记为1分。脏器、血液生化指标评分标准为:P≥0.5记为0分;P<0.5记为1分;P<0.01记为2分。脏器外观、病理评分标准为:无明显异常记为0分;异常似有似无为1分;有明显异常记为2分。上述4个动物试验中每有一个试验出现异常表现,则累加一个风险因子积分,否则为0,满分4分。基于上述评分标准,建立一个综合性动物模型,用以评价水体质量。
4.6 统计学分析
以SPSS 22.0 软件对本试验所得数据进行分析,采用均值-单因素方差分析法,比较各组间的显著性差异。结果以平均值±标准差(x±s)表示,P<0.05即认为差异有统计学意义。
5 结果分析
5.1 急性毒性研究
LD50预实验中,灌胃数小时后小鼠出现大便黄而稀溏,活动量减少,精神萎靡等表现,尤以50倍浓缩组为甚,但各组小鼠在给药后7 d观察期间无死亡情况。因本次试验无小鼠死亡,无法计算半数致死量,故进行了最大耐受量测定。以最大浓度和最大可承受体积进行两次灌胃给药后,2 h内大部分试验组小鼠活动量减少、反应迟钝、大便溏泻;之后小鼠症状减轻并恢复至正常;7 d内无小鼠死亡。第7 d称重后脱颈处死小鼠,解剖,肉眼可见各重要脏器质地、形态、颜色等与空白组小鼠相似无异常,器官系数无明显差异(表4、5),表明急性白洋淀水体中毒对器官伤害较小且可恢复。灌胃48 h内试验组小鼠体质量低于空白对照组,推测白洋淀水体会影响小鼠消化功能,这与部分游客误食白洋淀水体后出现急性肠胃炎的表现不谋而合,故用此模型进行急性毒性评价具有一定合理性。小鼠对白洋淀水体最大耐受量为400 mL/100 g。

表4 急性毒性试验白洋淀水体对小鼠体重影响

表5 脏器系数
5.2 皮肤毒性试验
从图2可看出,空白组小鼠未出现生理反应,而阳性对照组所有小鼠均出现大量明显红斑,致敏率为100%,说明本研究所用动物对含有2%的2, 4 -二硝基氯苯敏感,满足用来评价水体环境质量的前提。同时样品组仅一只小鼠出现了轻微的生理反应,致敏率为8.67 %,这与白洋淀水体对大多数人不会造成过敏反应的常识是一致的,证明该模型同样适用于实际水样,因此皮肤接触途径基于动物实验的健康风险评价模型评价水体环境质量可行(表6)。

表6 皮肤过敏反应计分
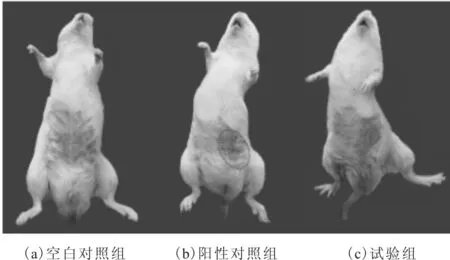
图2 激发接触24h后各组小鼠腹部过敏表现
5.3 眼刺激试验
由表3~4可以看出阳性组动物眼睛滴入2 %溴氰菊酯后1 h阳性组即出现结膜充血肿胀、分泌物增多等症状,眼刺激积分指数最高为39.25,属于中度刺激,故该模型满足用来评价水体环境质量的前提。由表3~5看出样品组也出现了轻微刺激反应,眼刺激积分指数最高为5,72 h眼刺激的平均指数为0.5,对照侧眼未见异常反应,证明该模型同样适用于实际水样,因此眼睛接触途径基于动物实验的健康风险评价模型评价水体环境质量是可行的(表7,8)。
5.3 口服毒性试验
5.3.1 小鼠一般状态观察
该结果可以初步衡量白洋淀水体有毒物质污染程度,对污染物质判定提供初步参考。试验期间,随着时间的增长,阳性组和试验组小鼠摄食量明显降低(P<0.05),而各组饮水量无较大差异,提示这两组小鼠的胃可能出现一些异常。此外,阳性组和试验组小鼠出现毛发污秽粗糙,情绪萎靡而少动,易惊,指爪苍白,大便失调等异常,观察期内各组未见死亡。空白组正常,而阳性组检出异常,且样品组出现相似异常表现,提示白洋淀水体可能受到以微囊藻毒素为主的污染(图3)。

表7 阳性组眼接触途径积分均值分布结果
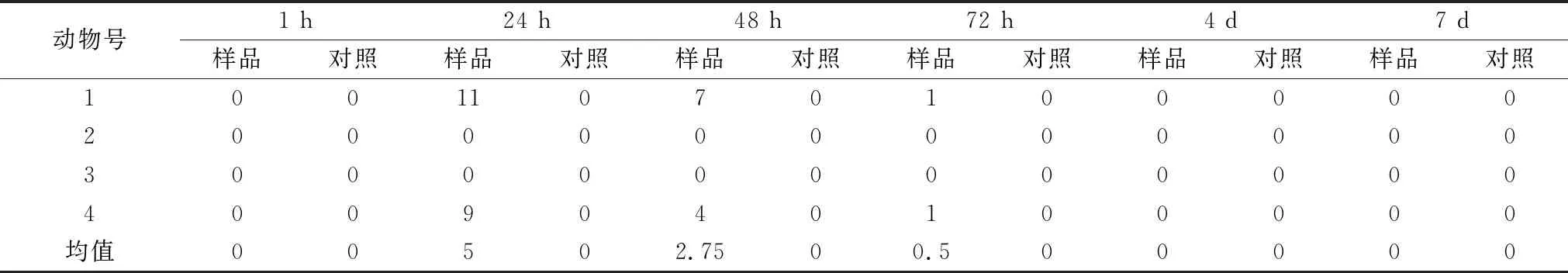
表8 试验组眼接触途径积分均值分布结果
(c)小鼠外观变化
5.4.2 小鼠脏器组织变化
污染物经口入体后,胃组织会是最先受到刺激及伤害的器官,同时肝脏和肾脏为动物最重要的代谢器官,而微囊藻毒素对肝、肾的毒性又相当大,故本研究通过血液分析及组织病理考察来衡量白洋淀水体中有毒物质污染程度,为污染物质判定提供重要参考。由图4可看出,与空白对照组相比,阳性组和试验组小鼠血清TNF-α,I L-1,I L-6及I L-17含量显著增高(P<0.05),且胃I L-1、I L-17,肝NF-B、TNF-α,肾NF-B、IL-6mRNA表达均明显增加(P<0.05),表明两组小鼠体内均有炎症发生。此外,阳性组和试验组ALT、AST、LDH及肾Scr、Glucose水平明显增加而ALB含量明显降低(P<0.05),证明微囊藻毒素溶液及白洋淀水体对小鼠脏器的确有一定损伤作用。而与阳性组相比,实验组各因子表达水平要低于阳性组,表明白洋淀水体对小鼠伤害要小于10 μg/L微囊藻毒素水溶液。
脏器形态学显示,空白对照组小鼠小鼠胃体完整、皱襞明显,黏膜层表面光滑而无出血点;肝脏外观正常无增厚和水肿;肾脏形态正常无异常增生,阳性对照组小鼠胃体颜色变浅,胃上部发黄;肝脏颜色较深,边缘较厚;肾脏表面色泽均匀无异常,试验组小鼠胃体除颜色较浅;肝形态近乎正常而颜色较深;肾脏颜色暗红但未见其他明显异常,H&E结果显示,在高倍镜下,空白对照组小鼠胃黏膜层次分明,上皮细胞排列整齐,结构清晰;肝细胞排列沿中央静脉呈现出放射索状,肝小叶结构完整清晰;肾血管球管袢薄而清楚、肾小囊腔隙均匀,小管横切面轮廓清楚。阳性对照组胃基膜层增厚,上皮细胞减少且排列疏松不规则;肝组织中肝细胞排列紊乱,肝小叶结构模糊,有细胞坏死及炎症细胞浸润;肾囊脏层破坏,肾小管管腔狭窄,管壁上皮细胞坏死,间隙内有炎症细胞浸润。试验组小鼠胃黏膜肌层少许增厚,有一定空腔;肝脏中肝小叶结构虽较完整,但仍有部分病变;肾脏中管壁细胞部分脱落,肾小管管腔狭窄且结构不完整。阳性组器官出现异常,说明该模型复制成功,试验组出现类似但较轻的异常表现,故该模型满足用来评价水体环境质量的前提,并且提示白洋淀水体可能受到一定的污染,如白洋淀水体中污染物以微囊藻毒素为主,污染程度要小于10 μg/L。
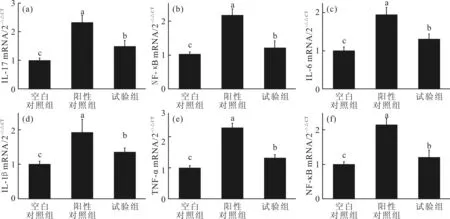
(a)、(d):小鼠胃IL-17、IL-1 mRNA表达;(b)、(e):小鼠肝脏NF-B、TNF-α mRNA表达;(c)、(f):小鼠肾脏IL-6、NF-B mRNA表达
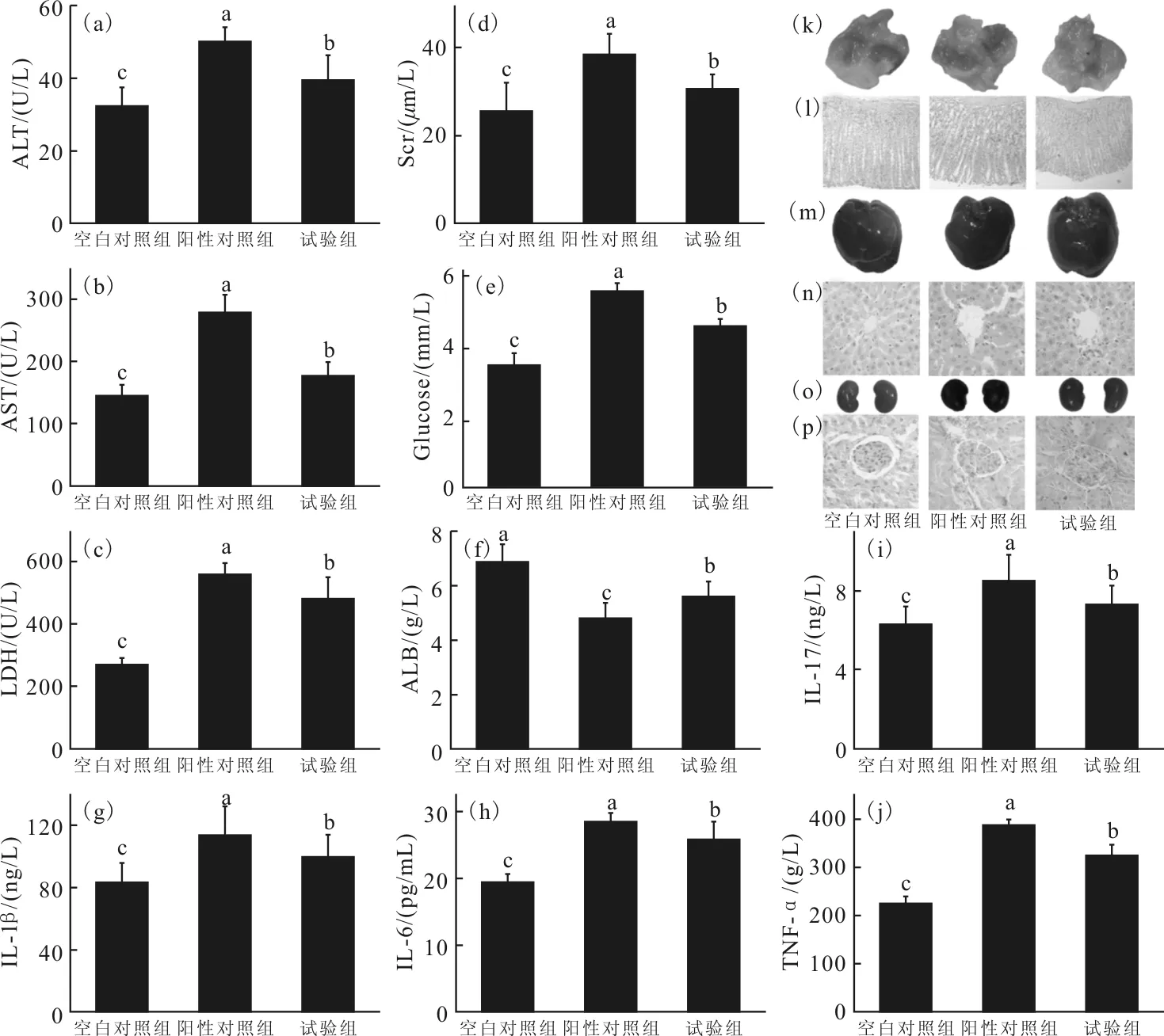
(a)~(j):血清ALT、AST、LDH、Scr、Glucose、ALB、IL-1、IL-17、IL-6、TNF-α水平;K、M、O:小鼠胃、肝、肾外观形态;(l)、(n)、(p):小鼠胃、肝、肾H&E染色
5.5 基于动物实验的水质监测模型建立和验证试验
将4种动物试验耦合,建立环境健康风险评价模型,用来评价水体环境质量。环境健康模型建立按照3个步骤来进行:首先,依据各动物试验中不同试验的权重系数及其评分进行综合危害程度分值计算,见公式(1);其次,根据在各动物试验中有无异常表现进行风险因子积分计算,即公式(2);最后,以综合危害程度评价建立数学动物模型:Y3=κY1Y2(κ为人类修正因子,通过剂量-反应评价进行计算,可以评价人类接触各环境的健康风险程度,为下一阶段工作的重点内容),评价环境质量。模型架构思路如图6所示。
(1)
(2)
在此模型架构下,对白洋淀水样进行验证试验,综合危害程度分值公式变为Y1=0.1A+0.2B+0.2C+0.5D。将各项得分带入公式(急性毒性试验得分为0,皮接毒性试验得分为0,眼刺激试验得分0分,口服毒性试验得分2.25,风险因子积分为1分),得出白洋淀水体对小鼠的综合危害程度分值为1.125。健康风险评价结果为小鼠通过口服途径接触白洋淀水体具有轻度健康风险,风险物质可能为微囊藻毒素。经数学模型(Y3=κY1Y2)计算出环境质量分值为1.125,对于试验动物来说,白洋淀水质有轻度污染。(水体环境质量标准暂定为不足1分为洁净,1~3分为轻度污染,3~6分为中度污染,6分及以上为重度污染)。该验证实验重复进行3次环境质量分值均为1.125,故认为结果真实可靠,该模型可行。
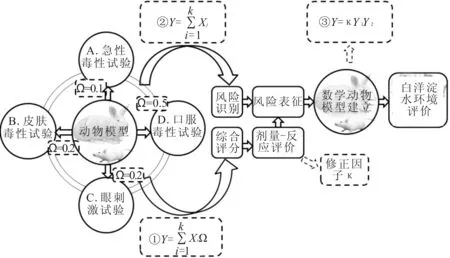
图6 水质环境健康风险评价模型示意
6 探讨
据中华人民共和国生态环境部公布的中国生态环境公报,白洋淀自2011~2019年一直处于富营养状态,甚至2012年达到重度富营养状态。在这九年间,化学需氧量及高锰酸盐指数基本上是其主要污染物,只有2011年时高锰酸盐指数不是其主要污染物。近年来,化学需氧量及高锰酸盐指数有所下降,但幅度差强人意,其溯源问题一直是白洋淀生态修复的热点及难点。在口服接触途径模型实验中,样品组的反应与阳性对照组极为相似且程度较轻。口服接触途径模型阳性对照组使用的是超过《地表水环境质量标准》(GB/T3838-2002)标准限值10倍的微囊藻毒素,小鼠出现食欲下降、毛皮及行为异常这些明显的中毒症状,并且肝、肾、胃、脾器官发现损伤,ALT、AST、Scr、ALB,TNF-α,I L-1等指标均出现差异,TNF-a、I L-1b、I L-6、I L-17及NF-kB表达明显增加。样品组同样出现了食欲下降、毛皮、器官受损、生化指标异常等这些明显的中毒症状。结合白洋淀水体采集季节为盛夏,藻类生长茂盛,推断白洋淀水体中可能含有超过1 mg/L但低于10 mg/L的微囊藻毒素。同时我们注意到2018年化学需氧量及高锰酸盐指数存在与季节相关的变化规律,即夏季为顶峰冬季为低谷[15],与藻类生长规律相符。因而推断微囊藻毒素很可能是白洋淀水体中化学需氧量及高锰酸盐指数来源之一。可见动物实验模型在水环境质量监测中存在巨大的潜力。
白洋淀水体现有监测体系并不全面,不能综合监控水质现状及变化趋势,很难满足雄安新区建设对白洋淀生态保护及修复的需求,急需能够综合评价水质的监测分析方法。本文初步以白洋淀水体为例,游客为对象,建立了一种能够综合评价水体环境质量的模型。研究了使用基于动物实验的健康风险评价模型法评价水体环境质量的可行性。设计了急性毒性动物实验,并依照游客有可能接触白洋淀水体的途径设计了皮肤接触途径、口服接触途径,以及眼睛接触途径的动物实验。构建了综合危害程度分值及风险因子积分数学计算公式,以环境健康风险评价做为桥梁,并通过数学模型计算出的环境质量分值,将动物实验结果与水体环境质量联系起来。应用基于动物实验的环境健康风险评价模型方法评价水体环境质量的精髓在于综合性的风险识别,因而基于动物实验的环境健康风险评价模型用来评价水体环境质量的可行性是基于动物模型中的实验动物在接触到浓度足以危害人类健康的物质后,能够展现出生理反应及病理变化。生理盐水以及浓度足以致人体过敏、中毒和眼部刺激的药物用来作为质控及阴、阳性对照,白洋淀水体(王家寨)用来检验该模型方法应用在实际水样的效果。研究结果表明:生理盐水未引起任何一个动物模型的阳性反应;各模型的阳性对照组所产生的阳性反应与文献一致[16,17];各模型的样品组反应与常识一致。研究表明急性毒性动物实验模型、皮肤接触途径、口服接触途径,以及眼睛接触途径的动物实验能够对白洋淀游客进行综合性的风险识别,并做了模型验证试验,证明基于动物实验的环境健康风险评价模型评价白洋淀水质是可行的。
与动物实验在纺织、化妆品行业应用不同,在环境监测领域中,不能止步于证明存在或不存在对实验动物健康有害物质,而要升华到环境要素中是否有浓度超过人体健康风险阈值的物质。动物实验很难直接表述某物质浓度多少,是否对人体有害,需要通过环境健康风险模型方式作为中介来表达。本文仅初步探索了动物实验在环境监测中的应用,建立并印证了基于动物实验的环境健康风险评价模型的可行性。完整的环境健康风险评价模型还需要通过剂量-反应步骤得出修正系数,使得该模型由实验动物推广至游客,同时需要完善健康风险表述、环境质量评分标准等部分,在后面工作中将会完成。该组模型不仅可以评价白洋淀游客的环境健康风险,还可以通过改变模型培养条件来满足不同研究区域及不同人群的健康风险评价。适用于各类饮用水水源地、重要生态功能区这类敏感、重要环境要素的环境监测中(不仅仅水体、还包括气体、土壤等要素),能综合全面准确地给出其环境质量。
