血清胱抑素C检测在乳腺癌筛查、诊断及术后评估中的临床价值
2020-10-12张刚强
张 强,黄 岩,李 娟,王 锦,张刚强,王 伟
近年来,乳腺癌在我国的发病率呈逐年升高趋势,目前已居女性恶性肿瘤的首位[1-3]。虽然已经提出并运用多种治疗策略来根除乳腺癌,但其病死率仍居高不下[4]。究其原因主要与乳腺癌早期诊断延误和复发转移密切相关,因此乳腺癌早期诊断和治疗后病情及时有效评估一直是乳腺癌基础研究与临床研究的热点与难点。胱抑素C (Cysatin C,Cys C)是调节半胱氨酸蛋白酶胞外活性的主要内源性抑制剂,具有抑制半胱氨酸蛋白酶调解细胞外蛋白水解的生理功能。研究[5]显示,Cys C还参与了结肠癌、胃癌、子宫内膜癌及黑色素瘤等恶性肿瘤的进展过程。但Cys C能否作为一种新的标志物用于乳腺癌诊断与病情评估,目前相关报道则不多见。我们采用胶乳增强透射免疫比浊法和Western blotting法分别检测了乳腺癌病人血清及组织Cys C的表达水平,分析乳腺癌病人血清与组织Cys C表达状况,探讨血清Cys C在乳腺癌筛查、诊断及病情评估监测等方面的临床价值。现作报道。
1 资料与方法
1.1 一般资料 选择2018年2月至2019年8月我院收治的女性乳腺癌病人53例作为乳腺癌组,年龄27~75岁;选择住院治疗的女性乳腺良性肿瘤病人48例为良性病组,年龄26~75岁,其中乳腺纤维腺瘤35例,脂肪瘤5例,乳腺导管内乳头状瘤3例,乳腺良性叶状肿瘤1例及其他乳腺良性肿瘤4例。病人均明确诊断且全部经病理诊断证实,术前均未接受放、化疗、内分泌及其他针对肿瘤的治疗。选择同期在我院体检的女性健康者40名为对照组,年龄28~79岁,均无乳腺疾病史。3组入选对象均剔除合并肝、肺、肾功能异常、高尿酸血症、糖尿病、糖尿病肾病、甲状腺功能异常等影响Cys C水平的疾病者。3组年龄均具有可比性。本研究获得蚌埠医学院第一附属医院伦理审查委员会的审批和病人的知情同意。
1.2 标本采集与处理 抽取研究对象晨起空腹状态静脉血3.5 mL,室温静置30 min,3 500 r/min离心15 min,迅速分离血清备用;收集乳腺良性肿瘤病人与乳腺癌病人手术切除的瘤组织标本,避免坏死组织,其中,乳腺癌病人同时收集对应癌旁组织(距癌组织≥3 cm,作对照组)标本。所有组织标本均在离体后30 min内经液氮速冻再置入去酶后的冻存管放入-80 ℃冰箱冻存备用。
1.3 主要试剂和仪器 Cys C检测试剂与校准品(与Cobas8000型全自动生化分析仪配套),兔抗人Cys C单克隆抗体(Bioworld Technology,美国),HRP标记的羊抗兔IgG二抗(SAB公司,中国)。Cobas8000型全自动生化分析仪(罗氏公司,瑞士),FTI-500型凝胶成像系统(日本FujiFilm公司),FR-200紫外与可见分析装置(上海复日科技公司),ChemiDocXRS成像系统(BIO-RAD,美国)。Gene Tool V3.04b图像分析软件(Gene Tools公司,美国)。
1.4 方法
1.4.1 血清Cys C检测 采用胶乳增强透射免疫比浊法,严格按照仪器及试剂说明书操作检测血清标本Cys C水平。在血清分离后2 h内完成检测。
1.4.2 Western blotting法检测瘤组织Cys C蛋白表达 Western blotting法操作参照文献[6],取出-80 ℃保存的组织标本,在液氮条件下碾碎成粉末状,迅速置冰上裂解30 min,充分匀质后,1 000 r/min离心15 min,收集上清液,用BCA法检测蛋白浓度,取定量组织蛋白与缓冲液1∶1混合后,100 ℃煮沸5 min。常规进行蛋白电泳,转膜及封闭,洗膜3次(每次10 min),加入稀释的一抗(1∶1 000),置4 ℃冰箱孵育过夜。第二天早上取出PVDF膜洗3次(每次10 min),随后将PVDF膜置于稀释的二抗溶液(1∶2 000),室温孵育2 h,同样洗膜3次(每次10 min),显色并进行曝光和图像采集,用Gene Tool V3.04b型图像分析软件分析蛋白条带吸光度,以GAPDH为内参对照,Cys C蛋白相对表达量=Cys C蛋白条带吸光度值/对应内参GAPDH吸光度值。
1.5 统计学方法 采用t(或t′)检验、方差分析和q检验。采用受试者工作特征曲线(ROC曲线)评估血清Cys C对乳腺癌的诊断效能。
2 结果
2.1 3组血清Cys C水平比较 血清Cys C含量乳腺癌组高于对照组和良性病组,良性病组高于对照组(P<0.01)(见表1)。其中部分病人(53例乳腺癌病人中42例)同时检测了术后血清Cys C含量,结果显示手术治疗后乳腺癌病人血清Cys C水平(1.063±0.045)mg/L较术前未治疗时血清Cys C水平(1.182±0.037)mg/L降低(t=2.77,P<0.01)。
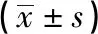
表1 3组血清Cys C水平比较
2.2 ROC分析血清Cys C检测对乳腺癌的诊断效能 通过对乳腺癌病人血清Cys C检测结果作ROC曲线分析,结果显示Cys C曲线下面积(AUC)为0.84,ROC曲线上约登指数最大处对应的临界值(1.015 mg/L)作为截断值,Cys C≤1.015 mg/L为阴性,Cys C>1.015 mg/L为阳性,其诊断乳腺癌的敏感度为67.92%,特异性为80.00%,准确度73.12%,有较高的诊断效能(见图1)。
2.3 乳腺癌病人血清水平与其临床病理参数间关系 46例乳腺癌病人(53例乳腺癌病人中有完整临床病理资料的46例),其中年龄>50岁、肿瘤直径≥2 cm、浸润型导管癌、有淋巴结转移、临床分型为Ⅲ型的乳腺癌病人血清Cys C含量高于年龄≤50岁、肿瘤大小<2 cm、浸润型小叶癌、无淋巴结转移、临床分型为Ⅰ~Ⅱ型的病人,差异均有统计学意义(P<0.01) (见表2)。
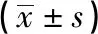
表2 乳腺癌病人不同临床病理特征与其血清Cys C表达差异
2.4 乳腺癌组织、癌旁组织及乳腺良性肿瘤组织Cys C蛋白表达 53例乳腺癌病人癌组织及癌旁组织蛋白提取符合Western blotting法检测要求的40例,48例乳腺良性肿瘤病人组织蛋白提取符合要求的35例。Western blotting法检测结果显示,Cys C蛋白在乳腺癌组织表达低于癌旁组织,癌旁组织表达低于乳腺良性肿瘤组织,差异均有统计学意义(P<0.01)(见图2、表3)。
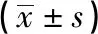
表3 乳腺癌组织、癌旁组织及良性肿瘤组织Cys C蛋白相对表达水平比较
3 讨论
Cys C是胱抑素家族的分泌分子,由120个氨基酸残基组成,广泛表达于机体所有有核细胞和大多数器官。Cys C是半胱氨酸蛋白酶内源性天然抑制剂,可调节溶酶体组织蛋白酶S、H、B、L、K的胞内和胞外活性;Cys C除具有蛋白酶抑制活性外,还参与其他多种生物学功能的调控[5],意味着该分子在基因或蛋白水平表达变化,可能与多种病理状态的发生发展密切相关[7]。临床上一直以来将Cys C作为比肌酐更好的监测肾功能内源性标志物,用于临床病人肾功能,特别是儿科病人化疗期间肾小球滤过率等肾功能的监测与评估[8]。近年来相关研究[9]显示,Cys C表达水平的改变与癌症病人的临床结果存在着某种意义上的联系。
乳腺癌细胞可分泌具有直接溶解细胞外基质成分的半胱氨酸蛋白酶等酶类,这些酶类在乳腺癌细胞以血行播散途径发生侵袭转移中发挥着重要作用,Cys C作为半胱氨酸蛋白酶类天然抑制剂,可能在其中发挥着重要的调控作用。为了解Cys C与乳腺癌之间的关系,进一步明确乳腺癌病人血清Cys C表达状况及其在乳腺癌诊断与术后病情评估方面的临床价值。本次研究检测了初次确诊且未做治疗的女性乳癌病人、乳腺良性肿瘤病人与健康对照者血清Cys C水平,结果显示乳腺癌组高于对照组和良性病组,良性病组高于对照组,乳腺癌病人血清Cys C水平AUC为0.84,曲线约登指数最大处对应的截断值为1.015 mg/L,其诊断乳腺癌的敏感度为67.92%,特异性为80.00%,准确度73.12%。这与相关文献报道对乳腺癌诊断具有一定特异性的血清标志物CA153在乳腺癌诊断效能上相似,而且在诊断乳腺癌的准确度与特异性方面较文献报道的CA153指标更好[10-11]。由于这些乳腺癌病人初诊时临床上均没有明显影响Cys C水平的其他疾病(如肾功能改变等),上述检测结果提示血清Cys C水平检测在女性乳腺癌的筛查与诊断方面具有较高的临床价值,有成为乳腺癌诊断新的血清生化标志物和独立诊断乳腺癌的潜能。笔者进一步分析还发现,手术治疗切除癌组织后病人血清Cys C水平较初诊时下降。另外,我们对乳腺癌病人相关病理资料与其血清Cys C水平的关系进行分析,还发现病人淋巴结转移及临床分期也与病人血清Cys C水平存在一定的联系,以上这些更进一步说明血清Cys C水平变化与女性乳腺癌病人的病情具有很好的相关性。
从Cys C对半胱氨酸蛋白酶抑制功能有阻碍肿瘤进一步发展角度分析,Cys C在乳腺癌病人体内表达理论上应该是低的,但实际检测结果却显示乳腺癌病人组血清Cys C水平较正常对照组明显升高。结合人体所有有核细胞均有合成和分泌Cys C功能[7],我们分析可能是某种因素导致乳腺癌病人瘤组织表达Cys C过低或Cys C与乳腺癌细胞分泌的半胱氨酸蛋白酶之间正常平衡被打破,随之机体产生应激性反应,代偿性增加Cys C的合成与分泌以抑制相对增多的半胱氨酸蛋白的活性,使其无法对正常细胞和胞外基质进行降解和破坏,并最终引起病人血清Cys C水平升高,且血清Cys C水平变化与病人肿瘤体积或病情可能具有一定的相关性。为了验证这种推测和进一步明确乳腺癌组织Cys C蛋白表达状况,我们检测了乳腺癌组织、癌旁组织及乳腺良性肿瘤组织Cys C蛋白水平,结果显示乳腺癌组织Cys C蛋白表达既低于癌旁组织又低于乳腺良性肿瘤组织。这些结果则证实了我们上述对乳腺癌病人血清Cys C升高可能原因的推测。当然这种Cys C在瘤组织与血清表达的异质性/不一致性,再结合相关文献报道Cys C对细胞内外的组织蛋白酶抑制作用的差别[11],我们推测Cys C可能还通过与酶抑制活性无关的其他更为复杂的作用机制影响着乳腺癌的发生发展,这些还有待于进一步探究。
综上所述,血清Cys C作为乳腺癌生化辅助诊断指标,可能在乳腺癌筛查、诊断及手术治疗等评估中具有重要的临床参考价值。本研究存在一定的局限性:由于对入选对象影响Cys C水平并发症的严格排除,使得样本数偏少;其次,本研究主要是回顾性分析,缺乏前瞻性研究设计,因此没有对入选研究对象复发转移时血清Cys C水平做进一步跟踪检测和瘤组织分泌的Cys C作出明确的细胞定位,以上这些均是我们以后继续努力探索的方向。
