颅内动脉瘤破裂风险评估中CTA的有效性及形态学特征分析
2020-10-12沈龙山朱晶洁王大巍
吴 磊,沈龙山,朱晶洁,王大巍
颅内动脉瘤(IA)是临床常见的脑血管疾病,因脑动脉内腔局限性非正常扩张致动脉壁瘤状突出。该病是导致蛛网膜下腔出血重要原因,具有较高致残率和死亡率。因IA发生位置较特殊,病情重,使得诊断难度增大,影响到早期治疗。瘤体血流动力学变化在IA发生发展、破裂中有着重要作用,会引起瘤体和载瘤动脉形态学发生改变[1]。所以,IA形态学改变能够反映出瘤体的状态变化,但对于是否具有预测价值临床尚无统一看法,因而需更深入研究。现阶段,数字减影血管造影(DSA)是临床诊断IA的金标准,但费用较昂贵,且有一定创伤性,操作较为复杂。近年来,随着影像学技术创新发展,CTA作为新型诊断技术,有着更高分辨率,且操作便捷、无创,在临床上逐步应用开来。本文主要对我院诊治的103例IA病人的CTA诊断资料进行回顾性研究,分析破裂和未破裂动脉瘤瘤体的形态学特征表现,明确风险因素。现作报道。
1 资料与方法
1.1 一般资料 选择我院2017年1月至2019年5月诊治的103例IA病人临床资料,开展回顾性研究。本组病人均经CTA检查和DSA或手术确诊,术前接受影像学检查。动脉瘤破裂组纳入标准:(1)自发性蛛网膜下腔出血,满足并接受CT血管造影检查,经DSA或手术确诊;(2)既往无自发性蛛网膜下腔出血病史;(3)临床资料完整,具有典型蛛网膜下腔出血的临床表现。未破裂组纳入标准:经CTA、DSA或手术确诊为未破裂动脉瘤,且无典型蛛网膜下腔出血临床表现。2组排除标准:(1)外伤性动脉瘤;(2) CTA成像质量不佳无法评价形态学特征;(3)难于显示瘤颈及与载瘤动脉解剖关系;(4)伴血管畸形。本研究得到医院伦理委员会批准。103例中,男49例,女44例;年龄37~79岁;单发动脉瘤94例,多发动脉瘤9例;破裂组动脉瘤78例(84个瘤体),未破裂组动脉瘤25例(28个瘤体)。
1.2 方法
1.2.1 DSA检查 应用飞利浦公司生产的AlluraXper FD20型DSA机进行检查,并备好高压注射机,采用改良式Seldinger技术经股动脉完成穿刺,选择性穿刺超选到双侧颈内动脉、前交通动脉、双侧椎动脉。在进行造影时,X线C臂需旋转240°/4.1 s,并准确采集每秒30帧图像,矩阵为1024×1024。
1.2.2 CTA检查 应用荷兰Philips公司提供的Brilliance 64排128层螺旋CT,扫描方式为螺旋扫描,扫描方案为病人仰卧位,扫描范围自主动脉弓至颅顶。头颈部CTA扫重建矩阵512,准直器64×0.625,螺距0.923。应用高压注射器经肘静脉注入对比剂碘普罗胺(370)60~80 mL,注射流率为4.0~4.5 mL/s,扫描条件为管电压120 kV,管电流250 mAs/Slice,层厚0.9 mm,间隔0.45 mm,使用对比剂团注示踪技术扫描。
1.2.3 图像后处理 扫描获取的容积数据传输至Philips公司提供的Extended Brilliance Workspace 4.5工作站对所得图像进行后处理,应用多平面重建(MPR)、最大密度投影(MIP)及容积再现技术(VR)等行三维重建。为保证动脉瘤有关指标测量的准确性和一致性,由2名高年资神经放射医生分别独立测定动脉瘤病人参数,将平均值应用到后续分析中。
1.3 观察指标 观察并记录本组病人破裂与未破裂数量,掌握单发病例和多发病例的破裂发生数量;同时要掌握本组病人的动脉瘤分布部位,主要是后交通动脉、前交通动脉、大脑中动脉、大脑前动脉等,同时掌握动脉瘤数量、测定瘤体长度(即瘤体深度)、瘤颈宽度,同时计算出瘤体高度和瘤颈宽度比(AR)、瘤体深度和载瘤动脉直径比(SR)、动脉瘤面积与瘤颈处载瘤动脉面积比值(面积比)的数值(见图1);同时观察和统计本组病人的子囊数量。
1.4 统计学方法 采用t检验、χ2检验以及logistic回归分析。
2 结果
2.1 IA破裂发生情况 本组103例病人经CTA检查和DSA术中确诊,瘤体破裂78例,占比75.73%,未破裂瘤体25例,占比24.27%。典型病例见图2~3。
2.2 IA破裂和未破裂形态学特征对比 通过对破裂组和未破裂组病人CTA分析,瘤体大小、瘤体位置、AR 、SR、面积比及子囊数差异有统计学意义(P<0.05);IA破裂率以后交通动脉为主,其次是前交通动脉、大脑中动脉、大脑前动脉,最后是后循环,差异有统计学意义(P<0.05~P<0.01)(见表1)。
2.3 logistic回归分析 以IA破裂为自变量,以表1存在统计学差异指标作为变量,进行logistic回归分析,结果表明瘤体大小、AR、SR、面积比是IA瘤体破裂的独立风险因素(见表2)。
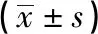
表1 IA破裂组和未破裂组形态学表现比较

表2 IA病人的形态学特征指标logistic回归分析结果

分组n子囊数[n;(百分率)%]病灶位置[n;(百分率)%] 后交通动脉 前交通动脉 大脑中动脉 大脑前动脉 后循环 破裂组7847(60.26)26(33.33)19(24.36)18(20.08)9(11.54)6(7.69)未破裂组256(24.00)3(12.00)4(16.00)5(20.00)6(24.00)7(28.00)t—9.96∗11.94∗P—<0.01<0.05
3 讨论
IA破裂引起的蛛网膜下腔出血是致死致残率较高的脑血管病,临床发病原因主要是脑血管先天缺陷、动脉粥样硬化等。以单发为主,多发相对较少。该病具有较高的死亡率,且在出血性脑血管病变中的死亡率更高,所以必须尽早诊治,更好地改善预后[2]。
CTA是一种新型无创性诊断技术,临床应用日益广泛,能够较准确地显示IA的病变表现,且能更全面、准确地预测病情发展情况,为临床治疗给予提供针对性的指导,而影响到预后,提升病人生存生活质量[3]。CTA成像原理就是经静脉注射对比剂后,在靶血管内及循环血中的浓度达到峰值,再通过CT扫描,将得到影像数据通过专业计算机软件进行处理建立三维图像,能够更清晰地显示颅内动脉主干血管壁及周围微动脉分支。在检查中,要控制好对比剂流速,确保靶血管内对比剂浓度较高,以提升扫描效果。但要注意的是,空间分辨力和对比剂注射流速直接关系到结果准确性[4]。
临床学者[5]对未破裂IA病人进行5年以上随访发现,多发IA的破裂发生率是6.8%,单发IA为1.9%,差异有统计学意义;多发IA破裂风险是单发IA的近2倍[6]。本研究中,单发IA破裂72例,多发IA破裂6例,发生率无明显差异,这与有关研究报道的结果有所不同,原因可能是因为本研究资料的破裂病例和多发IA的样本较少。另外,多发IA破裂出血临床预后相比单发要差,因而早期处理责任瘤体是治疗关键,但是对于非责任瘤体的处理当前临床尚无统一标准。所以,在多发IA处理时,关键是要准确判断责任瘤体,特别是在病人无法一次性完成处理时。可通过以下几点来判断多发IA中的责任动脉瘤:(1)CTA图像中显示出血量集中位置,尤其是局部血肿部位;(2)病人存在明确的定位体征,如动眼神经麻痹;(3)瘤体形态不规则或者体积偏大;(4)表现出多分叶形状、凸起。
IA破裂是引起自发性蛛网膜下腔出血主要原因,有着很高死亡率和致残率。从临床实际情况看,大部分病例是因出现蛛网膜下隙出血行CTA检查检出动脉瘤,在瘤体发生破裂后会造成严重后果,但并不是所有未破裂瘤体都会破裂,同时加上各种预防性干预医疗风险和IA自然破裂率相近,所以未破裂IA治疗策略是神经外科一个争议所在。现阶段,尚无简单、便捷、准确、易行的未破裂IA破裂风险预测指标。预测IA破裂风险的指标主要是通过IA瘤体的位置、瘤壁形态,IA位于后交通动脉和不规则瘤壁的破裂风险明显增加;但破裂动脉瘤中有很大一部分并非发生于后交通动脉与不规则瘤壁。本研究中,IA破裂率以后交通动脉最高,占到33.33%,其次是前交通动脉、大脑中动脉、大脑前动脉及后循环,分别为24.36%、20.08%、11.54%、7.69%。IA位于后交通动脉时的破裂风险增加,但是IA位于后交通动脉与不规则瘤壁并非一定会破裂[6-7]。
虽然诸多研究发现IA破裂病人和未破裂病人间瘤体大小、AR、SR能有效预测IA破裂的风险,但这类研究结果仍未达成共识,存在很大的争议。此种不一的研究结果可能是因为这几方面导致的:(1)预测IA发生破裂时,未调节病人的个体性影响因素;(2)临床学者应用现代多种影像技术(CTA、MRA、DSA) 以及相应的图像测量和后处理方法[8-9]。本研究中,以瘤体形态学指标和病人临床情况作为调节变量,通过多因素logistic回归分析计算,结果显示,瘤体大小、AR和SR均为动脉瘤破裂的独立风险因素(P<0.05)。对于面积比值不但考虑动脉瘤自身因素(瘤体的高度与宽度),且还需考虑载瘤动脉直径以及瘤颈。对相关变量进行多因素logistic回归分析,结果表明面积比和IA破裂具有相关性。另外,破裂组病例的动脉瘤面积比大于未破裂病例。伴随动脉瘤瘤体的进展增大,瘤内的血流变缓,瘤壁的剪切力也会减小,而动脉瘤更易破裂[10]。基于这些研究结果,本研究从血流动力学角度对面积比进行系统论述。本研究将动脉瘤面积(A1)表示在单位时间内动脉瘤可以容纳血容量,对于瘤颈处载瘤动脉面积(A2)意味着载瘤动脉在单位时间内可通过瘤颈供给动脉瘤血容量。如在A1相同的条件下,A2越小表示载瘤动脉单位时间内可通过的瘤颈供给动脉瘤血量越少,其瘤内血流速度会逐步变缓,瘤体内壁面切应力整体会变低,IA越易出现破裂[11]。在A2相同条件下,A1越大表示单位时间内动脉瘤能容纳血容量就会越大,IA瘤内血流速度会随着变,瘤内平均壁面切应力就会越低,动脉瘤更易发生破裂[12]。
近年来,子囊逐步成为破裂动脉瘤一个判断的重要根据,同时可及时传递出破裂的危险信号。国外研究学者指出子囊形成对于动脉瘤的破裂存在影响[13]。本研究结果显示,破裂组病人的子囊存在率为60.26%,高于未破裂组的24.00%(P<0.01)。所以,子囊形成是动脉瘤破裂一个危险因素,据统计,存在子囊的IA破裂风险是无子囊形成的5.6倍,但是子囊存在数和分布与IA破裂不具相关性[14]。
综上所述,CTA能够准确、清晰地显示出IA的形态学特征,其中瘤体大小、AR、SR及面积比等形态学表现是IA破裂风险的独立评估指标。但因样本数量影响,本研究结论存在一定不足,未来需开展大样本的课题研究,以保证结果的准确性。
