北京水毛茛分布与环境特征关系研究
2020-10-10韩丛海范雅倩赵新元
韩丛海,范雅倩,蒋 健,宋 泽,赵新元
(北京松山国家级自然保护区管理处,北京 102115)
人类活动加剧与全球气候变暖导致大量物种濒临灭绝,由此引起生物多样性降低从而削弱生态系统稳定性[1]。水体面积占全球地表总面积的76%[2],其中生存的大量水生植物对于维持全球生态系统稳定性具有举足轻重的作用。例如,毛茛科(RanunculusL.)沉水植物具有调节气候、改善水质、提供医药材料[3]等作用,是重要的植物种质资源库和遗传基因库。研究表明,水体水深、水温、溶解氧、pH、盐离子、总氮、浊度等物理化学因素对水生植物生长分布具有显著影响[4],水环境变化会导致某些水生植物种群绝灭,尤其是某些生境范围较窄的水生植物,如,北京水毛茛。
北京水毛茛(BatrachiumpekinenseL.Liou)为北京市特有沉水植物,是北京市Ⅰ级保护植物,为毛茛科、水毛茛属下的一个种,主要分布在北京昌平南口至居庸关一带的山谷丘陵溪水中[5]。北京水毛茛对水质要求极高,一般生长于浑浊度低、化学需氧量低的清澈水体中,是水体质量的重要指示物种,对于水生生态系统的健康评估具有重要指导意义。北京水毛茛群落结构单一,常形成单优群落,抗干扰能力较差,近年来,北京水毛茛种群和个体数量呈减少趋势[6],亟待保护。由于北京水毛茛分布的地域性,关于其群落调查的研究极少,现有的研究多为水生植被群落调查性研究[7-8],仅有个别研究探讨北京水毛茛水环境因子[9],对于影响北京水毛茛生长分布的环境因素一直以来缺乏全面深入的研究。
目前,对于珍稀植物的保护方式主要有就地保护和迁地保护。就地保护是以建立国家公园、自然保护区、风景名胜区等自然保护地的方式,对珍稀植物及其生境进行保护,这是对物种原生生境保护的首选方式。本文全面调研了松山自然保护区及其相邻的玉渡山自然保护区内北京水毛茛的生长分布情况,并对水系水文特征、水质特征与微生物多样性等生态环境指标进行了调查分析,旨在揭示影响北京水毛茛生长分布的物理、化学与生物因素。
1 研究区概况
北京松山国家级自然保护区位于北京延庆区境内,地理坐标为北纬40°29′05″~40°35′40″、东经115°43′44″~115°52′38″,总面积达6 212.96 hm2,海拔位于627~2 233 m之间,是华北地区典型暖温带森林生态系统,年均气温8.5 ℃,年降水量493 mm。松山保护区内野生动植物资源丰富,据不完全统计,现有维管束植物757种、哺乳动物29种、鸟类120种。松山保护区面积仅占北京市总面积的0.37%,而其裸子植物和被子植物种类却分别占北京市种类的50%和42%,成为北京地区重要的物种多样性中心[6]。
玉渡山区级自然保护区位于北京延庆区境内,与松山保护区相邻,地理坐标为北纬40°29′24″~40°37′0″、东经115°49′22″~115°59′8″,总面积达9 082.6 hm2,海拔位于600~1 600 m之间。据不完全统计,玉渡山保护区内有维管束植物713种、哺乳动物20余种、鸟类125种。
2 研究方法
2.2 样点设置与样品采集
经实地踏查,松山保护区塘子沟与玉渡山保护区西北沟分布有北京水毛茛。2019年6月,在上述2条溪流中分别设置样点4处、3处,各样点设置3个1 m×1 m的样方作为重复,共设置21个样方(表1),记录每个样方内水生植物种类与盖度。经调查,采样区域内仅有北京水毛茛一种水生植物,为北京水毛茛单优群落,此类单优群落也见于延庆西卓家营湿地[4],北京水毛茛生境范围窄是造成这种分布现象的主要原因。溪流宽度是水系特征的重要指标,本研究用激光测距仪(PD-S)测定溪流宽度(表1)。在各样方内用500 ml无菌水样瓶采集中层深度的水样,用于水质测定与水体微生物测序。
2.2 水文与水质测定
在野外用超声波多普勒流速流量仪(LSH10-1QC)测定水体流速,用便携式多参数水质分析仪(AP-800,AQUAREAD)测定水深、水温、水体pH、溶解氧、Cl-浓度、总溶解固体等指标。在实验室应用钼酸铵分光光度法测定水体总磷含量,碱性过硫酸钾消解紫外分光光度法测定水体总氮含量,应用总有机碳分析仪(TOC-VCPH)通过燃烧氧化-非分散红外吸收法测定水体总有机碳含量,应用原子吸收分光光度计(TAS-990F)通过原子吸收分光光度法测定铜含量(检测下限为0.05 mg/L),应用紫外可见分光光度计(TU-1901)通过二笨碳酰二胼分光光度法测定六价铬含量(检测下限为0.004 mg/L)。研究样点位置信息与水系水文特征如表1所示。

表1 研究样点位置信息与水系水文特征Tab. 1 The location information and the water system and hydrological characteristics at the studied sites
2.2 水体微生物富集与测序
采集到的水样当天完成微生物富集,通过隔膜真空泵(LH-85L)将水体中的微生物富集至孔径0.2 μm的聚碳酸酯滤膜(Millipore)上,每个样品富集5 L水样。应用DNA抽提试剂盒(MP FastDNA®SPIN Kit)提取滤膜上的水体微生物宏基因组DNA,通过HiSeq平台进行细菌16S rRNA V4区域和真菌ITS1区域高通量测序,其中细菌测序引物为515F和806R[10],真菌测序引物为ITS1和ITS2[11]。应用QIIME平台对高通量数据进行质控与分析,并计算每个样品的微生物群落物种丰富度(Chao1指数,表2)。Chao1指数的计算公式[12]如下:
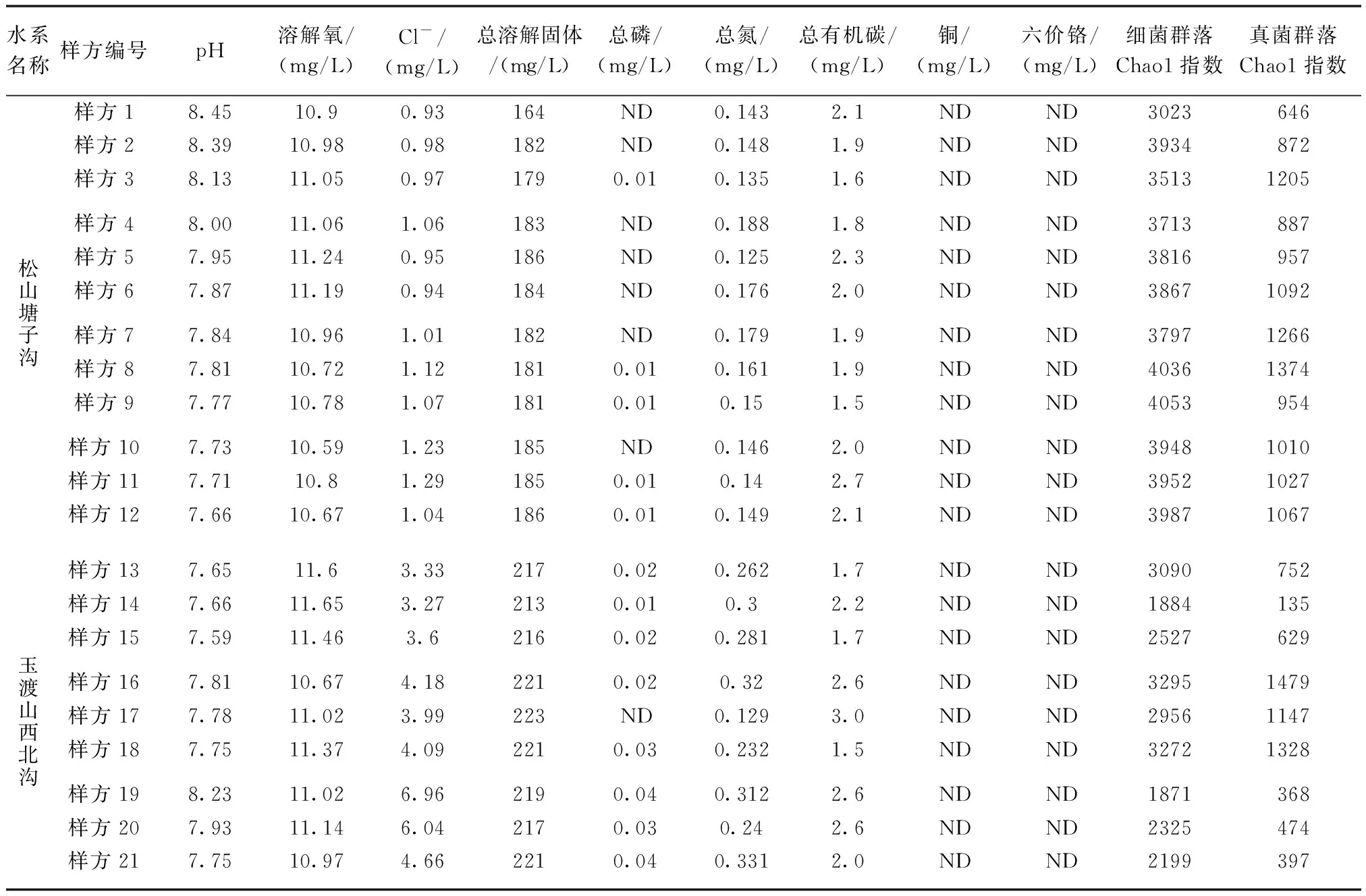
表2 研究样点水质特征与水体微生物群落多样性Tab.2 The water quality features and the microbial communities diversity at the studied sites
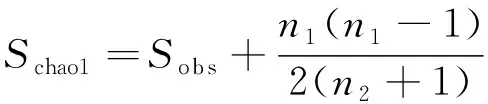
(1)
式中:Schao1为估计的OTU数,Sobs为实际观测到的OTU数,n1为只有一条序列的OTU数目,n2为只有两条序列的OTU数目。
3 结果与讨论
3.3 北京水毛茛分布特征
经实地调查发现,松山保护区内北京水毛茛目前仅分布在塘子沟。2017年以来,松山森林旅游区关闭、保护区内人类活动削弱,助推了北京水毛茛就地保护工作,目前塘子沟内北京水毛茛长势向好。玉渡山保护区内仅在西北沟发现北京水毛茛生长。
塘子沟样点2,4与西北沟样点6,7均分布有北京水毛茛(表1),塘子沟北京水毛茛平均盖度为70%±6.6%(平均值±标准误,下同),西北沟北京水毛茛平均盖度为97%±2.2%,前者显著小于后者(T检验,P<0.01),由此可见西北沟北京水毛茛群落分布更茂密、长势更好。
3.3 水系与水文特征
本研究中水系特征以溪流宽度表示,水文特征包括水温、水深、流速3个指标(表3)。塘子沟海拔显著低于西北沟(P<0.001,表3),塘子沟水温相对较高、平均为(12±0.2) ℃,西北沟水温平均为(9.6±0.4) ℃。两条溪流水深与水体流速无显著差异(P>0.05,表3)。在水系特征方面,塘子沟溪流宽度(3±0.3)m显著小于西北沟((4.7±0.6)m,P<0.05,表3)。

表3 研究样点水系与水文特征Tab.3 The water system and hydrological characteristics at the studied sites
从水系与水文特征的角度分析影响北京水毛茛分布的因素,Pearson相关分析结果表明,仅溪流宽度与北京水毛茛盖度有显著相关性(r=0.57,P<0.01)。通过回归拟合发现,溪流宽度与北京水毛茛盖度之间的二次曲线拟合(R2=0.42,P<0.01)优于线性拟合(R2=0.33,P<0.01,图1)。这一结果表明,北京水毛茛盖度与溪流宽度不是简单的线性关系;只有当溪流宽度大于一定数值时(根据图1二次曲线的拐点横坐标,这一宽度数值为2.4 m),溪流宽度与北京水毛茛盖度才呈现出正相关关系,此时溪流越宽、北京水毛茛的物理生存空间越大,北京水毛茛才得以大量生长繁殖。
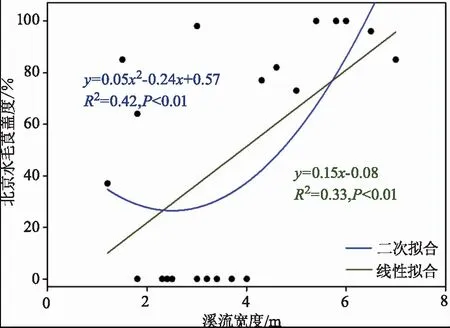
图1 北京水毛茛群落盖度与溪流宽度的关系Fig.1 Relationship between community coverage and stream width of Ranunculus japonicus in Beijing
水体流速是影响许多沉水植物分布的重要环境因素,尤其在流水中,流速慢有助于营养物质持留,从而形成稳定的植物群落结构。本研究中,水体流速小于0.23 m/s,流速较慢。因此,流速对北京水毛茛生长分布的影响不明显。研究表明,水温对沉水植物的生长有重要影响,如在人工繁育实验中,毛茛属沉水植物水生毛茛(Ranunculusaquatilis)在15℃水温比在低温水体中生长速度快[13],这一研究说明15℃左右的水温比较适合沉水植物生存。北京水毛茛环境适应性窄,一般生活在水温14 ℃左右的水体中[7],与水生毛茛适宜水温较为接近。本研究区域水温介于10~13.4 ℃之间,水温适宜、空间差异小,因此本研究中北京水毛茛生长分布不受水温限制。
水深常影响沉水植物生长,如Zhou等[14]的研究表明在水面以下0.6~1.2 m范围内,眼子菜属植物菹草(Potamogetoncrispus)的生物量最高。然而,该研究未考虑水面宽度、水体pH、总溶解固体含量等其他重要水文水质指标对菹草生长的影响。菹草常生活在弱酸及中性水体中,是富营养化浅水湖泊的常见种[15],与北京水毛茛生境截然不同。本研究区域水体清澈、水质条件好,水深为(0.26±0.01)m,整体水深很浅、变化不大,因此植被分布没有显示出层次性的变化,水深对北京水毛茛盖度无显著影响。
3.3 水质特征
本研究调查了水体pH、溶解氧、Cl-浓度、总溶解固体、总磷、总氮、总有机碳、铜、六价铬等9个重要水质指标。研究区域内水体pH在7.6~8.5之间,溶解氧含量在10.6~11.7 mg/L之间(表2)。塘子沟和西北沟的水体pH、溶解氧含量均无显著差异(P>0.05),且均符合Ⅰ类地表水标准(表4)。Pearson相关分析表明,自上游至下游,随着海拔下降,塘子沟水体pH由8.3显著下降到7.7(r=0.92,P<0.001,表2),而西北沟水体pH由7.6显著升高到7.9(r=0.76,P<0.05,表2),这两条水系水体pH随海拔变化的差异可能是溪流源头母岩母质不同造成的。塘子沟水体溶解氧含量随海拔升高(Pearson相关系数r=0.59,P<0.05),这是因为水温下降会导致溶解氧含量升高[16];西北沟由于海拔跨度小、水温变化小,因而溶解氧含量随海拔变化不显著(P>0.05)。塘子沟Cl-浓度、总溶解固体均显著低于西北沟(T检验:P<0.05,P<0.001;表4),说明西北沟水中盐粒子与固体杂质较多。塘子沟水中总磷(0.007±0.001)mg/L与总氮(0.153±0.005)mg/L含量符合Ⅰ类地表水标准(≤ 0.02 mg/L,GB 3838-2002),且显著低于西北沟总磷(0.024±0.004)mg/L与总氮含量((0.267±0.02)mg/L,表4)。2014年,塘子沟水体总磷与总氮平均含量分别为0.03 mg/L,1.1 mg/L[9],远大于目前水平,说明松山保护区近年来水质大幅改善。塘子沟与西北沟水体总有机碳含量差别不显著(P>0.05),铜含量均低于检测上限0.05 mg/L,六价铬含量均低于检测上限0.004 mg/L,铜、六价铬含量均符合Ⅰ类地表水标准(表4)。总体来说,松山塘子沟水质符合Ⅰ类地表水标准,西北沟水中盐离子与固体杂质较多、氮磷含量偏高。
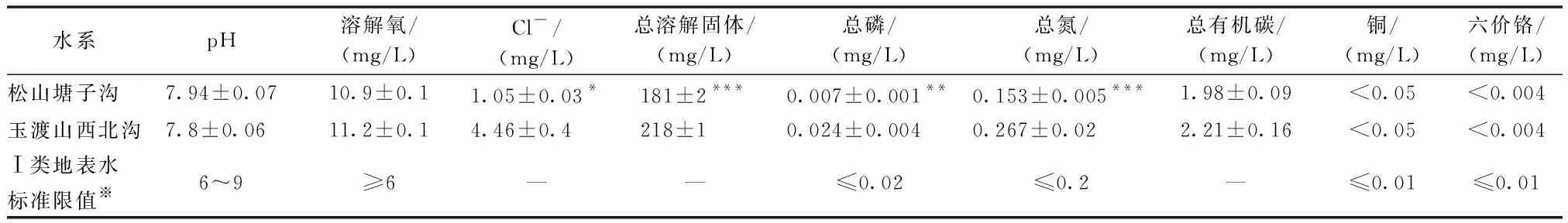
表4 研究样点水质特征Tab.4 The water quality features at the studied sites
Pearson相关分析表明,上述所调查的水质指标中,北京水毛茛盖度与总溶解固体、总磷、总有机碳含量均有显著正相关关系(表5),其中与水体总有机碳相关性最强(r=0.62,P<0.01)。据实地调查,本研究中北京水毛茛分布的区域底泥相对较厚,其中蕴藏了大量的有机碳,有机碳是植被有机质主要来源[17],因此,水体有机质与底泥含量较多的河段北京水毛茛生长更为茂密,这与水体流速慢的水域有助于营养物质持留从而形成稳定的植物群落结构的结论[4]较为一致。总溶解固体是溶解在水里的无机盐和有机物的总称,随着水生植被生物量的增大,水生植被根系分泌物增多,总溶解固体含量增多,因而北京水毛茛盖度与总溶解固体含量成正比。

表5 水质北京水毛茛盖度的相关性Tab.5 The Pearson correlation between water quality and coverage of Batrachium Pekinense L.Liou
磷是植物生长发育必须的大量元素,缺磷对植物光合作用、呼吸作用及生物合成等过程均有影响。水体富营养化会导致水生生态系统结构转变,当总磷含量高于0.11 mg/L、总氮含量高于1.2 mg/L时,水体出现富营养化;当水体总氮含量高于2.4~3.9 mg/L,或总磷含量高于0.05 mg/L时,水生植物盖度和多样性下降,浮游植物逐渐占主导[18]。本研究涉及的水体总磷含量在0.005~0.04 mg/L之间(表2),远未达到富营养化水平,在现有的总磷含量范围内,总磷含量的适度增加有利于提高于北京水毛茛净初级生产力。因此,水体总磷与总氮含量不是本区域内北京水毛茛生长分布的限制性环境因素。水体重金属影响沉水植物群落结构,本研究区域内铜、六价铬含量极低,均符合Ⅰ类地表水标准(表4),因此,重金属含量对北京水毛茛生长分布无显著影响。
3.3 微生物群落多样性
微生物能附着在水生植物表面形成生物膜,通过硝化与反硝化作用、金属还原等影响水生植物养分来源与水质状况,因此,探讨北京水毛茛生长分布与水体微生物的关系对于北京水毛茛就地保护意义重大。高通量测序分析表明,塘子沟细菌与真菌群落Chao1指数分别为3803±80,1030±56,西北沟细菌与真菌群落Chao1指数分别为2 602±189,745±148(表2),T检验表明塘子沟比西北沟细菌群落多样性高(P<0.001),而真菌群落多样性差异不显著(P>0.05)。Pearson相关分析表明,随海拔上升,研究区域内细菌群落多样性显著下降(r=-0.74,P<0.001,表6),而真菌群落多样性随海拔无显著变化(P>0.05,表6),这是由于塘子沟采样点海拔跨度大且海拔低、水温高,多样的生境和适宜的温度导致塘子沟水体细菌多样性较西北沟高,而真菌对环境变化的敏感性低,因此真菌群落多样性未表现出随海拔和地点的变化。
基于高通量测序结果,北京水毛茛群落盖度与水体细菌、真菌群落多样性无显著相关性(P>0.05,表6),这可能是因为研究区域内水质条件较好,塘子沟水质达到国家Ⅰ类地表水标准,玉渡山区级保护区水质也接近国家Ⅰ类地表水标准,清澈水体中微生物与植物生长繁殖态势稳定,未表现出同步变化的趋势。
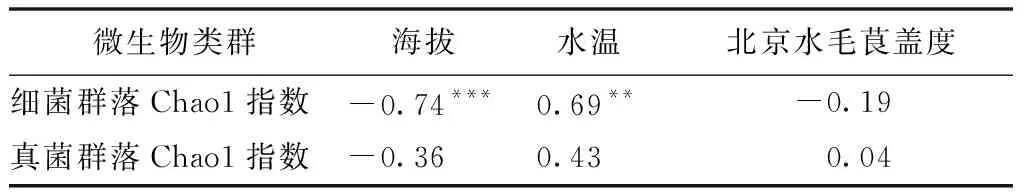
表6 水体微生物群落多样性、环境因子、北京水毛茛盖度三者之间的相关性Tab.6 The Pearson correlations among aquatic microbial community diversity,environmental factors and the coverage of Batrachium pekinense L.Liou
4 结论
珍稀植物的保护方法包括就地保护与迁地保护,其中就地保护是保护珍稀植物原生生境的有效方法[19],例如,建立自然保护区、风景名胜区等。无论何种保护措施,都需要深入了解植物生长限制因子,尽量营造一个适宜的生境以保证物种的正常繁殖。本研究针对松山自然保护区及其毗邻的玉渡山自然保护区,综合水系与水文特征、水质特征与水体微生物等多方面因素,从物理、化学、生物等多角度阐释影响自然保护区内北京水毛茛分布的环境因素,是对已有研究的极大扩展和补充。研究结果表明,水体总有机碳含量和溪流宽度是影响北京水毛茛分布的主要因素,其次为水体总溶解固体含量和总磷含量。因此,在北京水毛茛种群就地保护工作中应注意促进底泥堆积、加强水质管理、适当增大溪流宽度,提高生境质量和生态容量,促进北京水毛茛生长繁殖,保护这一珍稀种质资源。
本研究首次发现溪流宽度对于沉水类植物的影响,当流量一定时,溪流宽度越大,水深越浅、流速越慢,则更有利于底泥和有机物的积累,有利于扩大北京水毛茛的适生生境。同时,溪流底部的岩石构造、光滑程度等也会影响到底泥和有机物积累。而在流速急、水量大、深水流域,底泥和有机质难以在河底沉积,水生植物根系无处固着,此时溪流宽度可能无法影响北京水毛茛的分布,或者此类水域不适合北京水毛茛生长。溪流宽度、河床结构、水量水速等多种物理因素等都会影响底泥和有机质的堆积,从而影响到北京水毛茛的生长分布。由此可见,在适宜的水文水质条件下,底泥和有机质含量的多少是影响北京水毛茛生长分布的主要因素。研究认为,在北京水毛茛就地保护工作中,不仅要注意水质、物种竞争等化学、生物要素的影响,同时也要关注物理环境变化所带来的影响。
本研究区域内有4处水域(样点2,4,6,7,表1)适合北京水毛茛生长,具体生境特征为:溪流宽度介于1.2~7.0 m之间,水深介于0.15~0.37 m,水体流速小于0.23 m/s,水温10~13.4 ℃(表1);水体呈弱碱性,水体溶解氧含量介于10.6~11.4 mg/L,水体总固体含量小于223 mg/L,水体总磷含量小于0.04 mg/L、总氮含量小于0.33 mg/L,水体总有机碳含量1.5~3.0 mg/L,水体重金属铜含量小于0.05 mg/L、六价铬含量小于0.004 mg/L(表2)。上述生境指标数据为后续北京水毛茛环境特征分布模型的建立以及临近区县潜在分布区的预测提供了数据支撑,有利于下一步在相关区域开展针对性保护工作。
本研究揭示了水体底泥有机质和溪流水系特征对北京水毛茛生长分布的影响,明确了研究区域内北京水毛茛生境特征阈值。北京水毛茛是水质好坏的生物指示器,自然保护区应借助科学调查结果制定相关保护措施,深化研究结果的实践指导意义。后续研究将扩大调查范围,针对自然保护区、湿地、平原等不同区域开展北京水毛茛的调查研究,深化这一珍稀野生植物的研究与保护工作。
