青稞旗叶距与小孢子发育时期的相关性研究
2020-10-09朱天地陈琛王炜陈子萱李静雯
朱天地 陈琛 王炜 陈子萱 李静雯

摘要:选用3个青稞品种(系)0841-6、T09-401、昆仑3号为试验材料,采用改良苯酚品红溶液对小孢子染色,在光学显微镜下观察小孢子发育情况,分析青稞小孢子发育时期与旗叶距(旗叶与倒二叶的叶耳间距离)之间的相关性。结果表明,旗叶距为 0~3 cm 时,小孢子发育处于二分体时期;3~8 cm 时,大部分小孢子细胞处于四分体阶段;8~13 cm 时,单核中期为主;13~18 cm时,花药中存在各种发育时期的小孢子,但以单核靠边期为主;当旗叶距>18 cm 时,小孢子开始大量成熟,直至发育为成熟花粉。供试青稞小孢子品种(系)的发育时期均与旗叶距有一定的相关性,旗叶距可作为青稞花药和小孢子培养幼穗取材的重要形态学指标。
关键词:青稞;旗叶距;小孢子;发育时期;花药培养;染色
中图分类号:S512.3 文献标志码:A 文章编号:1001-1463(2020)09-0036-06
doi:10.3969/j.issn.1001-1463.2020.09.010
Abstract:Three highland barley cultivars including 0841-6, T09-401 and Kunlun 3 were used as experiment materials,staining highland barley microspores with modified phenol magenta solution, the development of microspore was observed under optical microscope, and the relationship between the microspore developmental stage of highland barley and the flag leaf spacing was analyzed. The results showed that when the flag leaf spacing was 0~3 cm, the microspore development was basically in dyad; At 3~8 cm, the microspore development was basically in tetrad; At 8~13 cm,the microspores developed into mid-uninucleate; At 13~18 cm,various kinds of developmental stages of microspores could be observed,but most of them were late-uninucleate microspores; When the flag leaf spacing exceeded 18 cm, a big scale of microspores entered mature period and developed into mature pollens. The development stages of the three kinds of highland barley microspores all have a certain correlation with the flag leaf spacing, the flag leaf spacing can be used as a morphological indicator on sampling of young spikes in the highland barley anther and isolated microspore culture.
Key words:Highland barley;Flag leaf spacing;Microspore;Developmental stage;Anther culture; Staining
青稞(Hordeum vulgare L. var nudum Hook.f.)是我國的原产物种之一,为禾本科大麦属的一种谷类作物[1 - 3 ]。因其内外颖与颖果分离,籽粒裸露在外面,故而得名裸大麦、米大麦或元麦[4 ],主要种植在青海、甘肃、西藏等高海拔地区,已有4 000多年种植历史[5 ]。青稞根据其棱数的不同,分为二棱青稞、四棱青稞和六棱青稞;按其颜色,又可被分为紫青稞、花青稞、白青稞、黑青稞等[6 ]。青稞不同于其他谷类,具有“三高两低” 的特点,即高纤维、高蛋白质、高维生素、低脂和低糖等,有预防糖尿病、降低胆固醇等作用,是现代健康文明生活的理想保健食品[7 ]。随着青稞营养价值不断地被挖掘,人们对其关注日渐增多,青稞已广泛涉及酿酒工业、功能食品、粮食工业、饮料工业等领域[8 ]。
青稞新品种的选育工作已经开展约70 a,且培育了大量的优良品种,但传统育种方法耗时耗力。由于长期对产量、抗性和品质的要求,很可能造成青稞遗传多样性的下降,对青稞新品种的选育不利[9 - 10 ]。单倍体育种在植物育种研究中具有重要应用价值,花药和小孢子培养是获得单倍体的有效途径,能够诱导产生胚状体,快速获得纯合育种材料,大大缩短育种年限,提高选择效率,加快育种进程。小孢子发育阶段与花药离体培养效果的相关性,是花药离体培养取材的关键,发育到一定阶段的花粉对离体刺激最敏感,并最终发育成完整植株[11 ]。例如,红花槐的花粉发育阶段与花冠与花萼的长度比、花蕾纵径等有直接关系[12 ];在大麦花30中,小孢子发育时期与旗叶距存在相关性[13 ];水稻中,旗叶距为7~11 cm时为小孢子离体培养的最佳时期[14 ];在籼稻中,小孢子处于单核靠边期时叶枕距为4~6 cm,为最佳诱导培养时期[15 ]。为了解小孢子发育时期与旗叶距的相关性,幼穗的取材需要建立更为精细的形态学指标,以获得更多处于适宜时期的花药和小孢子进行培养。我们以3个青稞品种(系)0841-6、T09-401和昆仑3号为试验材料,对其不同旗叶距的花药染色压片,用显微镜观察计数并拍照统计,探讨旗叶距、花药大小及颜色与小孢子发育时期的相关性,为青稞花药和小孢子培养的相关研究提供方法参考。
1 材料与方法
1.1 试验材料
供试青稞品种(系)为0841-6、T09-401、昆仑3号,均由甘肃省农业科学院生物技术研究所提供。这3个青稞材料均种植于甘肃省农业科学院生物技术研究所温室内,管理同常规大田。
1.2 试验方法
1.2.1 取样与测量 2019年10 月中旬将供试青稞种子播种于温室,2020年2月中下旬青稞现幼穗后取样,每天9:00 — 10:00时采集健康且长势较好植株上的不同旗叶距的幼穗,做好标记并放入自封口塑料袋中带回实验室。用游标卡尺测量旗叶距,并分为五个区间:0~3 cm、 3~8 cm、8~13 cm、13~18 cm、 18~23 cm。每个区间取10个幼穗测定,重复3次。将幼穗从叶鞘中抽出,用镊子轻轻剥去颖壳,取出花药并用游标卡尺测量长度,记录数据并拍照。
1.2.2 压片 用镊子取不同旗叶距幼穗中部的3枚花药,置于载玻片上,滴1滴染色液使其完全浸没,用玻璃棒挤压花药使小孢子游离出来,去掉花药残渣,染色 1~2 min 后盖上盖玻片,吸去多余染液,用奥林巴斯 BX-51显微镜观察小孢子发育状况并拍照记录。分别用改良苯酚品红和醋酸洋红染液染色,以选择效果最好的染色液。
2 结果与分析
2.1 染色液选择及染色时间
制片能否成功主要受染色液和染色时间的影响,同时也影响小孢子的镜检结果。由图1看出,改良苯酚品红染色液更适合青稞游离小孢子的染色观察,而经醋酸洋红染色的青稞游离小孢子背景比较混杂,不易观察小孢子的各发育时期。染色时间不宜过短也不宜过长,过短则达不到染色效果,过长会将细胞染色太深不利于观察,最佳染色时间为1.5~2.0 min。
2.2 青稞小孢子各发育时期的特征
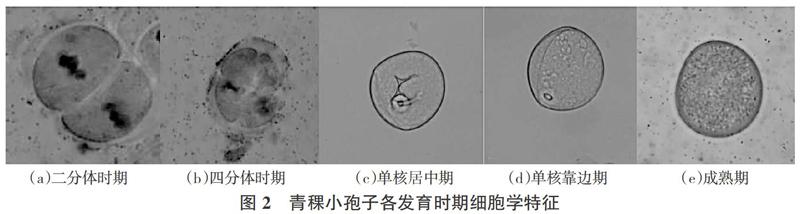
通过对青稞小孢子各发育时期的觀察,表明小孢子的发育是连续的,1个花药通常包含着不同发育时期的小孢子。如图2所示,小孢子母细胞经过第一次减数分裂形成的二分体(图2 a),再进一步进行第二次减数分裂形成呈“田”字形的小孢子四分体。由图2 b可见,光学显微镜下可以看到一层厚的胼胝质将小孢子包裹着,不同发育时期小孢子呈不同形状,规则的为圆形;之后胼胝质酶将胼胝质壁催化水解,小孢子从胼胝质中分离出来被释放至花粉囊中,此时小孢子具有不规则的外形轮廓,呈圆球形或纺锤形,细胞核较大,居中,也有稍偏离中央的,即单核居中期(图2 c)。随着小孢子从四周汲取养料,细胞体积逐渐增大,液泡也随之增大,将细胞核推向细胞壁边缘,即单核靠边期(图2 d);随后小孢子核进行2次有丝分裂,最终发育成为成熟花粉粒,光学显微镜下可见花粉粒颜色变深但看不到细胞器,细胞膨大呈球形(图2 e)。
2.3 青稞小孢子各发育时期与旗叶距的关系
通过观察,将小孢子的发育时期分为二分体时期、四分体时期、单核早中期、单核靠边期、双核期和三核期等 6个时期。由于试验条件受限,双核期和三核期难以区分,内部特征观察不明显,将这 2 个时期合并为发育后期。花药长度和花药颜色也随小孢子发育各个时期而有所变化。
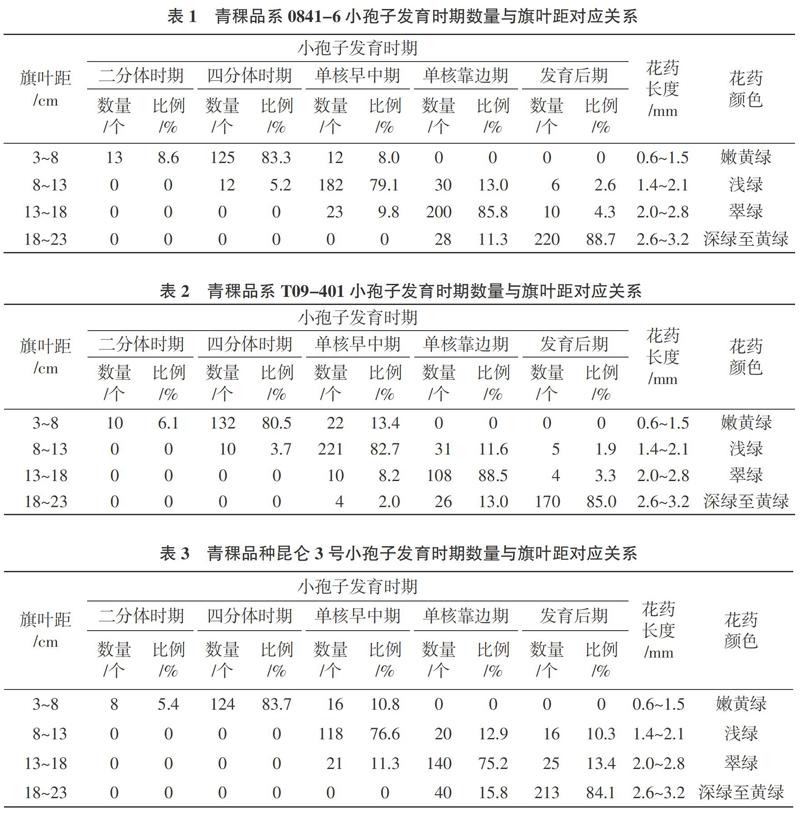
在光学显微镜下对青稞品系0841-6不同时期小孢子进行观察的结果(表1)可以看出,当旗叶距在 3~8 cm 时,主要以小孢子四分体时期为主,也有少量散落分布的二分体和单核早中期的小孢子,此时细胞质颜色浅,细胞核易见。旗叶距增加到8~13 cm时,四分体小孢子逐渐减少,单核早中期小孢子数量居多,同时可观察到单核靠边期和成熟期小孢子。当旗叶距在13~18 cm 时,单核靠边期小孢子数量急剧增加达到峰值,四分体小孢子几乎消失,单核早中期小孢子数量减少,同时出现成熟期小孢子。旗叶距>18 cm 时,单核早中期和靠边期的小孢子减少甚至消失,视野内以成熟期小孢子为主。
从表 2 和表3分别可以看出, T09-401和昆仑3号的小孢子发育时期与旗叶距的关系趋势与0841-6基本一致。当旗叶距在 3~8 cm 时,主要以小孢子四分体时期为主,旗叶距增加到8~13 cm时单核早中期小孢子数量居多,当旗叶距为13~18 cm时单核靠边期小孢子数量急剧增加并达到峰值,旗叶距>18 cm时视野内以成熟期小孢子为主。细微的差别是T09-401旗叶距在18~23 cm时可观察到单核早中期的小孢子,昆仑3号在旗叶距8~13 cm时未观察到四分体时期的小孢子。
从图 3 可以看出,0841-6、T09-401和昆仑3号各个时期的小孢子数量峰值都分别对应不同的旗叶距区间。
3 结论与讨论
单倍体育种在植物育种研究中具有重要应用价值,花药或花粉的离体培养是获得单倍体的有效途径,选择适宜的小孢子发育时期是花药或花粉离体培养取得成功的重要因素之一,小孢子发育时期的细微差别对花药培养的产率将产生重大的影响[16 - 17 ]。不同物种最佳取材时期有差异,例如,在黄瓜小孢子培养中,以单核中后期的花粉培养效果最佳[18 ];Duijs[19 ]和Takahata等[20 ]的研究表明,甘蓝花药培养中小孢子最佳培养时期为单核中后期至双核期,且双核期小孢子占比对甘蓝游离小孢子培养影响重大;张德双等[21 ]的研究认为,绿菜花游离小孢子培养的最佳时期也是单核靠边期至双核期;王亦菲等[22 ]选取小孢子发育时期处于单核期的青稞花药进行离体培养,成功获得了小孢子再生植株。
在大量的花药和小孢子离体培养过程中,采用显微镜逐个观察很困难并且易污染,所以确定与小孢子发育时期相对应的旗叶距大小形态指标至关重要。由于其直观性,利用旗叶距的大小来判断小孢子发育时期在小孢子的离体培养中得到广泛应用。Mayakaduwa等[14 ]认为水稻旗叶距为7~11 cm时为小孢子离体培养的最佳时期;在籼稻中,小孢子处于单核靠边期时叶枕距为4~6 cm,为最佳诱导培养时期[15 ];在大麦中,旗叶距在1.7~5.1 cm时,分离的小孢子数量最多[23 ];燕麦中旗叶距小于4 cm的圆锥花序能够形成胚状体[24 ]。试验取样过程中,旗叶距是一个比较直观的形态学指标,旗叶距的大小与小孢子发育时期有一定的相关性。以旗叶距为基本标准,同时结合显微镜观察,来判断最佳小孢子培养时期,可以降低实验误差。
本研究表明,当旗叶距在 0~3 cm 时,青稞主要以小孢子二分体时期为主,但由于试验条件受限,未对二分体时期小孢子进行计数。当旗叶距为3~8 cm时,主要以小孢子四分体时期为主,也有少量散落分布的二分体和单核早中期小孢子,此时细胞质颜色浅,细胞核易见。旗叶距增加到8~13 cm时,四分体小孢子逐渐减少,单核早中期小孢子数量居多,同时观察到单核靠边期和成熟期小孢子。当旗叶距在13~18 cm 时,单核靠边期小孢子数量急剧增加达到峰值,四分体小孢子几乎消失,单核早中期小孢子数量减少,同时出现成熟期小孢子。旗叶距>18 cm 时,单核早中期和靠边期小孢子减少至消失,视野内以成熟期小孢子为主。花药长度和颜色也随小孢子发育而产生变化,3 个供试青稞材料的总体趋势一致。该结果有助于提高青稞花药和小孢子离体培养时小孢子取材的准确性和效率。
参考文献:
[1] 胡再青,刘梅金,徐冬丽,等. 甘南高寒阴湿区甘青6号青稞种植密度与肥料配比试验初报[J]. 甘肃农业科技,2018(11):10-12.
[2] 刘广才,马 彦,张忠贤,等. 甘肃青稞宽幅匀播绿色高产栽培技术规程[J]. 甘肃农业科技,2018(7):87-90.
[3] 刘小娇,王姗姗,白 婷,等. 青稞营养及其制品研究进展[J]. 粮食与食品工业,2019,26(1):43-47.
[4] 包雪梅,谢惠春. 青稞主要成分及其应用的研究进展[J]. 现代食品,2019(2):43-47.
[5] 郑学玲,张玉玉,张 杰. 青稞淀粉理化特性的研究[J]. 中国粮油学报,2011,26(4):30-36.
[6] 张 峰,杨 勇,赵国华,等. 青稞β-葡聚糖研究进展[J]. 粮食与油脂,2003(12):3-5.
[7] 那成龙,陈建澍,张玉红,等. 大麦β-葡聚糖的提取及功能研究进展[J]. 麦类作物学报,2012,32(3):579-584.
[8] 李 健,丰先红,蔡一林. 青藏高原青稞育成品种的亲缘系数分析[J]. 中国农业科学,2019,52(16):2758-2767.
[9] MARTIN J M,BLAKE T K,HOCKETT E A. Diversity among north American spring barley cultivars based on coefficients of parentage[J]. Crop Science,1991,31(5):1131-1137.
[10] REN X F,NEVO E,SUN D F,SUN G L. Tibet as a potential domestication center of cultivated barley of China[J]. PLos One, 2013,8(5):e62700.
[11] 谢从华,柳 俊. 植物细胞工程[M]. 北京:高等教育出版社,2004.
[12] 李允菲,王仁涛,袁存权,等. 红花槐花药培养最适取材时期及选蕾标准[J]. 西北农林科技大学学报(自然科学版),2013,41(8):65-71.
[13] 高润红,郭桂梅,何 婷,等. 大麦‘花30旗叶距对小孢子发育时期、愈伤组织诱导以及绿苗再生的影响[J/OL]. 南京农业大学学报:1-8[2020-04-22]. http://kns.cnki.net/kcms/detail/32.1148.s.20200331.1514.002.html.
[14] MAYAKADUWA D M R G,Silva T D. A cytological indicator allows rapid assessment of microspore maturity,leading to improved in vitro anther response in Indica rice(Oryza sativa L.)[J]. In Vitro Cellular & Developmental Biology-Plant,2017,53(6):591-597.
[15] 胡 锐. 籼稻花药培养影响因素的研究[D]. 武汉:湖北大学,2015:24.
[16] WILLCOX M C,REED S M,BURNS J A, et al. Effect of microsporestage and media on anther culture of peanut(Arachishy pogaea L.) [J]. Plant Cell Tissue Organ Culture,1991,24:25-28.
[17] MC CORMICK S. Male gametophyte development[J]. Plant Cell,1993(5):1265-1275.
[18] 謝 淼,秦丽颖,潘俊松,等. 黄瓜花器形态发生、小孢子发育与花药培养[J]. 西北植物学报,2005,25(6):1096-1100.
[19] DUIJS J C. Microspore culture is successful in most crop types of Brassica oleracea L.[J]. Euplytica,1992,60:45-55.
[20] TAKAHATA Y,KELLER W A. High frequency embryogenesis and plant regeneration in isolated microspore culture of Brassica oleracea L.[J]. Plant Sci,1991,74:235-242.
[21] 张德双,曹鸣庆,秦智伟. 绿菜花双核期小孢子比例对游离小孢子培养的影响[J]. 园艺学报,1998,25(2):201-202.
[22] 王亦菲,陆瑞菊,陈志伟,等. 青稞花药的离体培养与植株再生[J]. 植物生理学通讯,2010,46(7):745-746.
[23] ESTEVES P,BELZILE F. Improving the efficiency of isolated microspore culture in six-row spring barley:I-optimization of key physical factors[J]. Plant Cell Reports,2014, 33(6):993-1001.
[24]WARCHO M,CZYCZYO-MYSZA I, MARCISKA I,et al. Factors inducing regeneration response in oat(Avena sativa L.) anther culture[J]. In Vitro Cellular & Developmental Biology-Plant,2019,55(5):595-604.
(本文责编:郑立龙)
