雄蚕益肾方对迟发性性腺功能减退症大鼠睾丸组织形态学改变及抗氧化作用研究
2020-10-09唐雪李波男周海亮何清湖周青熊伟高瑞松林群芳周兴
唐雪 李波男 周海亮 何清湖 周青 熊伟 高瑞松 林群芳 周兴


〔摘要〕 目的 探討雄蚕益肾方对迟发性性腺功能减退症(lateonset hypogonadism, LOH)大鼠睾丸组织形态学改变及抗氧化作用。方法 将18月龄SD雄性大鼠随机分为模型组,丙酸睾酮组,雄蚕益肾方低、中、高剂量组,2月龄SD雄性大鼠设为正常组。雄蚕益肾方低、中、高剂量组分别给予10.4、20.8、41.6 g/kg的雄蚕益肾方配方颗粒剂灌胃;丙酸睾酮组肌注5.21 mg/kg丙酸睾酮,隔日1次;正常组和模型组给予相同体积的蒸馏水灌胃,均连续28 d。实验结束后,记录大鼠悬尾实验不动时间,称体质量、采血,ELSIA法检测睾酮(T),睾丸组织进行黄嘌呤氧化酶法(SOD)、紫外吸收法(CAT)、硫代巴比妥酸法(MDA)、病理及电镜检测。结果 与正常组比较,模型组T水平降低(P<0.05),悬尾不动时间延长(P<0.05),睾丸组织抗氧化酶SOD、CAT降低(P<0.05)、MDA升高(P<0.05),HE染色睾丸间质减少,电镜示Leydig细胞线粒体数量减少、水肿明显,均符合LOH改变。与模型组比较,雄蚕益肾方各剂量组和丙酸睾酮组均能提高T水平(P<0.05)、缩短悬尾不动时间(P<0.05),雄蚕益肾方中、高剂量组和丙酸睾酮组均能升高SOD、CAT(P<0.05),降低MDA(P<0.05)。雄蚕益肾方各剂量组大鼠睾丸组织生精小管内精子数量增多,睾丸间质增加;电镜示Leydig细胞线粒体数量明显增多,部分可见线粒体鞘,部分线粒体嵴清晰,线粒体水肿不明显。结论 雄蚕益肾方能提升LOH大鼠T水平、缩短悬尾不动时间、一定程度改变睾丸组织形态和超微结构,可能与提高睾丸组织抗氧化能力有关。
〔关键词〕 男性迟发性性腺功能减退症;雄蚕益肾方;睾酮;组织形态;抗氧化
〔中图分类号〕R256.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.08.009
〔Abstract〕 Objective To study the effects of Xiongcan Yishen Recipe on testicular histomorphology and antioxidation in rats with late onset hypogonadism (LOH). Methods The 18-month-old SD male rats were randomly divided into a model group, a testosterone propionate group, a Xiongcan Yishen Recipe low, middle and high dose group. The 2-month-old SD male rats were set as normal group. Xiongcan Yishen Recipe low, middle and high dose group were given 10.4 g/kg, 20.8 g/kg and 41.6 g/kg Xiongcan Yishen Recipe granules by gavage respectively; Testosterone propionate group was intramuscularly given 5.21 mg/kg testosterone propionate, once every other day. The normal group and the model group were given the same volume of distilled water by gavage for 28 days. At the end of the experiment, the immobility time of tail suspension experiment was recorded. They were weighed, and blood was collected. Testosterone (T) was detected by ELSIA, and xanthine oxidase method was used to detect superoxide dismutase (SOD) in testicular tissue. Ultraviolet absorption method was used to detect catalase (CAT), and thiobarbituric acid method was used to detect malondialdehyde (MDA), pathology and electron microscopy. Results Compared with the normal group, T level in the model group decreased (P<0.05). Tail suspension time prolonged (P<0.05). antioxidant enzyme SOD, CAT decreased (P<0.05) and MDA increased (P<0.05) in testicular tissue. HE staining testicular stroma decreased. Electron microscopy showed that Leydig cell mitochondria decreased, and edema was obvious, which was in line with LOH change. Compared with the model group, each dose group of Xiongcan Yishen Recipe and testosterone propionate group could increase T level (P<0.05) and shorten tail suspension time (P<0.05), while SOD and CAT (P<0.05) increased, and MDA (P<0.05) was significantly decreased in the middle and high dose groups and testosterone propionate group. The number of sperm in the seminiferous tubules of the testis tissue of rats in each dose of Xiongcan Yishen Recipe increased, and the interstitium of the testis increased. Electron microscopy showed that the number of mitochondria in Leydig cells increased significantly, and some mitochondrial sheaths were visible. Some mitochondrial cristae were clear, and mitochondrial edema was not obvious. Conclusion Xiongcan Yishen Recipe can improve T level, reduce the time of tail suspension, and change the morphology and ultrastructure of testis to some extent, which may be related to improving the antioxidant capacity of testis.
〔Keywords〕 late onset hypogonadism in male; Xiongcan Yishen Recipe; testosterone; histomorphometric; antioxidation
随着人口老龄化,许多与年龄相关的疾病发病率越来越高,如心脑血管疾病、高血压病、肿瘤、前列腺增生、糖尿病等。迟发性性腺功能减退症(lateonset hypogonadism, LOH)也属于常见的年龄相关疾病之一,是指部分中老年男性患者由于雄激素缺乏所出现的一系列临床综合征。流行病学调查显示国内LOH患病率为10%~20%[1-2]。临床指南[3]认为,LOH诊断必须基于患者有雄激素缺乏相关的症状和体征(包括精神心理症状、心血管舒缩症状、体能下降症状、性功能障碍症状),同时还存在血清睾酮(testosterone, T)水平低下,两者缺一不可。因此,睾酮补充治疗(testosterone supplementation therapy, TST)[4]被视为LOH治疗的金标准,但也存在诸多争议[5],包括TST的剂量和疗程,尤其是TST的安全性问题,如是否增加患前列腺癌、心血管疾病风险,以及警惕睡眠呼吸暂停、红细胞增多症发生等,这些都要在TST期间定期监测。
中医学认为,LOH病发于《素问·上古天真论》中所阐述的“六八”至“八八”阶段,“天癸竭、肾脏衰”是致病之本,“肾虚肝郁”为病机关键。因此,临床治疗多从补肾助阳、滋肾柔肝、养心安神等方面入手[6-8],系统评价[9]报道,中医药治疗LOH临床总体疗效与TST相当,尤其在改善LOH患者性功能减退症状总分、血清总T水平以及勃起障碍、潮热盗汗等中医证候评分方面还优于TST(P<0.01)。
雄蚕益肾方是湖南中医药大学第一附属医院用于治疗LOH的经典成方,组方源于国家级名老中医谭新华教授,以“天癸竭”“乙癸同源”理论为指导,强调“肾肝同治”,组方精妙,临床观察证实雄蚕益肾方治疗LOH疗效确切[10-11],但具体机制仍需进一步探讨。研究[12-13]证实,增龄引起的睾丸超微形态学改变以及氧化应激损伤,与T水平低下、LOH发病密切相关。因此,本研究拟在上述研究基础上,从睾丸形态结构和氧化应激角度探讨雄蚕益肾方治疗LOH的可能机制。
1 材料
1.1 实验动物
SPF级SD大鼠(许可证号:SCXK<沪>2016-0005),15月龄,雄性,体质量700~800 g,25只,购自上海斯莱克实验动物有限责任公司;SPF级SD大鼠(许可证号:SCXK<湘>2016-0002),2月龄,雄性,体质量180~220 g,5只,购自湖南斯莱克景达实验动物有限公司。所有大鼠饲养在湿度55%~65%,温度20~24 ℃的环境中,自由采食和饮水。适应性喂养1周后进行试验。
1.2 實验药物和试剂
雄蚕益肾方配方颗粒(雄蚕蛾30 g,淫羊藿15 g,熟地黄15 g,枸杞子15 g,白芍10 g,炒蒺藜15 g),由江阴天江药业有限公司提供。丙酸睾酮注射液(宁波第二激素厂,1 mL:25 mg/支,兽药字<2016>110251054);T(货号RA20653)ELISA试剂盒,购自Bioswamp生物技术有限公司;超氧化物歧化酶(superoxide Dismutase, SOD)(货号A001-1-1)、过氧化氢酶(catalase, CAT)(货号A007-2-1)、丙二醛(malondialdehyde, MDA)(货号A003-1-1)生化试剂盒,均购自南京建成生物工程研究所。
1.3 实验仪器
352型酶标仪(芬兰Labsystems Multiskan MS);SmartSpecTMPlus紫外分光光度计(美国Bio-Rad);Tanon-5200全自动化学发光分析仪(上海天能);UC-7超薄切片机(Leica);HT7700透射电镜(日立);UPT优普特实验室超纯水器(法国Millipore)。
2 方法
2.1 动物分组与给药方法
参照Jeong HC[14]等造模方法,18月龄及以上SD雄性大鼠可直接视为LOH大鼠模型。本研究将购进的15月龄SD雄性大鼠正常喂养12周后达到18月龄,则视为LOH模型复制成功。按照随机数表法,将25只大鼠分成5组,即模型组(MG)、丙酸睾酮组(TG)、雄蚕益肾方-低剂量组(xiong can-lowdose group, XG-l)、雄蚕益肾方-中剂量组(xiong can-middledose
group, XG-m)、雄蚕益肾方-高剂量组(xiong can-highdose group, XG-h),每组5只。待LOH模型复制成功后,另取5只2月龄SD雄性大鼠设为正常组(NG)。
XG-l给予10.4 g/kg体质量剂量的雄蚕益肾方配方颗粒剂(按60 kg体质量成年人一天服用100 g,根据人和大鼠等效剂量换算,溶于蒸馏水制成2 g/mL浓度悬液)进行灌胃,XG-m、XG-h分别按2倍、4倍于成人的等效剂量给药,即20.8、41.6 g/kg体质量剂量。XG-l、XG-m每天灌胃1次,XG-h因药物浓度过高,每天分2次灌胃,连续28 d;TG大鼠肌注5.21 mg/kg体质量剂量的丙酸睾酮(按60 kg体质量成年人一次50 mg,根据人和大鼠等效剂量换算),每周3次(周1、3、5执行),连续28 d;NG、MG给予相同体积的蒸馏水灌胃。实验期间MG、XG-l、XG-m、XG-h各死亡大鼠1只,TG死亡大鼠2只。
末次给药12 h后,乌拉坦麻醉,处死所有动物,称质量、采血,左侧睾丸部分保存于4%多聚甲醛用于病理检查,部分保存于2.5%戊二醛用于电镜检查,右侧睾丸组织直接冻存于-80 ℃冰箱用于生化检测。血液离心管分装,3 000 r/min,10 min,分离出血清,-80 ℃冰箱保存待检。
睾丸指数=双侧睾丸质量(g)/体质量(g)×100%
2.2 大鼠悬尾实验[15]
于末次给药后进行。将大鼠尾端2 cm的部位用胶带固定在一水平金属杆上,大鼠倒挂后金属杆高度要使大鼠鼻子距离水平地面20~25 cm。悬挂两侧用隔板挡开视线,避免同时实验时受到其他大鼠干扰,但要保证大鼠在悬挂时不能碰触到隔板。大鼠为克服不正常的体位而挣扎活动,活动一定时间后,会出现间断性“不动”,显示“失望”状态,如此反复。计算6 min内的不动时间。此实验能一定程度反映大鼠的抑郁程度。
2.3 睾丸组织形态学观察
取相同部位睾丸组织经4%多聚甲醛固定24 h,常规脱水、浸蜡、石蜡包埋、切片(4 μm)、固定,HE染色后,Motic光学显微镜下观察。
2.4 睾丸间质细胞超微结构观察
取相同部位睾丸组织块约1 mm×1 mm×3 mm,2.5%戊二醛固定、丙酮梯度脱水、浸泡、包埋、固化,Leica UC-7超薄切片机切片50~100 nm,3%醋酸铀以及硝酸铅双染色,日立HT7700透射电镜观察、拍片。
2.5 大鼠血清T含量检测
按照Bioswamp生物技术有限公司提供的T ELISA试剂盒的详细过程要求,检测大鼠血清中T的含量。
2.6 大鼠睾丸组织SOD、CAT、MDA检测
取相同部位睾丸组织,按照南京建成生物工程研究所黄嘌呤氧化酶法(SOD)、紫外吸收法(CAT)、硫代巴比妥酸法(MDA)试剂盒的要求,将睾丸组织制成10%的匀浆液,分光光度计计算SOD、CAT、MDA的活力。
2.7 统计学方法
采用统计软件SPSS 20.0进行分析,符合正态分布及方差齐性的多组定量资料采用One-Way ANOVA test,方差不齐资料采用Tamhanes T2 test;不符合正态分布及方差齐性的多组定量资料采用Kruskal Wallis test方法进行比较。
3 结果
3.1 雄蚕益肾方对LOH大鼠睾丸指数的影响
与NG比较,睾丸指数显著降低(P<0.05)。
与MG比较,TG、雄蚕益肾方各组睾丸指数差异均无统计学意义(P>0.05)。说明上述药物干预并不能影响LOH大鼠睾丸指数。见表1。
3.2 雄蚕益肾方对LOH大鼠悬尾实验不动时间的影响
与NG比较,MG悬尾不动时间显著延长(P<0.05),反映LOH大鼠出现抑郁状态,符合临床LOH出现精神神经异常和体能下降要求。
与MG比较,TG、雄蚕益肾方各组悬尾不动时间显著缩短(P<0.05),说明上述各药物干预组均能缩短LOH大鼠悬尾不动时间。
与TG比较,XG-l、XG-m悬尾不动时间显著缩短(P<0.05),XG-h差异无统计学意义(P>0.05)。说明XG-l、XG-m在降低LOH大鼠悬尾不动时间方面优于TG。见表2。
3.3 雄蚕益肾方对LOH大鼠血清T的影响
与NG比较,MG血清T水平显著降低(P<0.05),符合LOH大鼠血清T水平低下的特点,满足LOH模型要求。
與MG比较,TG、雄蚕益肾方各组血清T水平显著升高(P<0.05),说明上述各药物干预组均能改善LOH大鼠血清T水平。
与TG比较,XG-l、XG-h血清T水平显著降低(P<0.05),XG-m差异无统计学意义(P>0.05)。说明XG-m改善LOH大鼠睾酮水平与TG相当。见表2。
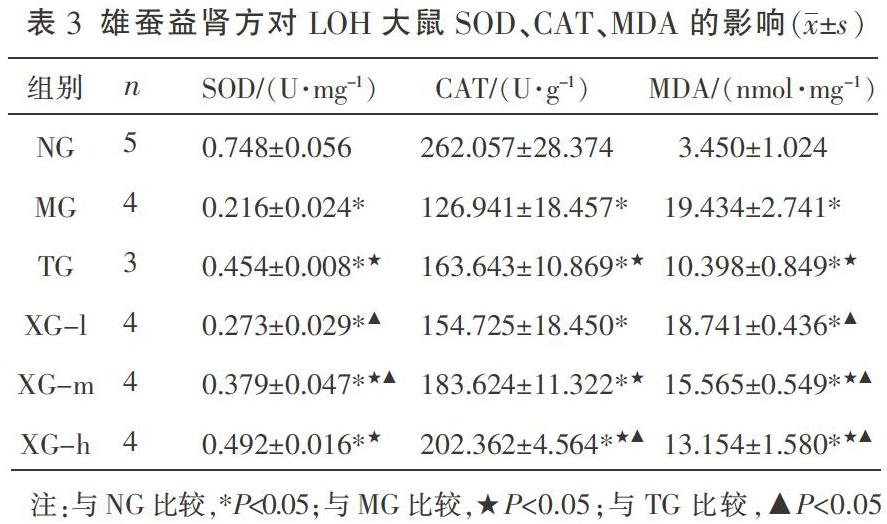
3.4 雄蚕益肾方对LOH大鼠睾丸组织SOD、CAT、MDA的影响
与NG比较,MG SOD、CAT水平显著降低(P<0.05),MDA水平显著升高(P<0.05),说明LOH大鼠睾丸组织发生氧化应激损伤。
与MG比较,TG、XG-h、XG-m各组SOD、CAT水平显著升高(P<0.05)、MDA水平显著降低(P<0.05),XG-lSOD、CAT、MDA差异无统计学意义(P>0.05)。说明TG、XG-h、XG-m能改善LOH大鼠氧化应激指标。
与TG比较,XG-hSOD水平差异无统计学意义(P>0.05),XG-hCAT显著升高(P<0.05),XG-h、XG-m MDA均显著升高(P<0.05)。提示XG-h升高SOD水平与TG相当,改善CAT水平优于TG,而降低MDA水平,TG优于XG-h、XG-m。见表3。
3.5 雄蚕益肾方对大鼠睾丸组织形态学影响
NG大鼠睾丸各级生精细胞发育正常,层次清晰,睾丸间质丰富;MG大鼠睾丸生精细胞数量减少,大量吞噬细胞,精子少,睾丸间质稀少;TG大鼠睾丸生精小管水肿,睾丸间质萎缩;雄蚕益肾方各组大鼠睾丸生精小管内精子数量增多,睾丸间质增多明显。见图1。
3.6 雄蚕益肾方对大鼠Leydig细胞超微结构影响
NG Leydig细胞线粒体数量多,聚集成线粒体鞘,线粒体嵴清晰,无水肿;MG线粒体数量明显减少,线粒体水肿明显,线粒体嵴不清晰,出现水肿扩张,空泡样变;TG较雄蚕益肾方各组、NG线粒体减少,部分线粒体水肿,部分线粒体嵴清晰;雄蚕益肾方各组线粒体数量明显增多,部分可见线粒体鞘,部分线粒体嵴清晰,线粒体水肿不明显。见图2。
4 讨论
40岁以后男性体内血清T水平将以每年0.8%~2%的速度缓慢下降[4],T水平低下是LOH发病的核心病机[16],本研究中LOHMG大鼠血清T水平显著低于NG(P<0.05),说明该模型完全符合LOH病理要求。Leydig cell是T合成的主要场所,因此在增龄导致T水平低下、LOH发病相关研究中,Leydig细胞是研究的关键点。许多研究[16-17]认为,随着年龄的增长,Leydig细胞数量减少和储备功能下降是主要原因之一。一方面增龄导致Leydig细胞数量减少。Neaves W B等[12]研究显示,与青年组(20~48岁)相比,老年组(50~76岁)Leydig细胞核数量减少了44%、核质平均总容量减少了40%,并且都与年龄呈负相关。同时Leydig细胞在形态和超微结构方面也会发生改变,邓春华等[18]研究报道,老年大鼠(20月龄)HE染色提示Leydig细胞体积变小,胞质浓缩,染色加深,细胞核固缩,可见双核、三核细胞;电镜提示Leydig细胞胞质含量减少,部分内质网出现水肿,常见线粒体嵴脱落,脂滴多而大,胞核异染色质增多。本研究中18月龄LOH大鼠睾丸组织HE染色示睾丸间质减少,Leydig细胞电镜示线粒体数量减少,水肿明显,并伴有空泡样变,与上述报道存在有一致性(见图1-2)。雄蚕益肾方干预后,LOH大鼠睾丸间质明显增多,电镜示线粒体数量增加、水肿减轻,说明雄蚕益肾方能一定程度改善LOH大鼠睾丸组织形态和超微结构。
另一方面,增龄导致Leydig细胞储备功能减退。形态和超微结构的异常可能是睾酮合成酶系整体功能衰退的表象。睾酮的合成涉及一系列的酶促反应与过程,主要与类固醇合成酶系(CYP11A1、HSD3B、CYP17A1、HSD17B)和胆固醇转运(StAR、TSPO)密切相关[19-20]。增龄将影响上述酶的活性或表达,直接导致Leydig细胞中类固醇合成通路上出现多重缺陷。目前对于这一改变的机制研究还存在许多不确定性,但有证据显示Leydig细胞内氧化还原反应失衡肯定参与其中。因为细胞内各种促氧化剂与抗氧化剂的失衡,将导致DNA、蛋白质和/或脂质损伤,进而导致功能障碍[21]。
活性氧(ROS)是正常细胞代谢过程中的产物,而在Leydig细胞中ROS产生会更高,因为除了线粒体电子传递链过程产生ROS,CYP11A1羟基化类固醇过程中还会产生ROS。随着年龄增加,ROS在Leydig细胞内蓄积,将导致Leydig细胞凋亡增加[22]、线粒体功能紊乱[23],同时ROS还可介导c-JUN信号通路抑制Nr77转录,进而降低睾酮合成酶基因表达[24]。SOD、CAT是机体内最主要的抗氧化酶,是生物体防御氧化应激的第一道防线。SOD将体内产生的ROS分解生成H2O2和O2,CAT再催化H2O2生成H2O和O2,通过清除超氧阴离子,进而保护细胞免受损伤,维持正常生理功能。MDA是脂质过氧化的最终产物,它反映了机体受氧化损伤的程度。本研究显示,LOH大鼠睾丸组织SOD、CAT含量显著降低,提示增龄诱发的大量活性氧自由基产生,并得不到有效清除,使抗氧化酶SOD、CAT活性受到抑制,机体受到氧化损伤,脂质过氧化程度加剧,因此,作为脂质过氧化作用代谢产物的MDA含量就会增加。本研究中TG、XG-m、XG-h均能改善LOH氧化应激指标,以XG-h升高SOD、CAT最明显,说明雄蚕益肾方能提高睾丸组织抗氧化酶活性,并呈明显剂量依赖关系。
T在体内以3种形式存在,即游离睾酮(FT,2%)、白蛋白结合睾酮(Alb-T,54%)、与性激素结合球蛋白结合睾酮(44%),前两者才是具有生物活性的睾酮(Bio-T)[25]。本研究TG、雄蚕益肾方各组均能提高LOH大鼠血清T水平,以TG改善最明显。但在降低LOH大鼠悬尾不动时间方面,XG-m、XG-l又明显优于TG。这也正是中医药治疗LOH的优势所在,一方面能提高T水平,另一方面,更能有效缓解LOH临床症状,并优于TST[9]。
综上所述,本研究证实了雄蚕益肾方能提高LOH大鼠血清T水平,降低悬尾不动时间,影响睾丸组织形态和超微结构,并通过增加睾丸组织抗氧化酶SOD、CAT活性、降低MDA含量,提升睾丸组织抗氧化能力。但本研究还存在一定局限性,因为睾酮水平的下降,除了与睾丸本身有关,也与下丘脑-垂体-睾丸轴内分泌相关,但本研究还未涉及;另外雄蚕益肾方是否会影响睾酮合成酶系和/或胆固醇转运酶的活性与表达,是否会影响Leydig细胞自噬,这都需要接下来的进一步研究。
参考文献
[1] 姜 辉,邓春华.中国男科疾病诊断治疗指南与专家共识[M]. 2016版.北京:人民卫生出版社,2017:142.
[2] 周 兴,周 青,赖永金,等.长沙地区城镇居民迟发性性腺功能减退症发病调查分析[J].湖南中医药大学学报,2017,37(12):1353-1357.
[3] WANG C, NIESCHLAG E, SWERDLOFF R, et al. ISA, ISSAM, EAU, EAA and ASA recommendations: investigation, treatment and monitoring of late-onset hypogonadism in males[J]. International Journal of Impotence Research, 2009, 21(1): 1-8.
[4] FODE M, SALONIA A, MINHAS S, et al. Late-onset Hypogonadism and Testosterone Therapy-A Summary of Guidelines from the American Urological Association and the European Association of Urology[J]. European Urology Focus, 2019, 5(4): 539-544.
[5] KHERA M. Controversies in testosterone supplementation therapy[J]. Asian Journal of Andrology, 2015,17(2):175-176.
[6] 李亚峰,付杰娜,崔伟锋,等.中醫治疗男性更年期综合征用药规律探析[J].中医研究,2019,32(11):72-75.
[7] 吕双喜,曾凡雄,邵魁卿,等.男性更年期综合征的中医用药规律及治疗思路探究[J].山东中医杂志,2017,36(2):136-139.
[8] 章新根,蔡海英.更年期综合征中医治疗方剂用药规律挖掘分析及临床应用举隅[J].江西中医药大学学报,2016,28(5):42-45.
[9] 周 兴,何清湖,周 青,等.中医药治疗男性更年期综合征随机对照试验的系统评价[J].中华中医药杂志,2013,28(9):2771-2775.
[10] 王孙亚,李望辉,周 兴,等.雄蚕益肾方联合小剂量他达拉非治疗男性迟发性性腺功能减退症伴男性勃起功能障碍的临床研究[J].中国性科学,2019,28(6):19-22.
[11] 王孙亚,李望辉,宾东华,等.雄蚕益肾方联合小剂量睾酮补充治疗男性迟发性性腺功能减退症临床观察[J].湖南中医药大学学报,2018,38(8):903-907.
[12] NEAVES W B, JOHNSON L, PORTER J C, et al. Leydig cell numbers, daily sperm production, and serum gonadotropin levels in aging men[J]. The Journal of Clinical Endocrinology and Metabolism, 1984, 59(4): 756-763.
[13] LI W R, CHEN L, CHANG Z J, et al. Autophagic deficiency is related to steroidogenic decline in aged rat Leydig cells[J]. Asian Journal of Andrology, 2011, 13(6): 881-888.
[14] JEONG H C, JEON S H, GUAN QUN Z, et al. Lycium chinense Mill improves hypogonadism via anti-oxidative stress and anti-apoptotic effect in old aged rat model[J]. Aging Male, 2018: 1-10.
[15] CAN A, DAO D T, TERRILLION C E, et al. The tail suspension test[J]. Journal of Visualized Experiments, 2012(59): e3769.
[16] XU W, ZHU Q, ZHANG B, et al. Protective effect of calretinin on testicular Leydig cells via the inhibition of apoptosis[J]. Aging, 2017, 9(4): 1269-1279.
[17] MAHMOUD A, COMHAIRE F H. Mechanisms of disease: late-onset hypogonadism[J]. Nature Clinical Practice. Urology, 2006, 3(8): 430-438.
[18] 邓春华,郭海彬,刘建中.老年大鼠睾丸间质细胞结构和功能变化的实验研究[J].中华男科学杂志,2005(10):740-743.
[19] PAPADOPOULOS V, MILLER W L. Role of mitochondria in steroidogenesis[J]. Best Practice & Research. Clinical Endocrinology & Metabolism, 2012, 26(6): 771-790.
[20] PAPADOPOULOS V, BARALDI M, GUILARTE T R, et al. Translocator protein (18 kDa): new nomenclature for the peripheral-type benzodiazepine receptor based on its structure and molecular function[J]. Trends in Pharmacological Sciences, 2006, 27(8): 402-409.
[21] MULLER F L, LUSTGARTEN M S, JANG Y, et al. Trends in oxidative aging theories[J]. Free Radical Biology & Medicine, 2007, 43(4): 477-503.
[22] DING X, WANG D, LI L, et al. Dehydroepiandrosterone ameliorates H2O2-induced Leydig cells oxidation damage and apoptosis through inhibition of ROS production and activation of PI3K/Akt pathways[J]. The International Journal of Biochemistry & Cell Biology, 2016, 70: 126-139.
[23] DIEMER T, ALLEN J A, HALES K H, et al. Reactive oxygendisrupts mitochondria in MA-10 tumor leydig cells and inhibits steroidogenic acute regulatory (StAR) protein and steroidogenesis[J]. Endocrinology, 2003, 144(7): 2882-2891.
[24] LEE S Y, GONG E Y, HONG C Y, et al. ROS inhibit the expression of testicular steroidogenic enzyme genes via the suppression of Nur77 transactivation[J]. Free Radical Biology & Medicine, 2009, 47(11): 1591-1600.
[25] HAYES L D, ELLIOTT B T. Short-term exercise training inconsistently influences basal testosterone in older men: a systematic review and meta-analysis[J]. Frontiers in Physiology, 2018, 9: 1878.
(本文編辑 贺慧娥)
