IL-22BP对肠炎相关性结直肠癌小鼠脾单核细胞和结肠组织炎症因子表达的影响
2020-10-09叶华涂云
叶华,涂云
(1.广东医科大学广东省天然药物研究与开发重点实验室,广东 湛江 524023;2.广东医科大学海洋医药研究院,广东 湛江 524023;3.湛江中心人民医院,广东 湛江 524023)
炎症性肠病(包括溃疡性结肠炎和克罗恩氏病)是导致结直肠癌发生的高发因素之一。肠炎相关性结直肠癌(colitis -associated colorectal cancer,CAC)的发病模式为“正常肠黏膜→急性炎症→慢性炎症→不典型增生→上皮内瘤变→腺癌”,与经典的结直肠癌发病模式并不完全相同。前期的炎症是CAC发展的先决条件,炎症因子在其中发挥重要作用。白细胞介素-22(IL-22)是IL-10细胞因子家族的成员,在各种不同的炎症反应中具有不同的功能,主要取决于所处的炎症环境[1]。肠道慢性炎症时,IL-22在肠道组织中长期大量表达,在促进肠道黏膜愈合的同时,也会刺激肠道细胞增殖,从而引发结直肠癌[2]。与IL-10细胞因子家族的其他成员不同,IL-22具有一种可溶性分泌受体,称为IL-22结合蛋白(IL-22BP)。尽管IL-22BP与IL-22受体1(IL-22R1)具有最高的结构同源性,IL-22BP对IL-22的亲和力比IL-22R1高很多,因此可以阻止IL-22与IL-22R1结合。在肠道等多个组织中都观察到了IL-22BP的组成性表达,并认为可能通过抑制IL-22功能参与调节结肠组织修复和肿瘤的发生[3],然而IL-22BP如何调节肠炎相关性结直肠癌的作用机制尚不清楚。因此本文建立了肠炎相关性结直肠癌小鼠模型,研究IL-22BP对脾单核细胞和结肠组织干扰素γ(IFN-γ)、IL-17A、IL-22、IL-6和肿瘤坏死因子α(TNF-α)等炎症因子表达的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级雄性C57BL/6小鼠,6~7周龄,体重(20±2)g/只,购于北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2012-0001。
1.1.2 试剂及仪器 氧化偶氮甲烷(AOM)购于美国Sigma公司;葡聚糖硫酸钠(DSS,分子量:36 000~50 000 Da)购于美国MP Bio公司;红细胞裂解液购于碧云天生物技术有限公司;CD3/CD28抗体购于美国Cell Signaling Technology 公司;IFN-γ、IL-17A、IL-22、IL-6和TNF-α ELISA试剂盒购于武汉华美生物工程有限公司。组织包埋机(武汉俊杰电子有限公司);组织切片机RM2235(德国Leica公司);酶标仪(美国宝特Bio-Tek公司)。
1.2 实验方法
1.2.1 动物模型的建立和分组给药 20只C57BL/6小鼠随机分模型组和IL-22BP组,两组小鼠均腹腔注射12 mg·kg-1AOM 1次,1周后先自由饮用2%DSS,连续5 d,然后改为普通洁净水,连续饮用16 d,此21 d为1个周期,共重复4个周期。IL-22BP组从每个周期的第15天开始腹腔注射IL-22BP 0.2 mg·kg-1,每两天注射1次,共重复4个周期。第120天颈椎脱臼处死小鼠,收集脾脏和结肠组织,观察记录肿瘤形态、数量,计算肿瘤发生率。
1.2.2 结肠组织病理学观察 小鼠结肠组织用PBS清洗后,滤纸吸干,在结肠远端取2 cm组织放置于10%中性福尔马林溶液中固定24 h,常规脱水,石蜡包埋,切片,HE染色,显微镜下观察,区分结肠上皮内瘤变属于低级别上皮内瘤变(low-grade of intraepithelial neoplasia,LGIN)还是高级别上皮内瘤变(high-grade of intraepithelial neoplasia,HGIN),同时对结肠进行炎症评分、黏膜息肉评分和肿瘤评分[4],根据炎症、水肿、上皮缺损、隐窝萎缩、增生和不典型增生/肿瘤的评分情况计算得出结肠的组织学活动指数(HAI)。
1.2.3 脏器指数的测定 完整分离小鼠脾脏和结肠,去除脂肪和筋膜后称重,分别以脾脏和结肠重量(mg)/小鼠体重(g)计算得出脾脏指数和胸腺指数。
1.2.4 脾单核细胞培养 将脾脏剪成1~2 mm组织块,置于50 μm细胞筛网轻柔研磨。收集到的细胞培养于DMEM培养基(含10%胎牛血清、2 mol·L-1谷氨酰胺、50 U·mg-1青霉素和50 U·mg-1链霉素),使用红细胞裂解液裂解红细胞。将细胞按照2.5×106/孔接种到24孔板,加抗CD3/CD28抗体(4 μg·mL-1)在DMEM培养基中培养48 h(37 ℃,10% CO2),收集上清液80 ℃冷存备用。
1.2.5 ELISA法检测脾单核细胞和结肠组织IFN-γ、IL-17A、IL-22、IL-6和TNF-α表达 将待测结肠组织与低温生理盐水按照1∶9放入匀浆器充分研磨后,于4 ℃以5 000 r·min-1离心5 min,收集上清液备用。按ELISA试剂盒要求操作,于450 nm检测吸光度。

2 结果
2.1 IL-22BP对CAC小鼠成瘤情况的影响 收集各组小组结肠标本,可见模型组和IL-22BP组小鼠结肠可见不同程度充血水肿增厚,有大小不一的肿瘤出现在肠壁的黏膜面,主要分布在距肛门4~6 cm以内的肠段,肿瘤直径约2~5 mm,表面光滑、质韧,未见溃疡及菜花样改变。与模型组相比,IL-22BP组小鼠肿瘤数量明显降低,小鼠平均肿瘤数目由(3.6±1.24)减少为(1.6±0.97)个,差异有统计学意义(见表1)。根据WHO分类,轻度和中度异型增生属于LGIN,重度异型增生和原位癌属于HGIN,可见模型组肿瘤发生率为100%,其中HGIN 9例,LGIN 1例;IL-22BP组肿瘤发生率为90%,其中HGIN 6例,LGIN 3例,较模型组有所降低。

表1 IL-22BP对CAC小鼠成瘤情况的影响
2.2 IL-22BP对CAC小鼠结肠组织病理学改变的影响 病理结果发现,实验中诱发的结肠肿瘤为腺癌,在组织学上为高分化管状腺癌。实验结束时,对结肠进行炎症评分、黏膜息肉评分、肿瘤评分和HAI评分,结果见表2显示,IL-22BP组肿瘤评分和HAI评分均显著低于模型组,结果有统计学差异(P<0.05)。

表2 IL-22BP对CAC小鼠结肠组织病理学改变的影响
2.3 IL-22BP对CAC小鼠脏器指数的影响 结果见表3,模型组小鼠脾脏指数为4.82±0.59,IL-22BP组小鼠脾脏指数为3.09±0.52,较模型组降低(P<0.05),差异具有统计学意义;模型组小鼠结肠指数为19.34±1.72,IL-22BP组小鼠结肠指数为15.77±2.09,较模型组降低(P<0.05),差异具有统计学意义。

图1 小鼠结肠组织病理学变化
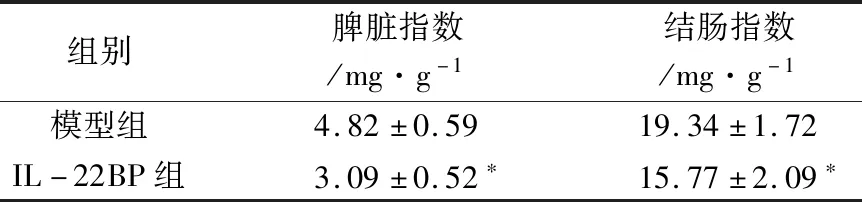
表3 IL-22BP对CAC小鼠脏器指数的影响
2.4 IL-22BP对CAC小鼠脾和结肠组织炎症因子表达的影响 结果见表4~5,ELISA法检测IFN-γ、IL-17A、IL-22、IL-6和TNF-α表达,与模型组相比,IL-22BP组脾单核细胞和结肠组织IFN-γ、IL-6和TNF-α水平增高(P<0.05或P<0.01),IL-17A水平有所降低,IL-22水平无明显改变。

表4 IL-22BP对CAC小鼠脾单核细胞炎症因子的影响

表5 IL-22BP对CAC小鼠结肠组织炎症因子的影响
3 讨论
结直肠癌是导致癌症死亡的第二大因素。结直肠癌的发展是一个多阶段的过程,包括致癌物、遗传改变和宿主免疫系统之间的复杂相互作用,并最终导致癌症的发生。与肝癌、前列腺癌、胃癌等常见恶性肿瘤相似,慢性炎症是结直肠癌发展的独立危险因素,如溃疡性结肠炎患者结直肠癌发病率显著增加[5]。对炎症相关结肠癌发生的研究表明,炎症细胞衍生的细胞因子直接或间接刺激癌细胞的生长[6-7]。然而,在特定的炎症条件下,免疫细胞也可以通过清除增生异常细胞和癌细胞的下游效应介导抗肿瘤反应[8]。特别是肠炎相关结直肠癌,表现出广泛的炎性浸润,细胞因子在肿瘤微环境中的高表达。
本研究结果表明,IL-22BP可以显著抑制CAC小鼠肿瘤生长,而且IL-22BP组肿瘤评分和HAI评分均显著低于模型组。免疫/炎症细胞控制癌细胞增殖的能力主要取决于细胞因子,其中Th1CD4+细胞、CD8+细胞和NK细胞产生γ干扰素(IFN-γ),通过激活细胞毒性免疫来限制肿瘤生长[9]。我们观察到给予IL-22BP后,肠道和脾单核细胞IFN-γ含量均有所提高。
在人类CRC中检测到,Th17 CD4+细胞产生的肿瘤特异性细胞因子如IL-17A和IL-22表达上调[2,6]。多项研究也证明了这些细胞因子在促进肿瘤发生发展中的重要性,与之相对应的是Th17免疫细胞浸润对结直肠癌患者的预后有负面影响[10]。我们发现小鼠腹腔注射IL-22BP后,脾单核细胞IL-17A含量有所下降。但是肠道和脾单核细胞IL-22含量没有明显改变,说明IL-22BP对肠炎相关性结直肠癌的抑制作用是通过影响IL-22与IL-22R1的结合,对IL-22的表达没有影响。
细胞因子IL-6和TNF-α对炎症和癌症都是至关重要的,它们可以构成一个同时促进炎症和肿瘤生长的中枢信号通路[11]。临床研究显示,结直肠癌患者血清IL-6和TNF-α水平升高,两者共存水平与预后密切相关[12]。然而在本研究中虽然IL-22BP可以抑制CAC小鼠肿瘤生长,但IL-6和TNF-α含量有所增加。肿瘤微环境中的细胞因子主要由造血细胞产生,但一些细胞因子如IL-6和TNF-α也可由恶性细胞自身产生,以建立一个自分泌肿瘤促进信号回路,进一步增强NF-κB和STAT3的激活。我们推测,在本研究中,由于IL-22的活性被IL-22BP抑制,从而反馈性引起恶性细胞增加IL-6和TNF的分泌。
综上所述,通过建立肠炎相关结直肠癌小鼠模型,可以观察到IL-22BP抑制CAC小鼠肿瘤生长,进一步研究脾单核细胞和结肠组织IFN-γ、IL-17A、IL-22、IL-6和TNF-α等炎症因子表达,发现IFN-γ、IL-6和TNF-α水平增高,IL-17A含量降低,IL-22含量无明显改变,表明IL-22BP对炎症因子的作用是一个复杂的网络调节体系,还需要深入研究。
