红山樱新品种粉彩组培快繁技术研究
2020-10-09张蕾蕾奉树成王贤荣
张蕾蕾,奉树成,王贤荣
(1.南京林业大学生物与环境学院,江苏 南京 210000; 2.上海植物园,上海 200231)
粉彩(Fencai)为优良乡土植物红山樱(Cerasusjamasakura)种系下的新品种,具有花期早、花色艳丽、花径大、抗性强等诸多优点,在园林应用、行道树及庭院美化方面,拥有极大的市场前景和推广应用价值。但由于其传统的繁殖方法周期长,结实率低且幼果易脱落等因素的影响,导致粉彩的规模化生产受到严重限制,极大阻碍了其市场的发展,运用组织培养技术来完善其繁殖体系尤为关键。
近年来,很多学者对樱花进行大量研究,樱属植物组织培养快速繁殖体系均有建立[1-4]。樱属组织培养多以离体器官直接诱导成苗方式进行,Paprstein F.等[5]以2个甜樱桃品种的茎尖为外植体,在离体条件下直接产生新植株;佐々木揚[6]使用野樱桃芽腋研究了日本传统手工业的3种优良野生无性系繁殖成本;及华[7]以山樱花品种敬翁樱的嫩梢和带腋芽的茎段为材料,获得完整植株,移栽成活率达90%;Negishi K等[8]进行东京樱花(Cerasusyedoensis(Matsum.) Yu et Li)组培时,通过添加激素6-BA、GA3、IBA可直接诱导芽原基产生新植株。尽管直接诱导茎尖或腋芽再生植株可行有效,但该法的增殖系数低且易受取材季节和天气限制,因此提高丛生不定芽增殖系数对于短期内获得大量芽苗并进行产业化生产极为重要。本研究以红山樱新品种粉彩幼茎为材料,采用全组合实验设计和正交试验法研究不同培养基和激素组配对粉彩再生的影响,为规模化种植和生产粉彩良木提供理论依据。粉彩作为新品种,有关组培快繁体系的研究未见报道,以粉彩的幼嫩茎段为外植体,采用全组合试验设计植物生长调节剂对粉彩组培的影响,初步建立粉彩的组培体系,为规模化生产提供理论依据。
1 材料与方法
1.1 材 料
供试材料为红山樱种系下新品种粉彩三年生种苗,取自南京林业大学樱花研究基地。3月—5月晴朗天气,选择生长健壮、无病虫害的幼嫩茎段。
1.2 方 法
1.2.1试验材料处理与消毒
将采集的幼嫩茎段进行修整,剪成1.5~2.0 cm的带腋芽小段,将修整好的小段放在洗涤剂中浸泡并搅拌,之后将洗涤后的材料分别用流水冲洗0、30、60、90 min,再转入无菌操作台进一步操作。用70%~75%乙醇浸泡25~30 s,无菌水清洗3~5次,重复3次,再用0.1%的HgCl2分别消毒处理3、5、7、10 min,无菌水清洗3~5次,过程中不断摇晃,使其彻底消毒。
1.2.2诱导愈伤组织培养基筛选
愈伤组织诱导启动培养基采用1/4 MS[9]作为基本培养基,以6-BA(0.5、1.0、1.5 mg·L-1)、IBA(0.01、0.02、0.03 mg·L-1)激素组合,采用全组合进行试验(见表2),于黑暗中培养。通过观察愈伤组织生长情况,分析不同激素浓度和激素组合对粉彩愈伤组织诱导的影响,从而筛选出最佳诱导培养基,并挑选健壮的愈伤组织进行下一步试验。
出愈率(%)=(出愈外植体数/接种外植体数)×100%;
有效愈伤率(%)=(可用于分化愈伤数/出愈外植体数)×100%。
1.2.3愈伤组织分化丛生芽培养基诱导
根据史港影等[9]的试验结果,选择MS培养基为基本培养基,以6-BA(0.5、1.0、1.5 mg·L-1)、IBA(0.01、0.02、0.03 mg·L-1)激素组合进行实验,采用全组合试验方法(见表3),通过观察丛生芽生长情况,综合分析激素浓度和激素组合对丛生芽生长的影响,筛选出丛生芽分化最佳的培养基。
1.2.4芽苗增殖培养
参照史港影等[9]的方法,对长势优良的芽苗进行增殖培养。以MS为基本培养基,以6-BA(0.5、1.0、1.5 mg·L-1)、NAA(0.1、0.3、0.5 mg·L-1)、TDZ(0.1、0.2、0.3 mg·L-1)激素组合,采用正交设计表L9(34)进行试验(见表4、表5),每个处理接种50瓶,每瓶接种3~4块丛生芽团,置于培养室中进行培养。每隔7 d观察1次生长情况并做好记录,40 d为1个周期,统计各组合芽苗生长状况。

表5 6-BA、NAA、TDZ组合对芽苗增殖的影响
增殖系数=(一个周期内形成的有效苗数/接种苗数)×100%。
1.2.5生根和移栽
培养基MS、1/2 MS和3/4 MS为基本培养基,激素组合参照福建山樱花的生根诱导培养基IBA 0.5mg·L-1、NAA 0.2 mg·L-1[10,11]。通过观察芽苗生根状况,筛选获得最佳激素组合。
将生长健壮,根系良好的组培苗进行移栽。移栽前炼苗,揭盖,注入稍高于培养基0.3 cm的无菌水,在培养室炼苗2~3 d后进行移栽,移栽基质第1种配方参考南程慧等[12]的培养基质,珍珠岩∶河沙∶蛭石=1∶1∶1;第2种配方参考吕月良等[13],珍珠岩∶泥炭土=1∶2,第3种配方为珍珠岩∶泥炭土∶蛭石=1∶2∶1。
1.2.6培养条件与统计方法
培养室温度26 ℃,光照强度2 500 lx,光/暗(12 h/12 h)培养。
采用SPSS 23软件和Excel 2016软件共同对实验结果进行分析和统计。
2 结果与分析
2.1 不同消毒条件对茎段污染及愈伤形成的影响
由表1可见,茎段经流水冲洗30 min,以0.1%的HgCl2处理5 min时效果最佳。
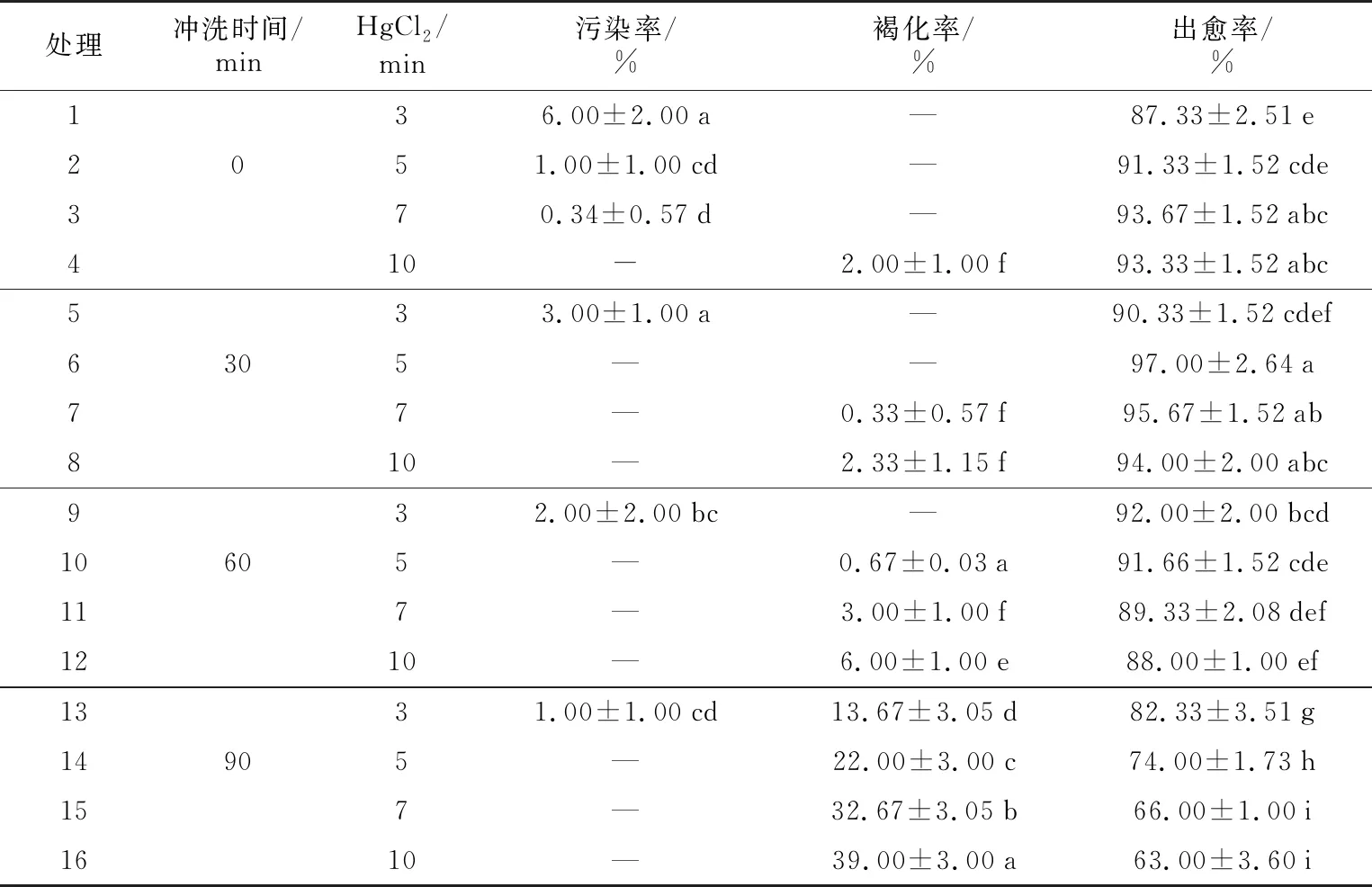
表1 茎段灭菌情况
以流水冲洗时间为例,污染率随流水冲洗时间的增加而逐渐减少,但褐化率则随流水冲洗时间的增加而逐渐增加,当流水冲洗时间超过30 min时,污染率逐渐减少,最大仅为3%,当流水冲洗时间为90 min时,褐化率高达39%;HgCl2处理与流水冲洗处理情况相同,流水冲洗超过30 min和HgCl2处理超过5 min时,污染率均为0,而褐化率则逐渐上升,最高达39%,严重影响了茎段出愈率,此时出愈率仅为66%,部分发生褐化的茎段死亡,无法继续进行愈伤组织诱导。处理6中,流水冲洗30 min,HgCl2处理5 min时,污染率、褐化率均为0,出愈率97%,效果最佳。
综上所述,冲洗时间和HgCl2处理时间的增加,会导致茎段污染率降低,褐化率升高,且褐化率对出愈率影响较大,呈负相关性。

图1 愈伤组织诱导
2.2 不同激素组合对愈伤组织诱导的影响
本研究表明激素组合6-BA 1.0 mg·L-1+IBA0.02 mg·L-1对诱导愈伤组织效果最好,该组合下愈伤组织诱导快,健壮愈伤组织多,颜色黄白色,结构紧密颗粒状。
由表2可知,高浓度的6-BA诱导愈伤组织速度快,产生愈伤组织量多,但同时有水渍化现象产生,尤其在6-BA的浓度升高至1.5 mg·L-1时,愈伤组织诱导速度快,量大,结构疏松,质地晶莹剔透,引起玻璃化,后期有根出现,继代一次后表现为自身生长,不利于分化培养。激素IBA的浓度影响愈伤组织结构的疏密程度,从2、5、8号处理发现,当IBA浓度为0.02 mg·L-1时,愈伤组织诱导量少,愈伤组织结构紧密成块状,生长速度一般,选择激素6-BA 1.0 mg·L-1,与激素IBA 0.02 mg·L配合使用时,愈伤组织呈现黄白色,质地紧密,后期逐渐变绿,有利于后期分化丛生芽。
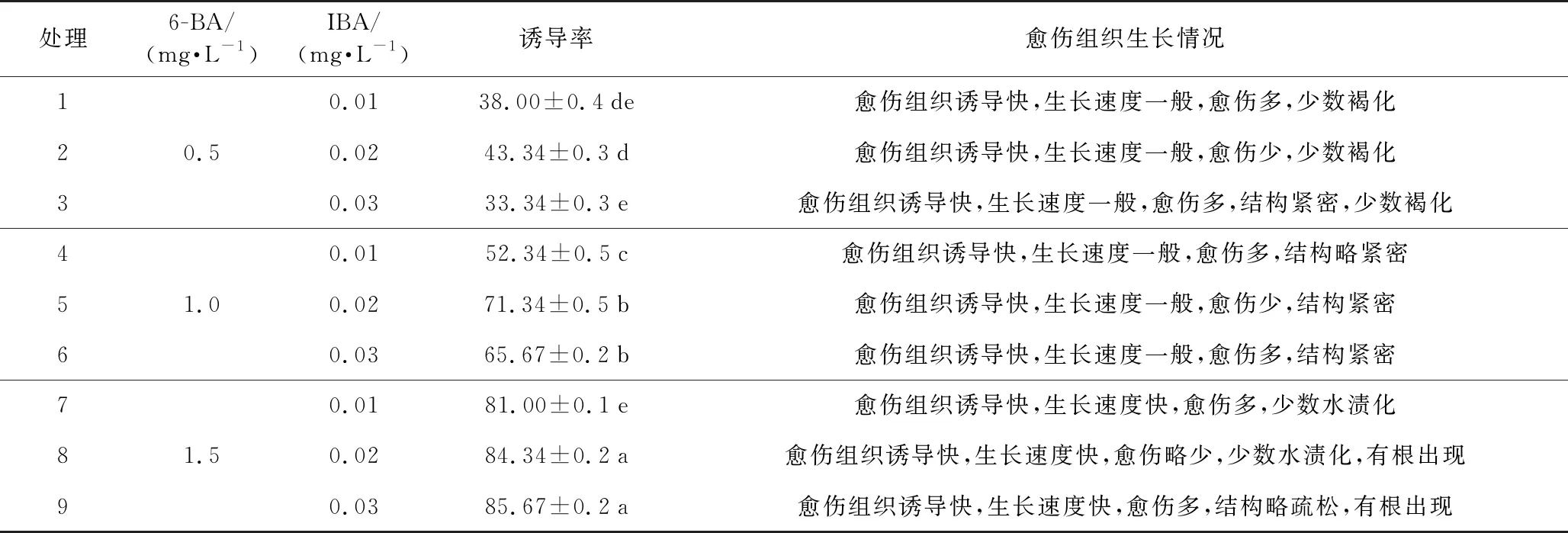
表2 6-BA、IBA激素组合对愈伤组织诱导的影响
图2 愈伤组织分化丛生芽
2.3 不同激素组合对分化丛生芽的影响
由表3可知,激素组合6-BA 1.0 mg·L-1+IBA 0.01 mg·L-1对分化丛生芽效果最佳。

表3 6-BA、IBA激素组合对分化丛生芽的影响
激素6-BA浓度会影响愈伤组织分化丛生芽。在1~6号处理中,激素6-BA的浓度为0.5~1.0 mg·L-1时,愈伤组织表现增殖少,有绿色颗粒状物出现,部分有芽眼出现;在7~9号处理中,激素6-BA的浓度为1.5 mg·L-1时,愈伤组织增殖快,偶有绿色团块出现,无芽眼分化,有水渍化出现,且继代一次后,绿色团块组织生长加快,有明显膨大现象,伴随水渍化出现,丧失分化的能力。结合以上现象得出,高浓度的6-BA不利于愈伤组织分化丛生芽。
当激素IBA浓度为0.03 mg·L-1时,愈伤组织表现为膨大生长,无芽体分化,而当激素IBA浓度为0.01 mg·L-1时,分化最多,分化率为43.33%。说明高浓度的IBA不利于分化丛生芽。
IBA与6-BA配合使用时,当6-BA浓度在(0.5、1.0 mg·L)和IBA浓度在(0.01、0.02 mg·L-1)之间,愈伤组织均有绿色颗粒出现,继代一次后,愈伤组织块变紧实,芽眼出现,4号、5号均有芽体分化。
2.4 不同激素组合对芽苗增殖的影响
由表4可知,6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1+TDZ 0.1~0.2 mg·L-1为芽苗增殖激素组合,最高增殖系数为503.33%。
由表3可知,激素6-BA和NAA各水平间差异不大,TDZ各水平间差异明显,呈现下降趋势,以1.0~1.2 mg·L-1时增殖效果较好,综合增殖系数与芽苗生长状况(表4)来看,激素6-BA浓度和激素NAA浓度对芽苗增殖的质量影响较大,在7、8、9号处理中,当激素6-BA浓度为1.5 mg·L-1时,芽苗增殖快,节间明显增长,新生丛生芽多,但小叶叶型狭小细长,后期生长慢,仍有弯曲皱缩现象,长势弱,有玻璃化现象出现,因此,高浓度的6-BA不利于芽苗的健壮。在1、4号处理中,当激素NAA浓度为0.1 mg·L-1时,芽苗表现出叶小,节间变化不明显,新生丛生芽少的现象,但芽苗生长健壮,活力强,因此,低浓度的NAA有利于芽苗增殖生长。添加激素TDZ后,新生丛生芽生长明显增多,生长速度加快,新叶颜色浅绿。

注:A为健壮增殖芽苗;B、C为细弱增殖芽苗。图3 芽苗增殖

表4 6-BA、NAA、TDZ水平间增殖系数多重比较
通过正交试验的方法,继代一次后,芽苗长势良好,节间伸长明显,新生丛生芽逐渐生长,颜色浅绿,叶变大,叶片出现卷缩成柱状的现象有所改善;继代二次后,丛生芽生长健壮,叶色绿色,叶片开展正常,可直接切分进行壮苗生根,部分丛生芽出现徒长现象,后期经过复壮处理,使其可进行生根培养,而部分细弱芽苗为提高成活率,需继代复壮多次后方可进行生根培养。
2.5 基本培养基及激素对芽苗生根的影响
由表6可知,生根培养基选择3/4 MS基本培养基效果最好。试验发现,MS培养基和1/2 MS培养基生根时间久,3/4 MS培养基用时最短。从长势看,MS培养基中同时长出4~5条主根,无须根,长度大致相同,颜色白色,生长速度一般,10 d后,由白色渐转变成米黄色,主根停止生根,1/2 MS培养基中主根短小膨胀成纺锤状,15 d后,尖端生出细弱的根,后期主根停止生长,变褐死亡。3/4 MS培养基中生根快,最早记录在3 d后就有一个白色根尖冒出,后持续生根,主根健壮,白色,在生长主根处或主根上产生须根,须根生根较主根生长晚3~5 d,后期主根渐变成黄白色,须根仍呈现白色。

表6 基本培养基对芽苗生根的影响
由表6可见,激素组合NAA 0.5 mg·L-1+IBA0.5 mg·L-1对生根诱导效果最佳,具体表现为生根速度快,主须根适宜,且生长健壮。

表7 NAA和IBA组合对生根的影响

注:A为正常生根;B为无须根生根;C为根系膨大生根。图4 生根情况

注:A为培养室炼苗;B为覆膜移栽;C为移栽成苗。图5 炼苗移栽
1、5、9号处理,当NAA的浓度与IBA浓度比值为1时,根系生长状况较好,主根生根快,根系白色健壮,须根量多,幼苗上部分生长良好,叶片开展良好,节间增长,上部与下部协调生长,后期须根在主根生出处或主根上长出,颜色白色,量多。
2.6 不同基质组合对成活率的影响
由表8可知,基质组合珍珠岩∶泥炭土∶蛭石=1∶2∶1移栽成活效果最佳,成活率最高达53.34%。由于幼苗在培养室微环境与室外环境差距很大,对移栽成活率影响较大。当珍珠岩、河沙和蛭石组合时,由于珍珠岩和河沙持水量弱,因此其组合移栽成活率最低,仅有20%,珍珠岩和泥炭土组合时,大比重的泥炭土会造成积水,不利于根系生长,因此其组合移栽成活率为40%,移栽基质的要求是既要保水保营养,又要透气促进根呼吸,因此基质组合珍珠岩∶泥炭土∶蛭石=1∶2∶1时成活率最高,为53.33%。

表8 成活率情况
3 讨论与结论
木本植物组织培养的关键技术是建立无菌体系,外植体的选择和消毒方法至关重要[14],对不同取材部位进行灭菌时间也不同,已建立的樱属植物组培快繁体系多以幼嫩茎段为外植体[4、15-18],推测原因是幼嫩茎段中所含的植物内源激素较多,细胞活力强,有利于脱分化与再分化。有研究发现,细胞分裂素(BA或KT)与生长素(IBA或NAA)的激素浓度配比对樱花的启动培养影响效果较显著,且低浓度的IBA和低浓度的6-BA有利于愈伤组织诱导和分化[2,19],本试验采用不同浓度6-BA和IBA组合进行诱导愈伤组织试验,发现愈伤组织诱导良好。培养基中添加Vc,有效降低分化过程中的愈伤组织褐化率[20-22],本试验在愈伤组织分化丛生芽时添加Vc 30 mL·L-1。陈志伟等发现,在培养基中单独添加0.5 mg·L-1的IBA可有效诱导生根,生根率达100%[23];Sarropoulou[24]在2种樱桃枕木生根培养中发现,IBA和L-精氨酸浓度的组合中,根长度最长38 mm;藤原直哉[25]在四季樱组培中发现,在MS培养基中添加NAA有利于不定根的产生。本试验采用不同浓度NAA和IBA组合进行生根诱导,生根快,主须根发达。
本研究采用间接诱导丛生芽的方式,提高增殖率,短时间内获得大量芽苗,亦可保留植株的优良性状,减少菌体污染。结果表明,以幼嫩茎段为外植体,采用75%乙醇消毒30 s,0.1%的HgCl2处理5 min,无污染出现,外植体在1/4 MS+6-BA 1.0 mg·L-1+IBA 0.02 mg·L-1培养基中产生愈伤组织速度快,用于分化丛生芽的有效愈伤组织团量大,后转接分化丛生芽培养基1/4 MS+6-BA 1.0 mg·L-1+IBA 0.01 mg·L-1+Vc 30 mL·L-1中,芽眼生长快,丛生芽分化率高,丛生芽增殖的培养基是MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1+TDZ 0.1~0.2 mg·L-1+CH 500 mg·L-1,最高增殖系数为503.33%。生根的最佳培养基配方为3/4 MS+NAA0.5 mg·L+IBA 0.5 mg·L-1,平均生根时间为5 d。移栽前,尽量冲洗干净根系培养基,注意动作轻柔,避免损伤根系,移栽的最佳基质配方是珍珠岩∶泥炭土∶蛭石=1∶2∶1,移栽成活率达53.33%。由于幼苗在培养室微环境与室外环境差距很大,对移栽成活率影响较大,为尽快度过培养基与基质之间提供营养的环境,在室外进行覆膜遮盖,控温保湿,提高幼苗的成活率。
