CRISPR/Cas 9基因编辑技术降低贵州禾株高研究
2020-10-09郭洪刚曹雪娇曾晓芳赵德刚
郭洪刚,曹雪娇,曾晓芳,赵德刚,2
(1.贵州大学生命科学学院/农业生物工程研究院/山地植物资源保护与种质创新教育部重点实验室,贵州省农业生物工程重点实验室,贵阳 550025;2.贵州省农业科学院国家农业农村部DUS中心贵阳分中心,贵阳 550006)
水稻是世界主要粮食作物之一。随着全球人口不断增长和耕地面积日益减少,提高水稻产量对保障世界粮食安全具有重要意义[1]。株高是水稻重要的农艺性状之一,水稻植株高度过高易引起倒伏,导致光合产物形成、运输和储存受到阻碍,同时也会引起水稻籽粒腐烂和霉变,从而降低水稻产量。适当降低水稻植株高度可以提高水稻植株耐肥性,还可以提高水稻产量[2]。水稻“绿色革命基因”OsGA20ox2(sd1),编码赤霉素合成途径中关键酶——赤霉素20氧化酶(GA 20 ox),GA 20 ox催化GA 53转换为GA 20[3]。sd1就是由于特定位点的突变导致水稻体内活性赤霉素(gibberellin,GA)合成受阻、活性GA含量下降,从而使植株表现出不同程度矮化,使得水稻植株获得半矮秆的表型,产量提高[4]。由于OsGA20ox2基因仅在水稻叶片、茎秆和未开放的花中表达,所以sd1突变体的性状仅表现为植株半矮化,但其产量不受影响[5]。因此,获得OsGA20ox2基因功能敲除且能稳定遗传的水稻品种对降低水稻株高,提高其抗倒伏能力具有重要意义。
CRISPR/Cas系统具有较高的效率和特异性,并且载体构建简便灵活。由于插入位置与作用位点分离,在转基因植物的后代中通过自交和回交等手段可将带有CRISPR元件的T-DNA插入从基因组中分离出去,从而可以在不改变其他优良性状的基础上,直接对基因组内源基因进行定点修饰[7]。目前随着CRISPR/Cas 9技术的发展成熟,已经逐渐应用到动植物、微生物等领域,在植物界已广泛应用于番茄、拟南芥、水稻、小麦等[6-8]。利用CRISPR/Cas系统在水稻中已成功实现对多个功能基因进行定点突变,并获得稳定的突变体植株[9]。同时,作为进行植物功能基因组学研究的一种重要手段,CRISPR/Cas 9基因编辑技术已广泛应用于水稻的理论研究以及各种优良性状的分子育种工作中。
贵州禾是经过长期的自然选择和人工选择,形成的特殊水稻生态型,是贵州省黔东南从江、黎平、榕江、剑河等县苗族、侗族人民重要的粮食作物[10]。贵州禾具有色泽光亮、米体滚圆、香味浓郁、口感细腻、粘度适中、油脂多而不腻、耐水浸泡等优良食味品质[11]。黎平杂边禾是一种具有穗大、籽粒饱满等特点的高秆贵州禾材料。本实验室在前期引种中发现,黎平杂边禾在贵阳地区表现出植株株高增加、极易倒伏的性状,严重影响了其推广应用。因此,本研究通过设计构建水稻OsGA20ox2基因定点突变的CRISPR/Cas 9表达载体,遗传转化黎平杂边禾,以期获得OsGA20ox2基因敲除的半矮化突变植株,对探索该技术在贵州地方稻种遗传育种中的应用潜力提供一定的技术支持。
1 材料与方法
1.1 材 料
水稻材料黎平杂边禾由贵州大学农业生物工程研究院收集并保存。大肠杆菌(Escherichiacoli)菌株DH 5 α、农杆菌(Agobacteriumtumefaciens)菌株EHA 105均由贵州大学农业生物工程研究院保存。带有CRISPR/Cas 9系统的BGK 030表达载体购自杭州百格生物技术有限公司。
1.2 主要药品试剂
各种基因克隆所需的内切酶和聚合酶等均购自TaKaRa公司(大连),卡那霉素(kanamycin,Kan)购自北京索莱宝公司,潮霉素(hygromycin,Hygr)购自德国Rochem试剂公司,其他分子生物学试剂为国产试剂。
1.3 靶位点选择及载体构建
在水稻基因组注释计划数据库(Rice Genome Annotation Project)中查找到水稻OsGA20ox2基因序列,根据水稻目标序列上游约19个核酸序列的特征(rotospacer adjacent motif,PAM)和Cas 9编辑系统的特点,识别目标序列的相邻原型区间序列,结合目标基因结构的保守性,在植物CRISPR在线靶位点设计数据库(http://cbi.hzau.edu.cn/cgi-bin/CRISPR)中设计适用于水稻OsGA20ox2基因定点突变sgRNA序列。靶点的特异性通过信息网站Cas-OFFinder(http://www.rgenome.net/cas-offinder/)和水稻基因组数据库(Rice Genome Annotation Project:http://rice.plantbiology. msu.edu/)比对序列进行验证。分析发现,这些靶位点不会或不易引起脱靶效应,即在基因组其他编码区域无相同或相似靶点,并且可以特异匹配目标位点。
本研究根据基因选择的高特异性gRNA靶点序列(加上PAM序列,红色标注)和靶点突变的测序引物见表1。引物全部由Invitrogen公司(美国)合成。

表1 实验所用引物序列
载体构建及验证参考黄小贞等[12]方法,化学合成sgRNA连接到CRISPR/Cas 9表达载体BGK 030上。
1.4 水稻成熟胚遗传转化
遗传转化参考张璠等[13]的方法,以含基因编辑系统的农杆菌菌液转化水稻愈伤组织,然后用含有100μg·mL-1潮霉素的筛选培养基进行抗性愈伤筛选;将生长状态良好的抗性愈伤组织挑取到分化培养基上进行组织分化,待苗长至3 cm时移至生根培养中诱导生根,最后将生根的抗性植株移栽至培养桶中培养。
1.5 转基因植株鉴定
参考王关林等[14]的方法,利用CTAB法提取抗性植株与野生型植株叶片基因组DNA,利用潮霉素抗性基因特异性引物(Forward:5′-CGAGAGCCTGACCTATTGCAT-3′,Reverse:5′-CTGCTCCATACAAGCCAACCAC-3′)对抗性植株进行PCR扩增,扩增反应条件为:94 ℃ 3 min→(94 ℃ 30 s,51 ℃ 30 s,72 ℃ 30 s)35次循环→72 ℃延伸7 min;14 ℃保存。扩增产物在1%琼脂糖凝胶电泳后进行检测。
1.6 转基因植株突变位点鉴定
利用CTAB法提取PCR检测呈阳性转基因植株及野生型叶片基因组DNA,利用靶位点基因特异测序引物(表2)进行PCR扩增后,回收扩增产物,送Invitrogen公司进行测序,分析靶位点的突变情况。

表2 OsGA20ox2基因编辑靶点测序引物
1.7 突变植株农艺性状测定
将突变的转基因植株种植后,收获T1代种子,2019年5月将突变株系CR 28号T1代种子种植于转基因植物示范基地,常规肥水管理,成熟期测定突变体农艺性状。
2 结果与分析
2.1 水稻OsGA20ox2基因编辑载体的构建
根据CRISPR/Cas 9系统的靶点设计要求,设计适用于水稻OsGA20ox2基因定点突变的sgRNA序列,将基因的gRNA靶点设计位于第一外显子区域内,以CCAGGTGTCCGAGCACGGCGTCG序列作为sgRNA序列。特异靶位点设计好后,将OsGA20ox2的gRNA序列连接到含有水稻U 6启动子的BGK 030载体上(图1),经过分子克隆,酶切验证无误后,导入农杆菌EHA 105。
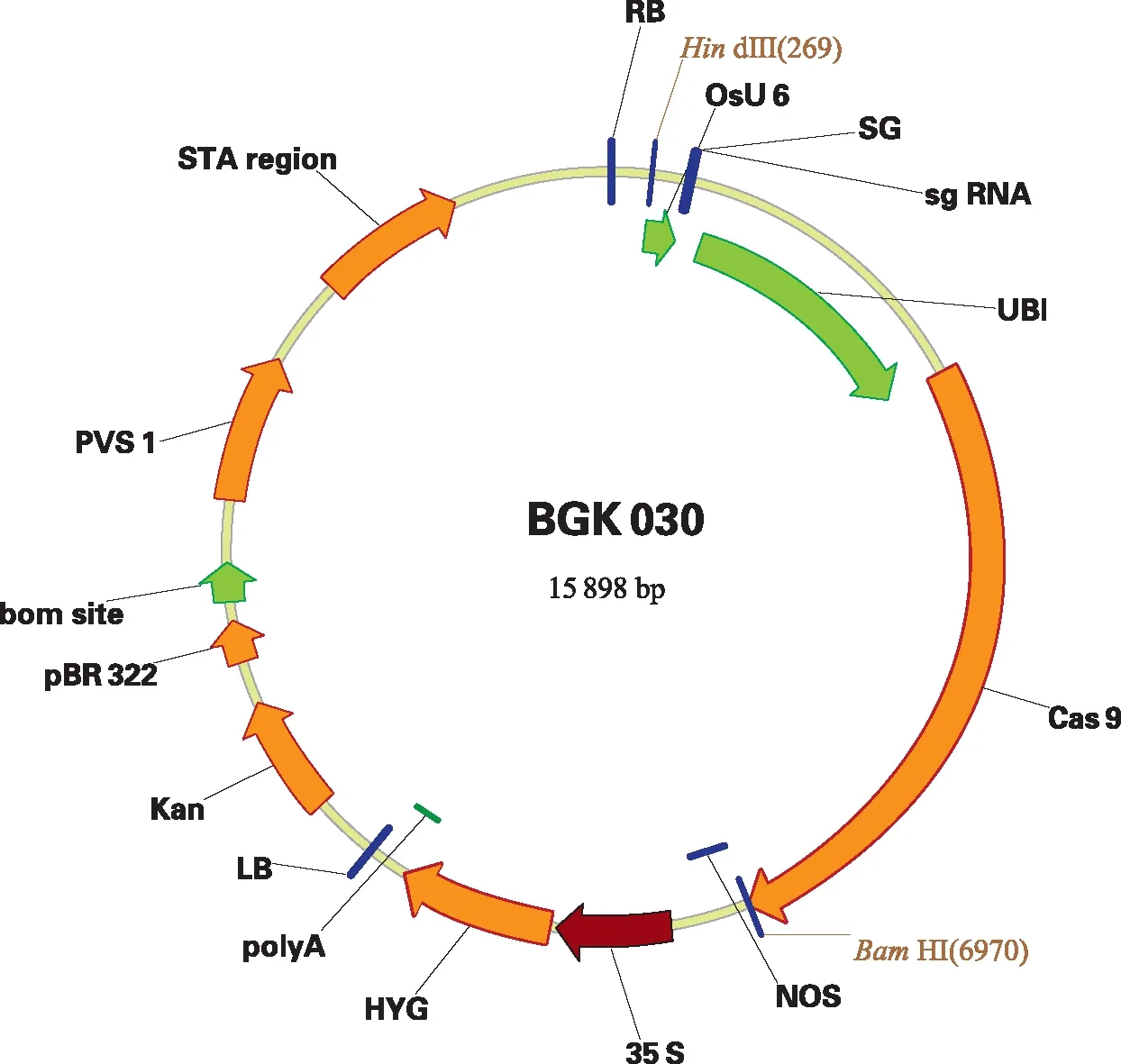
图1 OsGA20ox2基因编辑表达载体
2.2 转基因植株的获得
基因编辑载体经PCR、酶切和测序验证无误后转入农杆菌EHA 105菌株。以阳性农杆菌克隆的菌液侵染转化野生型黎平杂边禾的愈伤组织(图2 A),侵染之后,将愈伤组织转移到潮霉素筛选培养基上进行筛选培养(图2 B),筛选1个月后,将颜色鲜黄、直径1~2 mm的阳性愈伤挑取到分化培养基上进行分化培养(图2 C),待苗长至3 cm时移入生根培养基中进行生根培养(图2 D)。

注:A为愈伤组织继代培养;B为潮霉素培养基上筛选愈伤;C为分化培养基上分化培养25 d;D为生根获得转基因植株。图2 水稻遗传转化
对获得的抗性水稻植株进行DNA提取,利用潮霉素特异性引物进行PCR验证发现,转基因植株在481 bp左右有明显条带,阴性对照扩增无条带,初步证明基因编辑载体已经转入水稻,筛选获得16株PCR检测呈阳性的转基因植株。
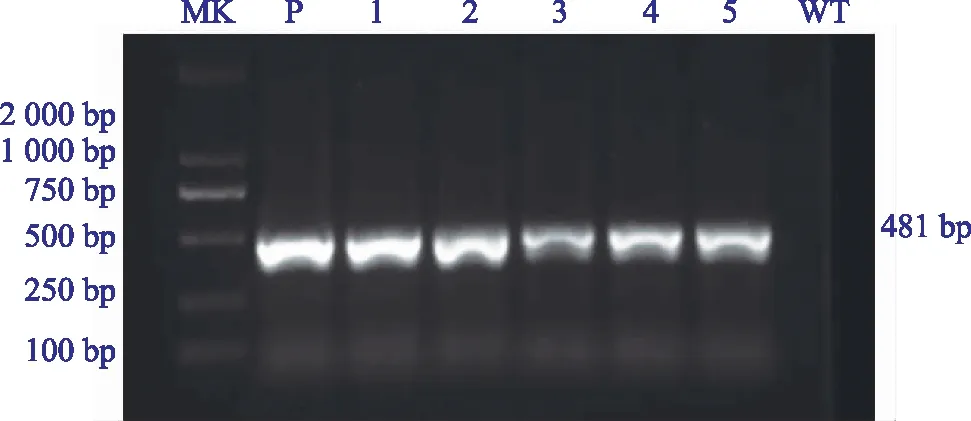
注:MK为DL 2000 MarKer;P为质粒;1~5为转基因植株,WT为阴性对照。图3 转基因植株的PCR鉴定
2.3 转基因植株突变位点分析
提取筛选获得的PCR检测呈阳性的转基因植株及野生型植株叶片DNA,利用OsGA20ox2基因包含靶点特异性测序引物进行PCR扩增,将获得的461 bp PCR产物进行回收及测序,分析靶点突变情况。在获得的16株转基因植株中,发现有7株在靶位点PAM(CCG)后的第5个碱基处开始发生了编辑(A 02-H 01)。其中A 02植株发生的3个碱基的缺失,B 02-H 01等6个植株发生了1个碱基插入和替换(图4)。说明基因编辑载体进入水稻,CAS 9蛋白在水稻OsGA20ox2基因靶位点的PAM位置第5个碱基开始发生了切割,使目的片段断裂引发基因修复、基因产生缺失或替换,从而导致OsGA20ox2基因结构发生变化。

注:WT为野生型植株;其余为转基因植株;黄色框CCG表明PAM位点。图4 转基因水稻OsGA20ox2基因突变位点分析
2.4 T1转基因植株农艺性状
种植于转基因水稻种植基地的突变体CR 28株系,植株株高明显低于野生型黎平杂边禾,但籽粒大小与野生型相比差异不明显(图5)。在水稻成熟期分别测量突变体植株及野生型植株的株高、有效分蘖数、剑叶长、剑叶宽、穗长、有效穗粒数等农艺性状。结果表明,突变体CR 28株系植株株高明显降低,平均株高为112.64 cm,比野生型降低29.6%,分蘖数、千粒重、剑叶长、剑叶宽及剑叶角与野生型相比差异不明显,但突变体植株穗长比野生型降低11.7%,突变体有效穗粒数比野生型降低34.3%(表3)。

表3 野生型黎平杂边禾与转基因黎平杂边禾农艺性状对比

注:A为成熟期水稻植株Bar=10 cm;B为水稻籽粒Bar=1 cm;C为水稻穗Bar=5 cm,其中WT为黎平杂边禾,CR 28为基因编辑植株。图5 利用基因编辑技术获得的半矮化贵州黎平杂边禾
3 讨 论
由于水稻株高过高产生的倒伏会使水稻品种结实率明显降低,限制了产量潜力的进一步挖掘[15]。OsGA20ox2基因定点突变会导致水稻体内活性GA合成受阻,活性GA含量下降,从而表现出不同程度矮化[16]。Qiao F等[17]利用RNAi技术抑制OsGA20ox2的表达,获得了半矮秆的水稻品种。然而RNAi技术本身存在一些缺点,RNAi技术通过降解靶基因的mRNA进行基因干涉,降低其表达水平,而非完全敲除靶基因的功能,同时,一些和靶基因序列相近的基因表达也可能会受到抑制[18]。特别是CRISPR/Cas 9技术的发展,使得RNAi技术在功能基因组学和作物分子育种领域的应用正迅速地被取代。Hu等[19]利用CRISPR/Cas 9技术对粳稻恢复系申繁17和申繁24进行SD1基因编辑,株高测定结果表明,CRISPR/Cas 9技术编辑后获得的半矮秆品种的株高与其野生型相比大约降低25%。结果表明,CRISPR/Cas 9技术是一种非常有效的水稻矮秆育种工具。
在本研究中,利用CRISPR/Cas 9基因编辑系统,获得7株OsGA20ox2基因突变的半矮化水稻新种质。通过对基因编辑后的突变植株的农艺性状进行研究,发现从7株突变植株中筛选的CR 28中随机挑选的16株T1代植株平均株高为112.64 cm,比相同条件下种植的野生型黎平杂边禾平均株高(160.00 cm)低29.6%,而转基因水稻的分蘖数、千粒重、剑叶长、剑叶宽及剑叶角与野生型相比差异不明显,但突变体植株穗长比野生型降低11.7%,突变体有效穗粒数比野生型降低34.3%,在随机挑选的16株突变体植株中存在穗长和与有效穗粒数无显著差异的植株,需要对后代突变体株系进行进一步筛选。由于突变体植株株高降低且抗倒伏,在贵阳田间可采取合理密植或者通过施肥来弥补穗粒数减少的情况。本研究获得的OsGA20ox2基因突变半矮化水稻新种质为CRISPR/Cas 9技术在水稻种质改良上的应用提供了研究资料,也为培育新的水稻矮杆种质提供了材料来源。
