铀胁迫对不同苔藓生长及抗氧化系统的影响
2020-10-09李俊柯杜家豪邓章轩罗中旭赖金龙罗学刚
李俊柯,杜家豪,邓章轩,罗中旭,赖金龙,2,罗学刚,2
(1.西南科技大学生命科学与工程学院,四川 绵阳 621010;2.西南科技大学生物质材料教育部工程研究中心,四川 绵阳 621010)
【研究意义】铀(Uranium,U)是一种具有高放射性和长半衰期的典型工业污染物[1],其作为一种天然放射性核素,在地壳中的平均含量为2×10-4%(WT),在岩石、土壤、水和生物体中平均含量约为4 mg/kg[2]。铀在自然界中有3种放射性同位素(U-234、U-235和U-238),其中U-238丰度最高(99.27%),半衰期达到4.51×109年[3]。由于人类活动,如采矿、磷酸盐加工、核工业和农业施肥,大量的铀被释放到环境中[4]。例如,铀尾矿和排放水中的铀浓度分别达到400~41 598、0.244-35.7 Bq/L[5]。研究表明,铀作为一种非必需和有毒的放射性核素,化学毒性风险高于辐射毒性风险,其通过食物链进入生物体,摄入时具有持续的化学毒性,因而对生物体和人类健康有极大的损害。
【前人研究进展】研究者根据铀在环境中的生物地球化学特性,开发了一些铀修复技术——物理、化学和生物技术[6]。其中,生物修复特别是植物修复,具有原位修复、应用方便、成本低等特点,是一种理想的修复方法。在植物修复中,铀积累植物如芸苔属[7]、向日葵[8]和黑麦草[9],都种植在铀污染地区,通过根从土壤中提取铀,铀能随时间从土壤中移除。然而,铀矿山一些裸岩、砂石地形土壤残存量少,大多数高等植物无法生长,成为铀矿山植物修复的难题。苔藓植物作为铀矿山生态修复的先锋植物,在生态系统中的广泛分布使其占有重要地位[10]。苔藓植物能适应土壤残存量少的地形,能在其他植物无法生存的铀矿山荒漠化、石漠化土地上生长,同时,加速岩石风化成土的过程,进一步导致岩石分解、土层增厚、有机质增加,具有较强的蓄水保水、水土保持及防风固沙能力,而且在改善土壤理化性质、提高土壤抗冲性及抗雨滴贱蚀等方面具有十分显著的作用[11]。因此,苔藓结皮对于铀矿山生物修复具有极大潜力。然而,铀往往对植物体有严重的毒害作用,有研究表明,铀已对植物造成明显的毒害症状,包括植物生长缓慢、根系坏死、降低光合速率等[12],从而大大降低铀矿山植物修复的效率。因此,研究苔藓植物对铀的耐受性及抗性机制,是评价苔藓结皮用于铀矿山生态修复可行性的关键。
【本研究切入点】为了探究铀对苔藓生长及抗氧化系统的影响,本研究选用3种易生长、耐旱、荒石漠化常见优势苔藓——大灰藓(Hypnum plumaeforme)、大灰藓小型变种(Hypnum cupressiformeL.ex Hedw.var.cupressiforme)、砂藓(Racomitrium canescensHedw.)作为研究对象。采用条件易控、环境误差小的溶液培养法处理苔藓植物。【拟解决的关键问题】观察铀胁迫对苔藓生长的影响,测定苔藓铀的累积量,阐明苔藓抗氧化系统对铀胁迫的适应机制,评价苔藓植物对铀的耐受性,为铀矿山苔藓结皮生态修复提供一定的参考依据。
1 材料与方法
1.1 试验材料
选用大灰藓、大灰藓小型变种、砂藓作为供试材料,采集于西南科技大学路旁树荫下、水渠边及山坡上,采集后选取生长良好、长势基本一致的苔藓,用去离子水培养3 d,待生长正常且生长状况基本相同时进行铀胁迫处理。
1.2 试验方法
根据苔藓对铀污染的敏感性,铀胁迫浓度设置为0(对照)、5、10、15、20 μmol/L。铀源使用硝酸铀酰(238U,UO2(NO3)2·6H2O),以1/2霍格兰营养液配制含铀处理液(pH=5.5)。铀胁迫处理72 h后,记录苔藓植株生长状态,测定不同铀浓度处理3种苔藓可溶性蛋白、游离脯氨酸(Pro)、丙二醛(MDA)含量,过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)活性以及苔藓中铀含量。1/2霍格兰营养液成分包括:101.1 mg/L KNO3,236.15 mg/L Ca(NO3)2·4H2O,98.59 mg/L MgSO4·7H2O,16.01 mg/L NH4NO3,13.61 mg/L KH2PO4,铁盐溶液(1.345 mg/L Na2-EDTA和1.112 mg/L FeSO4·7H2O),以及微量元素(含0.569 mg/L H3BO3、0.356 mg/L MnCl2·4H2O、0.043 mg/L ZnSO4·7H2O、0.01 mg/L CuSO4·5H2O、0.018 mg/L H2MoO4·H2O),pH值为5.5。人工气候箱培养条件为:温度25 ℃,空气相对湿度80%~85%,光照强度为3 500 lx,光照时间12 h。
1.3 苔藓生长及铀含量分析
铀胁迫处理后,采集苔藓叶片,选取长势一致的苔藓植株,用滤纸擦干植株表面水分,采用数码显微镜对苔藓植物茎尖与假根进行拍照,观察铀处理后苔藓植物的生长状况。
铀含量测定:样品85℃烘干至恒重,用微型植物粉碎机将样品粉碎并过孔径0.075 mm样品筛,每个样品取0.25 g,重复3次,采用Niton XL3 X射线荧光分析仪测定铀含量。
1.4 逆境生理指标分析
可溶性蛋白含量采用考马斯亮蓝法(G-250)[13]测定,Pro含量采用3%磺基水杨酸法[14]测定,MDA含量采用硫代巴比妥酸(TBA)显色法[14]测定。
SOD、POD、CAT活性采用南京建成生物工程研究所生产的试剂盒处理。酶粗液个提取方法如下:将采集后的植株编号,每个处理取0.1 g鲜叶片于预冷的研钵中,加入0.1 mol/L冷磷酸缓冲液(pH=7.0)1 mL和少量石英砂,冰浴研磨,匀浆后用0.01 mol/L冷磷酸缓冲液(pH=7.0)5 mL冲洗,并转移至离心管,3 500 r/min离心10 min,上清液即为酶粗提取液,将酶液转移至试管,4℃冷藏保存,备用。将处理后的酶粗液按各试剂盒说明书操作表要求分别测定SOD、POD和CAT活性。
生物富集系数(BCF)[15]=植物干物质中重金属含量(mg/kg,DW)/重金属浓度(mg/kg,DW)
试验数据采用SPSS 20.0 软件进行差异显著性分析,采用Excel软件及Origin 2017制图,不同处理间的方差分析采用二因素有重复实验分析方法,多重比较采用Tukey多重比较法。
2 结果与分析
2.1 不同苔藓生长状态及铀累积特性分析
由图1可见,铀胁迫72 h后,3种苔藓植物受到不同程度的铀毒害。空白对照大灰藓呈绿色,茎尖呈阔披针形,叶缘平展宽大,假根粗大,呈黑色或褐色。大灰藓茎尖在低浓度(5 μmol/L)铀胁迫下无明显变化;而在中高浓度(10~20 μmol/L)铀胁迫下,茎尖颜色渐黄;当铀浓度达到20 μmol/L时,其茎尖呈黄褐色,叶缘萎缩偏小,假根在铀胁迫下无明显变化。空白对照大灰藓小型变种植物体呈绿色,枝叶与茎叶同形,外展细小,假根细小,呈黑褐色,其茎尖在高浓度(15~20 μmol/L)铀胁迫下由绿色逐渐变黄,茎叶收缩,与空白对照相比变小,其假根在铀胁迫下无明显差异。空白对照砂藓中肋较粗,突出叶尖成绿色毛状刺,假根呈黑色。砂藓茎尖在铀浓度为5~15 μmol/L胁迫下变化不明显,而在铀浓度为20 μmol/L时茎尖颜色变黄变黑,假根无明显差异。
如图2所示,随着铀浓度的增加,3种苔藓植物体内铀累积量均显著上升,铀累积能力表现为大灰藓小型变种>大灰藓>砂藓。当铀处理浓度为20 μmol/L时,3种苔藓铀累积量分别为3 440.67、2 410.67、906.33 mg/kg(DW)。由表1可知,大灰藓BCF最大值出现在铀浓度5 μmol/L时,为0.37;大灰藓小型变种BCF最大值出现在铀浓度20 μmol/L时,为0.43;砂藓BCF随铀浓度增大而减小,最大值出现在铀浓度5 μmol/L时,为0.25。结果表明,大灰藓小型变种对铀有较强的富集能力,而砂藓对铀的富集能力较弱。

图1 铀胁迫下3种苔藓生长局部状况Fig.1 Growth of three bryophytes under uranium stress
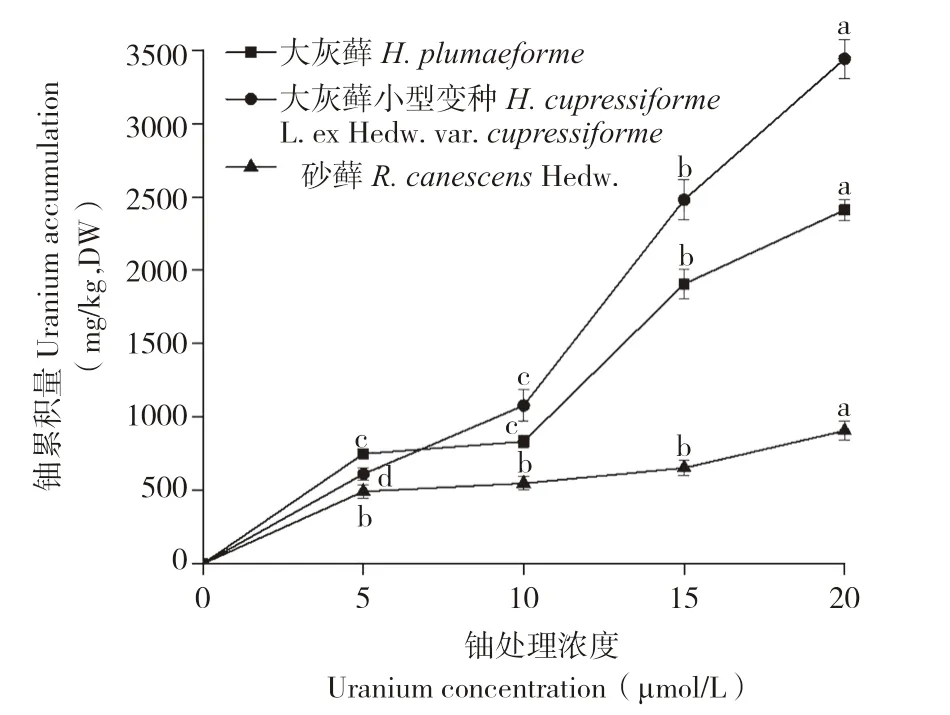
图2 3种苔藓对铀的累积特性Fig.2 Accumulation characteristics of Uraniun in three bryophytes
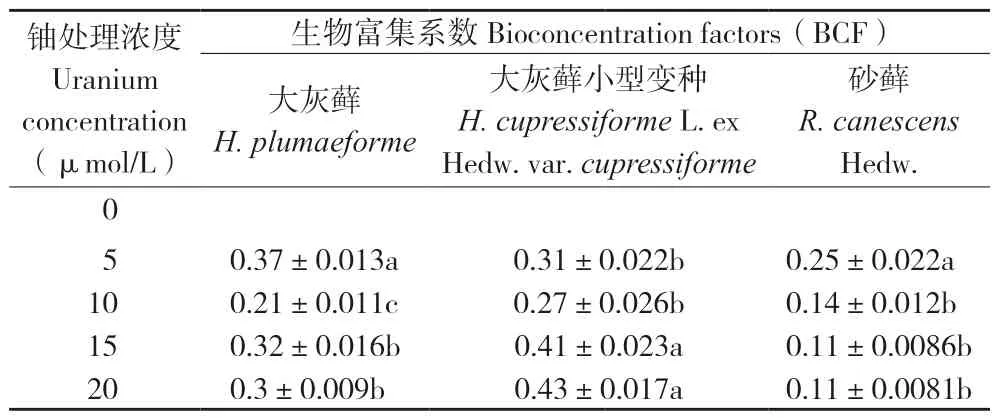
表1 不同浓度铀处理苔藓生物富集系数Table 1 BCF of bryophytes under different concentrations of uranium
2.2 铀胁迫对苔藓植物可溶性蛋白含量的影响
可溶性蛋白是重要的渗透调节物质和营养物质,能衡量植物是否受到重金属胁迫。图3结果显示,3种苔藓可溶性蛋白含量随铀浓度的增加均表现为“低促高抑”。大灰藓可溶性蛋白含量在铀浓度为15 μmol/L时达到最大值,为13.05 mg/g(FW),且不同浓度梯度其可溶性蛋白含量存在显著差异。大灰藓小型变种可溶性蛋白含量在铀浓度为10 μmol/L时达到最大值(10.7 mg/g,FW)。砂藓可溶性蛋白含量在铀浓度为10 μmol/L时达到最大值,为14.84 mg/g(FW)。结果表明,低浓度铀胁迫促进苔藓植物可溶性蛋白合成,高浓度铀胁迫使其可溶性蛋白合成受到抑制。
当植物体受到逆境胁迫时,可通过积累脯氨酸来提高植物的耐逆性。由图4可知,铀胁迫使3类苔藓植物体内游离脯氨酸含量产生了显著变化。对大灰藓而言,铀浓度与其游离脯氨酸含量呈正相关,铀浓度为0~10 μmol/L时,其对应脯氨酸含量无显著差异,而在铀浓度为10~20 μmol/L时,其对应脯氨酸含量存在显著差异。对大灰藓小型变种,随着铀浓度增加,其脯氨酸含量先增大后减小,在铀浓度为15 μmol/L时达到最大值(9.88 μg/g,FW)。砂藓植物体内游离脯氨酸含量随铀浓度增加呈现先升后降的趋势,在铀浓度为10 μmol/L时达到最大值、为7.12 μg/g(FW)。结果表明,在铀胁迫下,细胞内会产生脯氨酸来调节细胞渗透平衡,抑制铀进入细胞中。而高浓度的铀对苔藓植物产生严重的毒性现象,破坏其细胞结构,抑制蛋白质合成,使得植物体内无法大量产生脯氨酸,导致其含量降低。
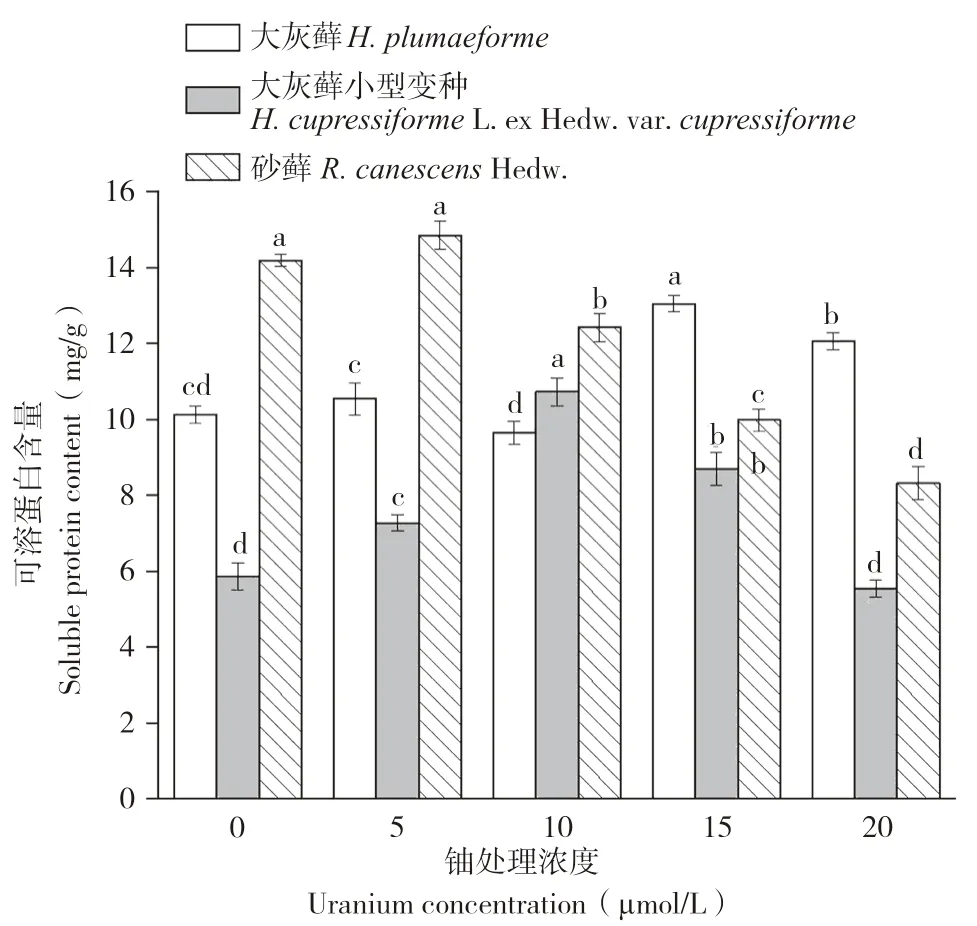
图3 铀胁迫对3种苔藓可溶性蛋白含量的影响Fig.3 Effects of uranium stress on soluble proteins in three bryophytes
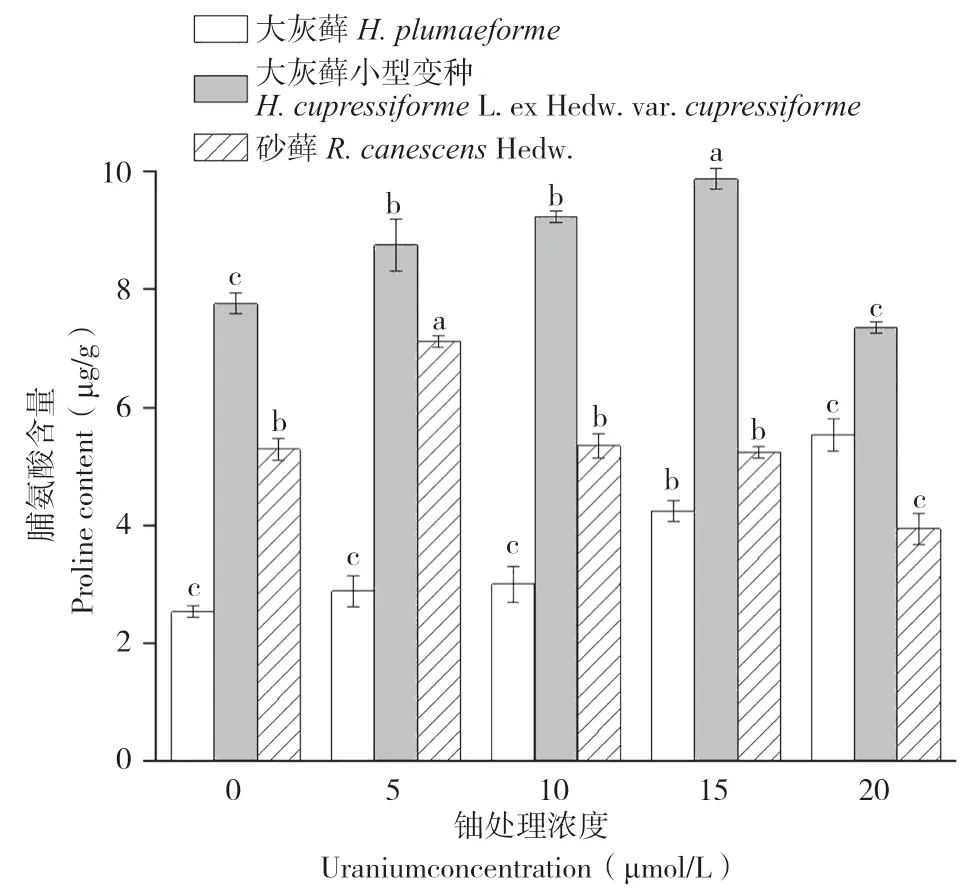
图4 铀胁迫对3种苔藓脯氨酸含量的影响Fig.4 Effects of uranium stress on proline contents in three bryophytes
2.3 铀胁迫对苔藓植物MDA含量的影响
丙二醛(MDA)是细胞膜脂过氧化反应的产物,植物中MDA含量的多少说明植物细胞膜受到伤害的程度。从图5可以看出,3种苔藓植物体内MDA含量均随铀胁迫浓度的增加逐渐增大。方差分析表明,大灰藓MDA含量在各铀浓度0~10 μmol/L和15~20 μmol/L处理间存在显著差异,而在10~15 μmol/L间不存在显著差异。而大灰藓小型变种与砂藓MDA含量在各铀浓度处理间0~10 μmol/L不存在显著差异,而在10~20 μmol/L间存在显著差异。结果表明,大灰藓对于低浓度铀胁迫反应快于大灰藓小型变种与砂藓。
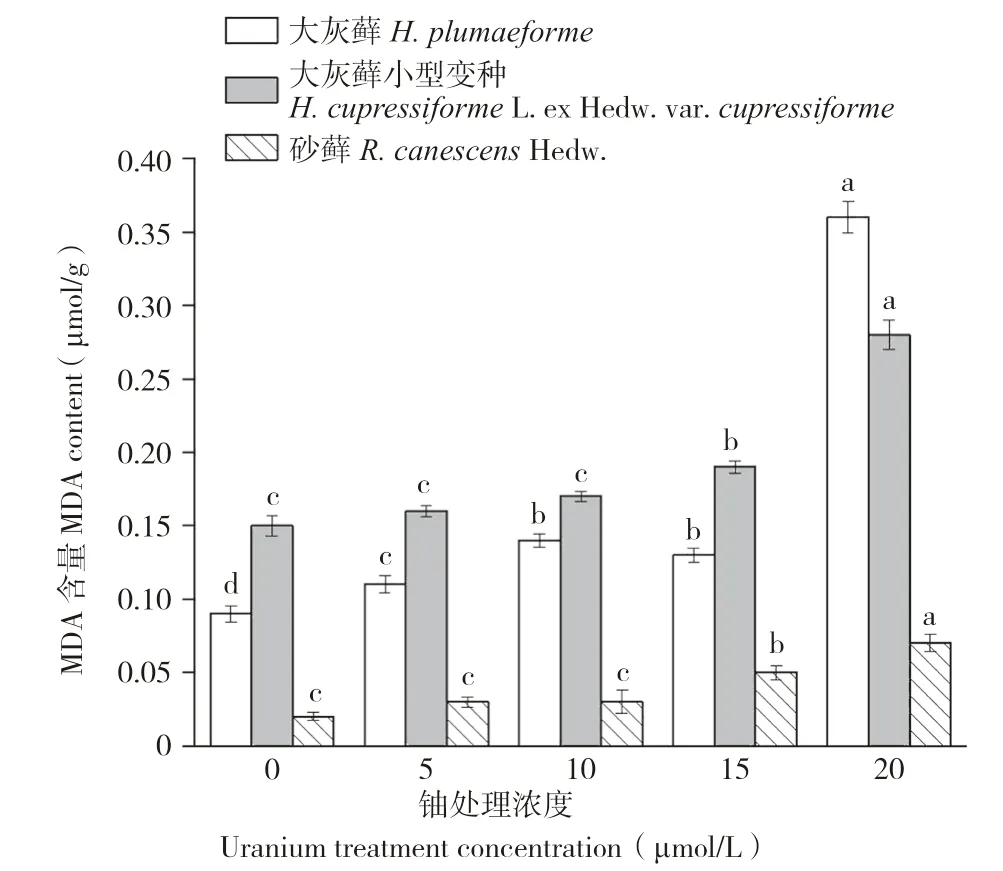
图5 铀胁迫对3种苔藓MDA含量的影响Fig.5 Effects of uranium stress on MDA contents in three bryophytes
2.4 铀胁迫对苔藓植物抗氧化酶系统的影响
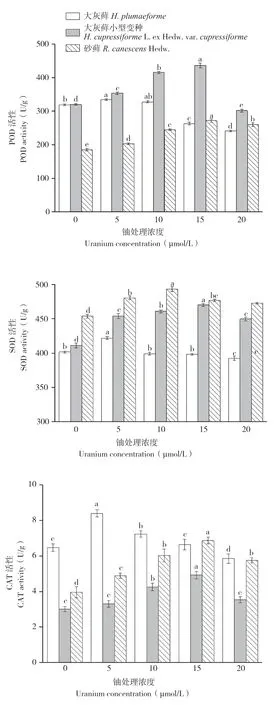
图6 铀胁迫对3种苔藓POD、SOD、CAT活性的影响Fig.6 Effects of uranium stress on activities of POD,SOD and CAT in three bryophytes
过氧化物酶(POD)作为活性氧酶促清除系统的重要酶类,能有效清除植物体内过氧化氢。结果(图6)显示,随着铀浓度的增加,3种苔藓的POD活性先增大后减小。大灰藓在铀浓度为5 μmol/L时POD活性达到峰值,为334.42 U/g(FW),各浓度处理间均差异显著。大灰藓小型变种在铀浓度为15 μmol/L时POD活性达到峰值,为436.29 U/g(FW)。砂藓在浓度为15 μmol/L时POD活性达到峰值,为271.75 U/g(FW)。SOD也是一种抗氧化保护酶。由图6可见,随着铀浓度水平的升高,3种苔藓 SOD活性呈现先增后降的趋势。大灰藓在浓度为5 μmol/L时 SOD活性达到峰值,为421.75 U/g(FW),各浓度处理间均差异显著。大灰藓小型变种在铀浓度为15 μmol/L时 SOD 活性达到峰值,为470.05 U/g(FW),各浓度处理间均差异显著。砂藓在铀浓度为10 μmol/L时SOD活性达到峰值,为493.06 U/g(FW),铀处理浓度在10~15 μmol/L间SOD活性无显著差异,其余各处理间均差异显著。随着铀浓度的升高,3种苔藓CAT活性呈现先增后降的趋势。大灰藓在铀浓度为5 μmol/L时CAT活性达到峰值,为8.40 U/g(FW),各浓度处理间差异显著。大灰藓小型变种在铀浓度为15 μmol/L时CAT 活性达到峰值,为4.92 U/g(FW),铀处理浓度在0~5 μmol/L间CAT活性无显著差异,其余各处理间差异显著。砂藓在铀浓度为15 μmol/L时CAT活性达到峰值,为6.86 U/g(FW),各浓度处理间差异均显著。结果表明,3种苔藓植物在铀胁迫下其抗氧化系统应答表现为低促高抑,且大灰藓小型变种对铀胁迫具有较强的耐受性。
3 讨论
铀胁迫对3种苔藓植物的毒害作用主要表现在高浓度时使其茎叶变黄变黑,并阻碍茎叶生长发育,其茎叶与空白对照相比变小,出现不同程度的萎缩现象。假根在铀胁迫下无明显变化,可能是因为苔藓植物主要依靠叶片吸收养分,对环境变化较为敏感,而假根主要起固定植物体的作用,极少进行物质交换。苔藓植物对铀有一定的累积能力,且3种苔藓植物体内铀累积量与外源铀浓度呈正相关。富集系数(BCF)是指植株体内元素含量与环境元素含量之比,其值越大,则表明植物吸收能力越强。赵继武等[9]研究了黑麦草的铀富集特性,其BCF最高可达6.28,刘泽伟等[16]研究了蚕豆幼苗的铀累积特性,在铀浓度为25 μmol/L处理下其地下部铀累积量可达5 309 mg/kg(DW)。韩旭等[17]研究水芹和铜钱草对铀的富集浓度在55 mg/L处理下根、茎和叶各部铀浓度分别达到3637.2、322.9、373.4 mg/kg和2 908.8、262.7、136.5 mg/kg。本试验中,不同种类苔藓的铀累积能力有显著差异,其中累积能力最强的大灰藓小型变种,在铀浓度为20 μmol/L时为3 440.67 mg/kg(DW),BCF仅0.43。可见,苔藓植物对铀的累积能力不及某些超富集植物,原因可能为苔藓植物生物量较小,且极少通过假根进行物质交换。然而,在实际铀矿山生态修复中,大多数铀富集能力强的高等植物无法被种植在土壤残存量较少的贫瘠荒、石漠化土地上,只能依靠苔藓作为先锋植物,首先覆盖在工程创面或铀矿裸岩之上,使岩石风化成土,进一步导致岩石分解、土层增厚、有机质增加,为高等植物提取铀创造先决条件。本试验中,大灰藓小型变种对铀有一定的累积能力和耐受性,有联合超富集植物修复铀矿山贫瘠石漠化土地的潜力。
重金属离子能与植物体内其他化合物结合成金属络合物或螯合物,抑制蛋白质的合成[18]。3种苔藓可溶蛋白含量显著性变化表明,铀胁迫扰乱了苔藓植物体内蛋白质的合成。低浓度铀溶液引起可溶性蛋白含量增加可能是植物抗铀的解毒机制,其可以提高细胞的渗透浓度和功能蛋白的数量,有助于维持细胞正常代谢。然而,高浓度的铀对蛋白质合成有破坏性影响。首先,铀进入细胞后,提高了蛋白水解酶的活性,促进了原有蛋白质的分解。其次,铀对许多蛋白质合成酶系统具有毒性和纯化作用,破坏蛋白质合成的相关细胞器,抑制新蛋白质的合成。脯氨酸作为非酶抗氧化剂中的重要水溶性化合物,在植物体中不仅能起渗透调节作用,还能清除活性氧[19-20],通过抗氧化系统的协同作用精密地调控植物细胞中活性氧的平衡[21]。此外,Kaul等[14]认为,重金属胁迫能引起植物体内脯氨酸的快速累积,还可诱导GSH水平的上升,从而进一步增强抗氧化能力。本试验中,大灰藓小型变种与砂藓脯氨酸含量随着铀胁迫浓度的上升表现为“低促高抑”。当外源添加铀胁迫时,苔藓植物自身启动抗逆生理反应以抵抗重金属毒性的伤害,因此脯氨酸含量上升;当铀胁迫浓度不断升高,苔藓植物脯氨酸含量有所下降,表明其细胞结构遭到严重破坏,已无法累积脯氨酸。而大灰藓脯氨酸含量与铀胁迫浓度呈正相关,其原因可能是大灰藓对铀胁迫的耐受性强于大灰藓小型变种和砂藓,且累积脯氨酸能力较强,在铀浓度为20 μmol/L时其细胞结构并没有被严重破坏,仍能正常累积脯氨酸以抵抗重金属胁迫。MDA含量的测定往往能反映机体脂质过氧化水平,间接反映细胞损伤程度[22]。本试验中,3类苔藓植物体内MDA含量均与铀浓度呈正相关,表明膜脂过氧化程度加剧,细胞膜透性也逐渐增加,细胞膜透性越大表明细胞内含物流失越严重,细胞损伤程度越大。林喆[23]研究了齿肋赤藓在不同浓度Hg胁迫下MDA含量的变化,结果表明Hg浓度与齿肋赤藓的脯氨酸含量呈正相关。孙天国等[24]研究了(Zn2+、Cu2+、Pb2+和Cd2+)溶液对东亚砂藓和拟垂枝藓MDA含量的影响,结果表明MDA含量具有应激效应。本研究结果与前人相似。铀胁迫类似于其他形式的氧化胁迫,能导致植物体产生大量自由基,这些自由基对植物细胞膜有损害作用[25]。植物体能自身形成一种保护系统来清除自由基以减轻危害[26]。这套保护系统由抗氧化保护酶类和非酶抗氧化保护剂组成。SOD、POD、CAT是3种尤为重要的抗氧化保护酶。其中SOD能维持机体的氧化与抗氧化平衡,能清除超氧阴离子自由基(O2-·)保护细胞免受损伤;POD能清除植物细胞中的活性氧,是植物体内清除H2O2的关键酶[27];CAT能够促进H2O2迅速分解为分子氧和水,广泛存在于植物细胞中[28]。三者联合作用以清除植物体内产生过量的自由基和过氧化物[29]。一般而言,植物对铀胁迫产生响应通常表现为低浓度刺激正向应答,高浓度产生抑制作用[30]。本试验中3类苔藓植物抗氧化保护酶活性的变化证实这点,大灰藓、大灰藓小型变种、砂藓的SOD、POD、CAT活性均随着铀处理浓度的增加呈现先升高后降低的趋势,说明低浓度铀胁迫时,苔藓植物开启抗氧化保护系统,清理多余的自由基和过氧化物,保护细胞免受损伤,而高浓度的铀破坏了苔藓植物抗氧化系统的动态平衡,植物受到过氧化毒害加剧,抗氧化系统机能减缓。本试验中大灰藓抗氧化保护酶活性在铀浓度为5 μmol/L时达到峰值,随后随着铀浓度增加活性降低。大灰藓小型变种与砂藓的抗氧化保护酶活性在铀浓度为15 μmol/L时达到峰值,然后随铀浓度增加活性降低,表明大灰藓小型变种和砂藓对铀胁迫的耐受性优于大灰藓。
本研究结果表明,铀对苔藓植物茎叶产生了显著的毒性现象。中低浓度(5~10 μmol/L)铀胁迫对3类苔藓植物可溶性蛋白、脯氨酸含量的累积有一定的促进作用,高浓度(15~20 μmol/L)铀胁迫对其有显著破坏作用。3类苔藓MDA含量随着铀浓度的增加显著上升,3类苔藓抗氧化酶活性均表现为低浓度(5~10 μmol/L)刺激正向应答,高浓度(15~20 μmol/L)产生抑制作用。3种苔藓对铀有一定的累积能力,铀累积能力表现为大灰藓小型变种>大灰藓>砂藓。可见,苔藓植物在一定范围铀浓度胁迫下能通过激活抗氧化保护机制作出应答,以抵抗铀毒性的伤害,对铀有一定的耐受性,同时大灰藓小型变种对铀的富集能力较好,虽然不及一些超富集植物,但是将苔藓植物作为铀矿山荒石漠化地区生物修复的先锋植物,联合超富集植物进行原位修复是可行的,具有较好的应用前景。
4 结论
铀胁迫对苔藓植物生长发育有一定的毒害作用,表现为茎叶发黄发黑、植物体萎缩。3种苔藓对铀的累积能力不及某些超富集植物,因此不能替代超富集植物从土壤中提取铀,但在铀矿山荒石漠化地区中能作为先锋植物,加速裸岩风化、增厚土层,搭配超富集植物联合修复含铀矿土。中低铀浓度下苔藓植物通过调节抗氧化保护系统以抵抗铀胁迫,这种应答在高浓度铀胁迫下随着铀毒性加强,细胞结构被破坏而受到抑制。其中,大灰藓对铀胁迫的敏感性高于大灰藓小型变种与砂藓,可作为铀污染指示植物。大灰藓小型变种表现出一定的耐铀能力和富集能力,有用于铀矿山苔藓结皮-超富集植物联合修复的潜力。
