氨基化离子液体[NH2-Pmim][BF4]与乙腈二元体系的热力学性质研究
2020-10-09张庆国杨蕙歌
张庆国,邸 阳,杨蕙歌
(1.渤海大学 化学化工学院,辽宁 锦州121013;2.渤海大学 新能源学院,辽宁 锦州121013)
0 引言
随着环境污染问题不断加重,化石燃料的不断减少,环境问题越来越值得重视,丞待解决,因此,绿色化学的研究具有重要的实际意义[1].在此背景下,室温离子液体作为一种极具潜力的绿色溶剂被众多研究者广泛研究.与其他固液体材料、常见电解质相比,离子液体熔点非常低,电化学窗口较宽,化学稳定性和热稳定性良好,几乎无蒸气压[2].这使得它们可能是理想的溶剂和电解质.
基于前期工作[3-4],我们选择了一种新型离子液体1-氨丙基-3-甲基咪唑四氟硼酸盐,并将其与乙腈混合,配制成了全浓度范围的二元混合体系[NH2-Pmim][BF4]+ACN,测定了288.15 K~333.15 K温度范围内混合体系的密度、电导率等热力学性质.通过VFT方程和Arrhenius方程对[NH2-Pmim][BF4]+ACN混合体系的电导率随温度的变化趋势进行了描述.根据实验密度值及经验方程[5]估算了该体系的超额摩尔体积VE并讨论了二元体系内部的相互作用情况.
1 实验部分
1.1 主要试剂与仪器

表1 主要化学试剂
表2 实验仪器
1.2 [NH2-Pmim][BF4]离子液体的表征
采用红外光谱法对所合成的[NH2-Pmim][BF4]离子液体进行了表征,红外光谱图见图1,离子液体的特征官能团所对应的红外峰归属见表3.

表3 [NH2-Pmim][BF4]离子液体的红外归属
对所合成离子液体还进行了核磁共振氢谱的表征,核磁共振光谱图见图2,其化学位移见表4.由图2和表4可以看出,所合成离子液体无明显的杂质峰,表明其纯度较高.

表4 [NH2-Pmim][BF4]离子液体的核磁位移
1.3 [NH2-Pmim][BF4]离子液体二元体系的配制
[NH2-Pmim][BF4]+ACN离子液体二元体系的配制采用了重量法,其中[NH2-Pmim][BF4]的摩尔分数xIL为0,0.1001,0.2005,0.3000,0.3990,0.4996,0.5980,0.6975,0.7983,0.8987,1.
1.4 热力学性质的测定
1.4.1 密度
离子液体的热力学性质中最为重要的性质就是密度[6].离子液体的密度的大小一般与温度和阴阳离子的体积有关[7]. 使用梅特勒-托利多DM45型密度计,在288.15 K~333.15 K之间,每间隔5 K,对[NH2-Pmim][BF4]离子液体密度进行了测定.密度计的精确度为0.00001 g·cm-3.
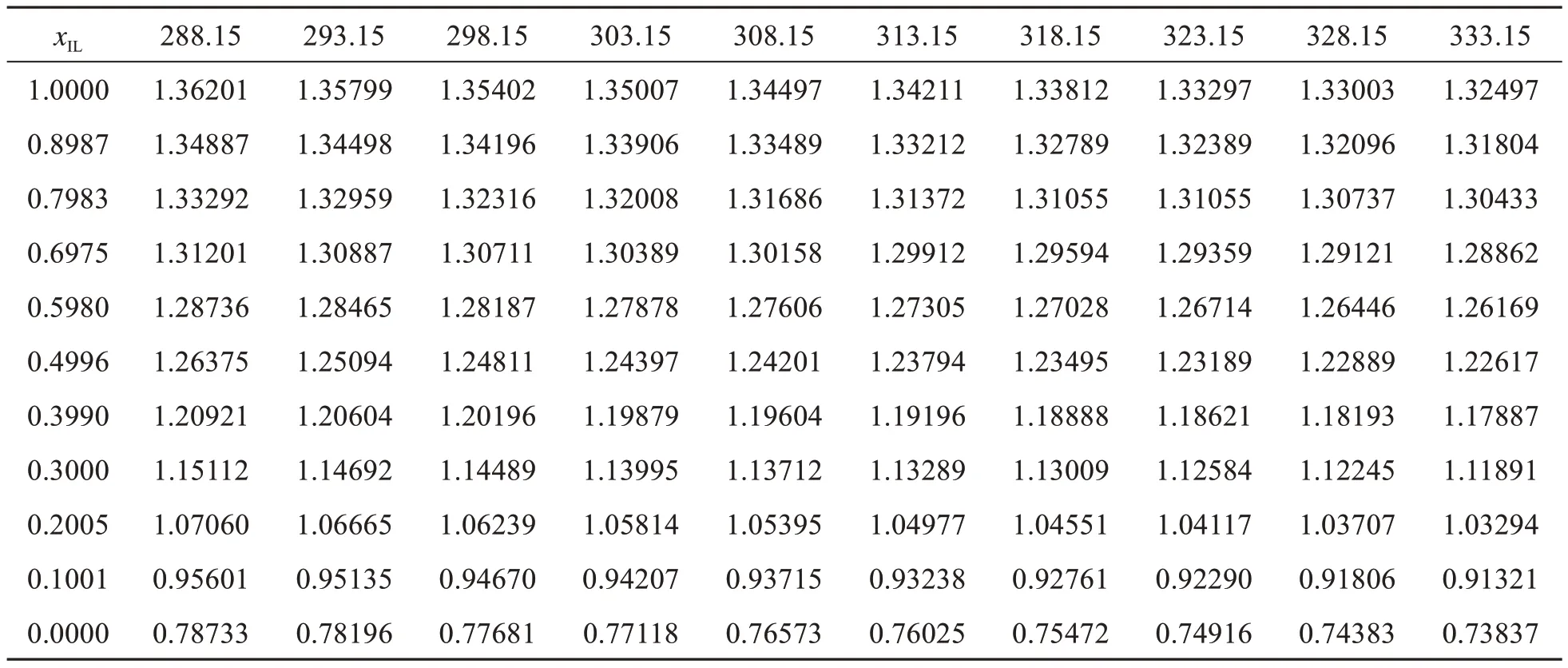
表5 [NH2-Pmim][BF4]+ACN二元体系的密度实验值(ρ,g·cm-3)
1.4.2 电导率
离子液体的导电性能比传统的有机电解液更加优异[8-11],有望替代传统有机电解液成为新型电解液,广泛应用于电化学中.[NH2-Pmim][BF4]+ACN体系的电导率值使用DDSJ-308A型电导率仪(DJS-10C电极)进行测定.使用低温恒温循环器进行温度控制,测温范围为288.15~333.15 K,间隔5 K,实验在充满氮气的手套箱中进行.
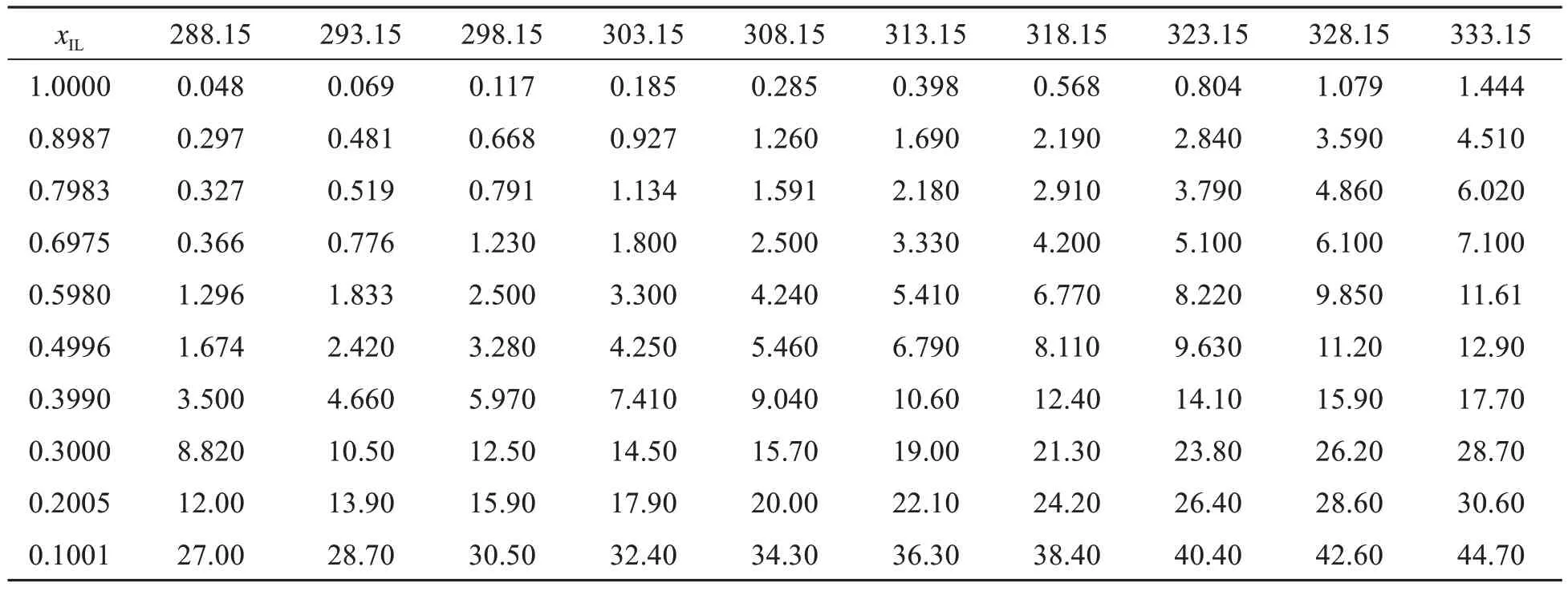
表6 [NH2-Pmim][BF4]+ACN二元体系的电导率实验值(σ,mS·cm-1)
2 结果和讨论
2.1 体积性质
离子液体二元体系的密度与温度的变化关系如图3a,随温度的升高,各组分的密度值均随之减小,主要原因是分子的热运动随温度的升高而加快,增大了分子间的距离,体积随之增大而使密度减小,符合密度与温度变化的规律[12].在同一温度下,密度随着[NH2-Pmim][BF4]摩尔分数的增加而增大,这是因为[NH2-Pmim][BF4]的增加使离子液体与溶剂间的相互作用增强引起的.
超额摩尔体积(VE)可以很好的解释二元体系内部的相互作用,为了进一步了解[NH2-Pmim][BF4]与ACN之间的相互作用,根据二元体系的密度值,使用公式(1)可以计算出二元体系的VE值:
其中x1是离子液体的摩尔分数,x2是溶剂的摩尔分数;离子液体的分子量用M1表示,ACN的分子量用M2表示;ρ1是离子液体密度,ρ2是ACN密度,ρ1,2是二元体系的密度;二元体系的VE值列于表7中.
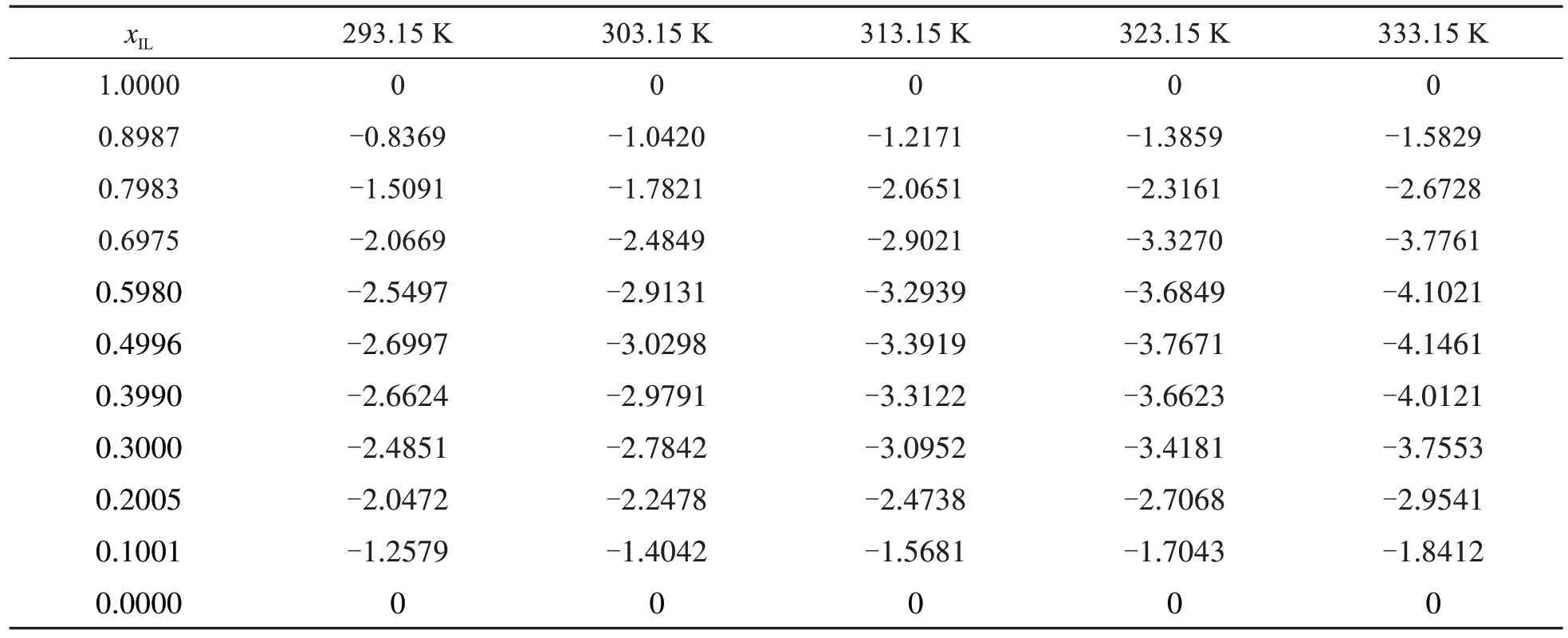
表7 二元体系在不同温度下的超摩尔体积VE(cm3·mol-1)
由图3b可知,在此二元体系的VE值均为负值,说明离子液体与ACN之间存在有效的体积堆叠和离子偶极作用,而阴离子具有很高的负电荷,离子基团电负性强,电子云密度较高,更容易与溶剂作用产生氢键.而且VE值随着温度的升高而逐渐增大,加入ACN后,二元体系的VE值先减小后增大,在xIL≈0.5时VE出现极小值,这种趋势与许多其它的二元体系相同[13].
2.2 电导性质
离子液体二元体系电导率的研究是其电化学应用研究的基础,其中温度及浓度是影响离子液体二元体系电导率的两个主要因素,如何描述温度及浓度的变化与电导率大小之间的关系是非常重要的.图4所示为[NH2-Pmim][BF4]+ACN二元混合体系电导率与温度之间的关系.从图4可以看出温度升高全浓度体系的电导率增大.温度一定时,加入溶剂,混合体系的电导率不断增大,溶剂分子的加入使混合体系粘度减小,进而导致电导率增大.[14-15]
二元体系的电导率随温度变化的关系可通过如下VFT方程来描述
其中D表示电导率;R2表示拟合相关系数;ED,D0,和T0均为可调节参数,拟合数值在表8中,所有的R2均>0.9997,这说明VFT 方程可以用来描述二元体系的电导率与温度的变化关系[16].

表8 Vogel-Fulcher-Tamman方程的电导率拟合参数
除了VFT方程,二元体系的电导率与温度之间的关系也可用Arrhenius方程来描述,方程如下:
其中σ∞为可调节参数;R为气体常数;Eσ为电导率活化能;表9为Arrhenius方程的拟合参数值.
图5为采用Arrhenius方程描述的电导率与温度的变化关系图,即lnσ vs1000/T图,lnσ与1/T成线性关系,不同温度下的电导率值均分布在Arrhenius方程的直线上,相关系数R2值均大于0.95,说明电导率随温度变化的大体趋势符合Arrhenius方程.比较同一条件下Arrhenius方程与VFT方程的R2值,得出VFT方程更适合描述离子液体电导率随温度变化的趋势[17-18].
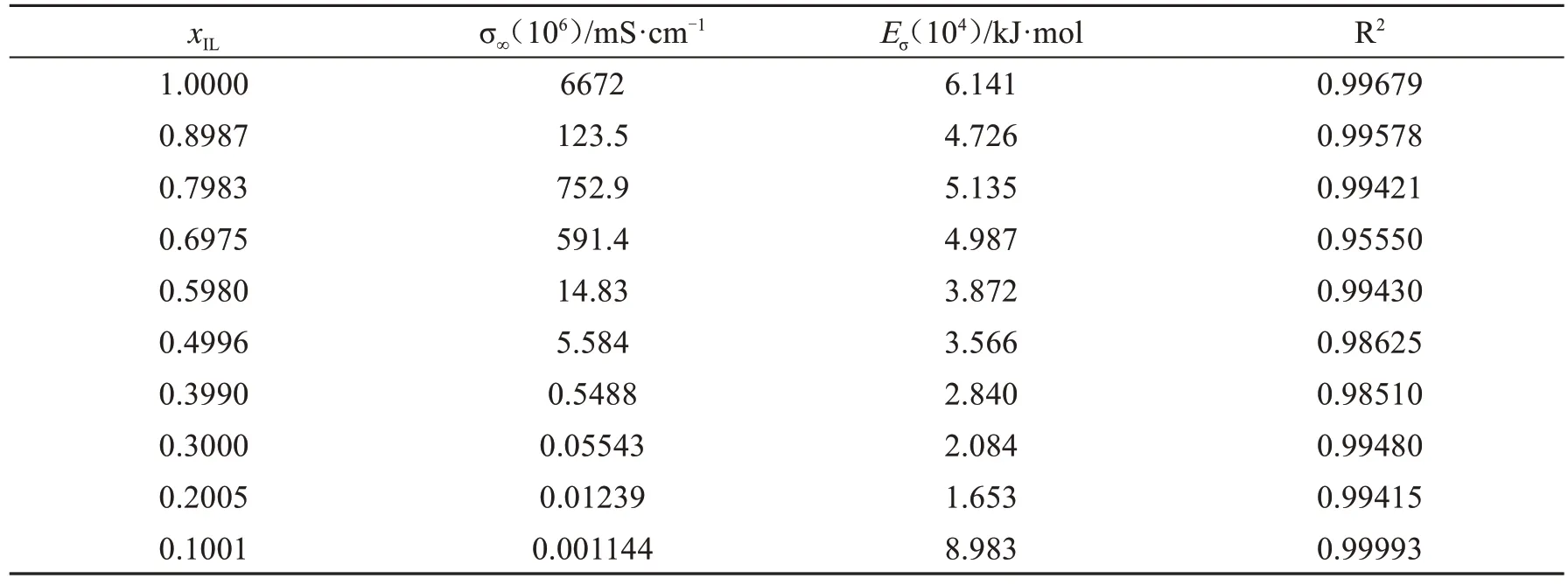
表9 [NH2-Pmim][BF4]+ACN二元体系Arrhenius方程的电导率拟合参数
3 结论
本文选择功能化离子液体1-氨丙基-3-甲基咪唑四氟硼酸[NH2-Pmim][BF4]与乙腈配制成全浓度的二元体系,测量了二元体系的电导率、密度等热力学性质.通过密度与经验方程估算了混合体系的超额摩尔体积VE,且二元体系VE值均为负值,说明二元体系内部存在离子偶极作用和有效的体积堆叠.还采用Arrhenius方程和VFT方程对二元体系的电导率与温度的变化关系进行了描述,对比发现,VFT方程更适合描述该二元体系的电导率与温度的变化关系.
