QuCHERS-UHPLC-MS/MS法测定畜中双氯芬酸钠残留量
2020-09-30王乾丽毛敏霞黄永桥马凯陶光灿李占彬
王乾丽,毛敏霞,黄永桥,马凯,陶光灿,李占彬*
贵州省分析测试研究院(贵阳 550014)
双氯芬酸钠(Diclofenac sodium)为非甾体类抗炎镇痛药,属苯乙酸类衍生物,主要通过抑制环氧合酶减少前列腺素的合成从而起到抗炎、镇痛、解热的作用[1-3]。近年来,双氯芬酸钠在临床上被广泛使用,该药物的安全问题也越来越受到关注,如造成肾脏、肝脏及坯胎等损害的不良反应[4-5]。双氯芬酸钠在畜禽养殖中主要用于动物关节炎、神经痛引起的发热、炎症等,能改善肉鸡的腿瘸和蛋鸡的断喙性能,但是该药物对禽类有较大毒性,欧盟已经批准双氯芬酸钠可以用于猪和牛,并制定了其最大残留限量(MRLs),在国内尚未批准用于动物,也未制定相关最大残留限量[6-7]。2005年,山东省药品不良反应监测中心将双氯芬酸等19种非甾体抗炎药列为不良反应重点监测品种,以加强安全性监测[8]。
目前,针对双氯芬酸钠的分析检测,国家质量监督检验检疫总局发布SN/T 2190—2008《进出口动物源性食品中非甾体类抗炎药残留量检测方法 液相色谱-质谱/质谱法》[9],文献报道的检测方法主要有高效液相色谱法、高效液相色谱-串联质谱法、气相色谱法、气相色谱-串联质谱法[10-18]。这些方法样品前处理过程繁琐,耗时长,且目标物损失较多,很难满足快速筛查的要求;而QuEChERS法作为一种样品前处理快速净化方法,未见应用于畜肉中双氯芬酸钠残留量的检测分析中。此次试验基于QuEChERS技术对药品进行前处理,结合超高效液相色谱-串联质谱分析手段建立畜肉中双氯芬酸钠残留的检测方法,该方法具有简单、快速、准确度和精密度好等优点,适用于大批量样品的快速分析检测,为企业和食品安全监管部门提供有效的技术支撑。
1 材料与方法
1.1 试验仪器和试剂
1.1.1 主要仪器与设备
Agilent 1290 超高效液相色谱仪、Agilent 6470 QQQ三重串联四级杆质谱,配有ESI源(美国Agilent公司);搅拌机Blixer3(法国ROBOT COUPA公司);LT2002电子天平(常熟市天量仪器有限公司);UMV-2多管涡旋混合器(北京普立泰科仪器有限公司);Milli-Q超纯水机(美国Millipore公司);陶瓷均质子(迪马科技有限公司);十八烷基键合硅胶(C18)吸附剂(上海安普实验科技股份有限公司);无水硫酸钠(天津市科密欧化学试剂有限公司);0.22 μm PTFE滤膜(上海安普)。
1.1.2 主要试剂
甲醇、乙腈(色谱纯,德国Merck公司);乙酸乙酯(分析纯,天津市科密欧化学试剂有限公司);甲酸(色谱纯,上海安普实验科技股份有限公司);乙酸铵(分析纯、西亚试剂);双氯芬酸钠(纯度>99%,德国Dr. Ehrenstorfer公司)。
1.2 标准溶液配制
精密称取10 mg双氯芬酸钠(精确至0.000 1 g)于10 mL棕色容量瓶中,用乙腈溶解并定容刻度,混匀,配制成质量浓度为1 000 mg/L标准储备液,于-18℃避光保存6个月。移取100.0 μL标准储备液于10 mL棕色容量瓶中,用乙腈定容,配制成10 mg/L的标准溶液,移取100.0 μL标准储备液于10 mL棕色容量瓶中,用乙腈定容,配制成100 μg/L的标准溶液,备用。
1.3 色谱条件
色谱柱,ZORBAX Eclipse Plus-C18反相色谱柱(50 mm×2.1 mm,1.8 μm,美国Agilent公司);流动相A,0.1%甲酸水溶液,B,乙腈;流速,0.3 mL/min;柱温,40 ℃;进样体积,2.0 μL;梯度洗脱程序见表1。

表1 流动相洗脱梯度
1.4 质谱条件
离子源,电喷雾离子源(ESI),正离子扫描;多反应监测(MRM);毛细管电压,4.5 kV;雾化器压力,45 psi;干燥气流速,10 L/min;干燥气温度,300 ℃;鞘气流速,10 L/min;鞘气温度,300 ℃;其他质谱条件见表2。

表2 其他质谱条件
1.5 样品前处理
称取5.00 g捣碎后的组织样品于50 mL具塞离心管中,准确加入10 mL乙腈,加入1粒陶瓷均质子,涡旋振荡10 min,以4 500 r/min常温离心10 min,吸取2 mL上清液于15 mL离心管中,加入900 mg无水硫酸钠和100 mg C18吸附剂,涡旋1 min,以5 000 r/min离心2 min,取上清液过0.22 μm PTFE滤膜,待测。
1.6 基质工作曲线配制
依次吸取不同体积的标准使用液加入相同取样量的3种空白基质样品中(牛肉、羊肉、猪肉),样品按1.5小节的方法处理后得到3种基质工作曲线,分别对3种样品进行定量校正。双氯芬酸钠的基质标准工作曲线范围为0.25~10.00 ng/mL。
2 结果与分析
2.1 样品前处理的优化
2.1.1 提取
选用空白猪肉、牛肉、羊肉阴性样品,分别考察了乙腈、0.1%甲酸乙腈、乙酸乙酯和0.1%甲酸乙酸乙酯的提取效率,结果见图1。3种畜肉基质中乙腈和0.1%甲酸乙腈的提取效果优于乙酸乙酯和0.1%甲酸乙酸乙酯的提取效果,且乙腈的提取效果好于0.1%甲酸乙腈,因此选择乙腈作为样品提取溶剂。
试验对涡旋振荡提取的时间(5,10和15 min)进行了优化,结果发现,在5~10 min时,随着时间的延长,提取效果明显增大,10 min以后随着时间的增加,提取效果基本趋于稳定,故选用涡旋振荡10 min作为样品提取时间。

图1 不同提取溶剂回收率比较
2.1.2 净化
目前,除了市售已有的产品,常用的吸附剂有C18、PSA、GCB等。此次试验对QuEChERS dSPE EMR-Lipid净化管(美国Agilent公司)、Oasis PRiME HLB固相萃取小柱(美国Waters公司,无需活化及淋洗、上样直接收集滤液)及C18吸附剂进行了考察。结果表明,使用QuEChERS dSPE EMR-Lipid净化管和Oasis PRiME HLB固相萃取小柱净化时,目标物基本被填料完全吸附;使用C18吸附剂净化时,目标物损失较少。试验进一步对C18粉的用量(50,100和200 mg)进行了优化,结果表明,使用100 mg C18粉净化样品时,净化效果较好,且目标物损失较少。
为加强样品净化效果,试验进一步对PSA吸附剂的用量(50,100和200 mg)进行了优化。结果发现,使用PSA吸附剂时样品净化效果更好,但是PSA吸附剂对双氯芬酸钠有较强的吸附,导致双氯芬酸钠的损失较大,故试验选择不加入PSA吸附剂。此次试验还对无水硫酸钠的用量进行了考察,最终确定使用900 mg无水硫酸钠。综合考虑,使用900 mg无水硫酸钠和100 mg C18吸附剂作为样品前处理方法。
2.2 色谱条件的优化
试验分别考察了乙腈-水、乙腈-0.1%甲酸水、乙腈-0.1%甲酸水含2 mmol/L乙酸铵溶液、甲醇-0.1%甲酸水、甲醇-0.1%甲酸水含2 mmol/L乙酸铵溶液等不同洗脱体系对目标物分离能力。结果表明,使用乙腈-0.1%甲酸水作为流动相时,目标物有良好的色谱分离效果,色谱峰峰型更好,且有较好的响应值,进一步对梯度洗脱程序进行优化,目标物有较好的分离,缩短样品分析时间,提高分析效率;试验考察了25,30,40和50 ℃不同柱温对目标物的影响,结果表明采用40 ℃的柱温时目标物有较好的响应值,从而确立了最佳色谱条件,样品单次分析时间仅需3.5 min,满足大批样品的快速检测分析。
2.3 质谱条件的优化
根据双氯芬酸钠含有羧基的化学结构特点,可在酸性条件下得到H+而形成较为稳定的[M+H]+准分子离子,在正离子模式下一级全扫描质谱得到分子离子峰([M+H]+,296.1),通过优化锥孔电压,对母离子进行二级质谱分析,得到子离子特征碎片质谱图,选择特征碎片中离子中响应值高、基线噪声低的离子对作为定性离子对,选择响应值最高的离子对作为定量离子对,优化子离子对碰撞能量,使其丰度最大;进一步优化毛细管电压、雾化器压力、干燥和鞘气的温度及压力等质谱参数,使其离子化效率最佳,得到最优的质谱条件。
2.4 方法学评价
2.4.1 基质效应的评价及消除
基质效应是指基质成分和目标化合物在进行离子化时相互竞争而导致目标化合物信号强度有不同程度的增强或减弱的现象,包括基质增强效应和基质抑制效应。尽管样品经过沉淀蛋白、分散固相萃取后取得了良好的净化效果,但仍无法完全消除基质效应,而基质效应的存在会对检测结果的准确性产生影响。因而在建立UHPLC-MS/MS检测方法时应对基质效应进行评价,为保证结果的准确可靠,采取措施消除或减弱其影响是非常必要的。
采用空白样品处理液加标曲线法(基质匹配标准曲线)评价基质效应,即基质效应ME=(基质配标准溶液曲线斜率/无基质标准溶液曲线斜率-1)×100%[19],负值表示存在基质抑制效应,正值表示存在基质增强效应,绝对值越大则基质效应越强。从表3可以看出双氯芬酸钠在猪肉、羊肉、牛肉中均存在基质效应,且均为基质抑制效应,抑制效应较大。

表3 双氯芬酸钠的基质效应
2.4.2 方法的标准曲线、检出限、定量限
采用基质工作曲线作为定量曲线。选取猪肉、牛肉和羊肉3种阴性样品,吸取不同量的标准使用液加入3种空白样品中,按照1.5小节的方法处理后经超高效液相色谱-质谱联用仪检测。以标准溶液定量离子对峰面积(Y)对其质量浓度(X,μg/L)作标准曲线,得到3种基质的工作曲线。结果表明,双氯芬酸钠在0.25~10.00 μg/L的质量浓度范围内呈现良好的线性关系,相关系数(R2)在0.996以上,适用于定量分析。通过向阴性样品中添加目标物来考察方法的检出限(LOD,S/N=3)和定量限(LOQ,S/N=10),最终确定方法的检出限(LOD)为0.5 μg/kg,定量限(LOQ)为1.5 μg/kg,结果见表4,说明该方法具有较好的灵敏度。

表4 双氯芬酸钠的线性范围、线性方程、相关系数(R2)、检出限(LOD)及定量限(LOQ)
2.5 加标回收及精密度考察
选取猪肉、牛肉和羊肉阴性样品,分别添加0.5,1和2 μg/kg 3个不同浓度的标准溶液,每个添加水平做6个平行试验,按照1.5小节的方法进行提取净化,3个加标浓度连续做3 d,分别计算精密度,精密度以变异系数(CV)表示。标准溶液、空白样品和加标样品见图2,结果如表5所示。3个添加水平的日内平均回收率分别为:猪肉86.9%~93.3%,牛肉90.9%~99.0%和羊肉87.3%~96.1%;日内变异系数(CV)分别为:猪肉2.3%~4.8%,牛肉5.1%~5.8%和羊肉4.4%~5.2%;日间平均回收率分别为:猪肉89.6%~94.1%,牛肉87.7%~96.1%和羊肉88.1%~94.9%;日间变异系数(CV)分别为:猪肉2.1%~9.0%,牛肉3.7%~8.2%和羊肉2.1%~4.0%。结果表明,该方法具有较好的重复性与准确性,能够满足猪肉、牛肉、羊肉样品中双氯芬酸钠残留量的测定。
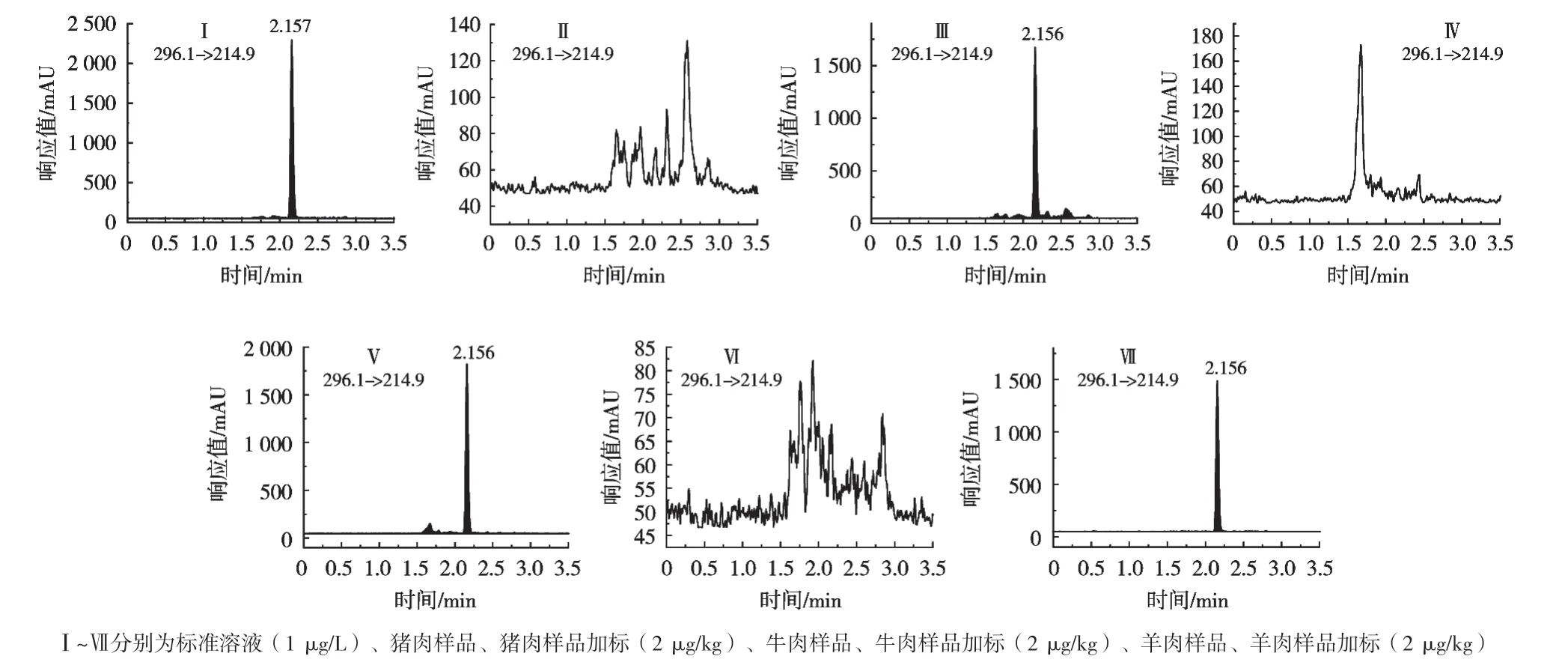
图2 MRM色谱图
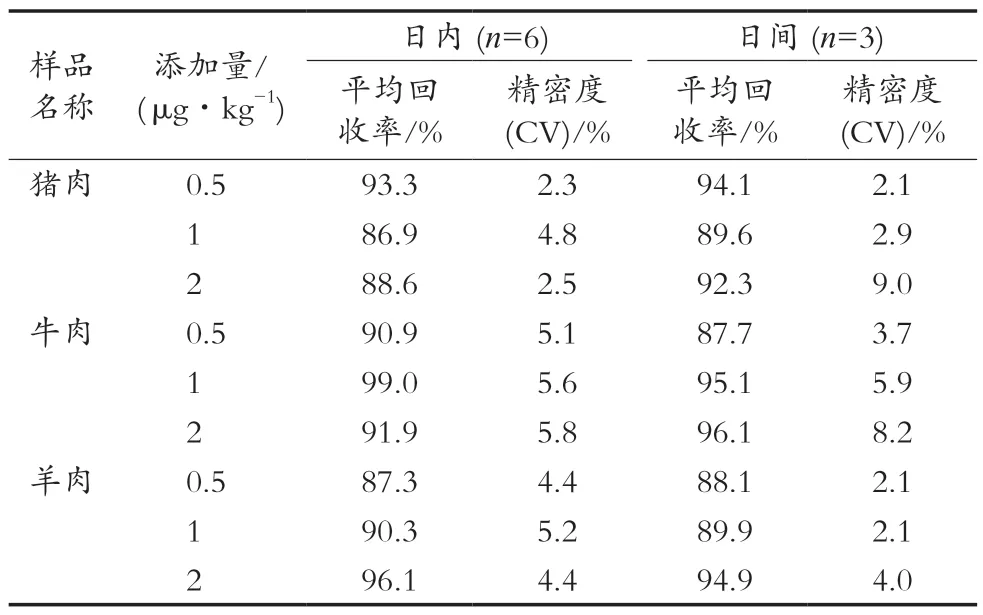
表5 畜肉中双氯芬酸钠的添加回收率和精密度
2.6 实际样品检测
选取了50个批次的市售猪肉样品、20个批次的市售牛肉样品和10个批次的市售羊肉样品,每个样品平行测定2次,按此次试验建立的方法进行测定,其中有3份猪肉样品和1份牛肉样品双氯芬酸钠检测结果呈阳性,猪肉检测结果分别为3.04,9.43和19.27 μg/kg,牛肉检测结果为6.65 μg/kg,其余样品均未检出。
3 结论
采用超高效液相色谱-串联质谱仪建立了猪肉、牛肉、羊肉中双氯芬酸钠残留量的快速检测方法,对样品前处理、液相色谱、质谱等条件进行优化,样品用乙腈提取剂,经QuEChERS试剂净化。结果表明,双氯芬酸钠在3.5 min内完成分析,相关系数(R2)在0.996以上,检出限为0.5 μg/kg;在0.5,1和2 μg/kg 3个添加水平的日内平均回收率分别为:猪肉86.9%~93.3%,牛肉90.9%~99.0%和羊肉87.3%~96.1%;日内变异系数(CV)分别为:猪肉2.3%~4.8%,牛肉5.1%~5.8%和羊肉4.4%~5.2%;日间平均回收率分别为:猪肉89.6%~94.1%,牛肉87.7%~96.1%和羊肉88.1%~94.9%;日间变异系数(CV)分别为:猪肉2.1%~9.0%,牛肉3.7%~8.2%和羊肉2.1%~4.0%。该方法操作简单准确,回收率高,灵敏度和重现性好,能够准确定性和定量双氯芬酸钠,为猪肉、牛肉、羊肉中双氯芬酸钠残留量的检测提供技术支撑,为监管部门及食品安全提供更多的理论依据。
