苦荞萌动的浸麦工艺优化
2020-09-30何伟俊吴俏槿夏雨陈甜妹曾荣白永亮
何伟俊,吴俏槿,夏雨,陈甜妹,曾荣,白永亮*
1. 佛山科学技术学院食品科学与工程学院(佛山 528200);2. 咀香园健康食品(中山)有限公司(中山 528400)
鞑靼荞麦(Fagopyrum tataricum(L.)Gaertn.),别名苦荞(Tartary buckwheat),是荞麦栽培种中的一员,在植物分类学上属于蓼科(Polygonaceae)荞麦属(Fagopyrum Mill.)的一种禾谷类作物。苦荞具有生长周期短(60~80 d可成熟)、抗严寒、抗逆性强、生态适应性强等特性[1],产地主要集中在四川、云南、贵州等西南省份。从营养角度看,苦荞具有丰富的氨基酸、维生素、矿物质、微量元素、膳食纤维、多酚、D-手性肌醇和黄酮等物质,具有降血糖、降血脂、抗癌、抗肿瘤和抗疲劳等生理功效,是一种具有强大开发潜力的功能性食品原料。在国内,随着食品加工技术不断发展,苦荞挂面、苦荞粉和苦荞焙烤食品等相继开发出,以苦荞为原料的休闲食品和健康食品如苦荞茶、苦荞醋和苦荞饼干等也在研究进展中。显而易见的是,以苦荞为原料开发的产品种类虽多,但目前在市场上种类却极其稀少,究其原因是苦荞本身口感差、口味苦涩、加工性能差等缺点,严重限制了苦荞发展,亟需一种改性方式对其进行改进。
萌动改性是改善青稞加工性状的一种快捷、简便和安全有效的手段,被广泛应用于大豆、绿豆和花生等作物原料。谷物在萌发过程中,种子的部分物质转化为可供新生命利用的活性成分,不仅可显著增加种子的营养成分含量和药用价值,而且可改善其风味和口感,因此萌发类食品目前在市场上深受消费者欢迎。大量研究表明,萌发不仅可以提高苦荞内对人体有益的活性成分如黄酮类化合物,而且可以消除其中有毒、有害或抗营养物质的含量[2-3]。近年来,通过浸麦和发芽的方式改进谷物营养品质受到广泛关注,对浸麦工艺的研究集中在大麦、小麦、青稞和麦芽等,但是对于苦荞的浸麦研究较少。种子萌发一般以浸麦和萌芽为组合进行,大部分谷物和豆类种子在萌发进行浸泡,会显著降低植酸含量等抗营养素因子[4]。关于浸麦工艺的研究目的主要集中在提高谷类作物内活性成分含量。闵维[5]通过浸麦工艺优化试验制得的萌发燕麦体外蛋白质消化率提高了58.02%,β-葡聚糖含量降低了8.6%。李丽霞[6]通过制麦工艺优化试验制得的萌发燕麦植酸含量下降了36.4%,蛋白质消化率上升了86.4%,而β-葡聚糖含量下降了87.0%。佟恩杰等[7]探究不同浸麦方式对麦芽中氧化还原酶类的影响,结果表示麦芽最优浸麦方式为浸四断八。浸麦工艺不仅对种子内的活性成分造成影响,而且可使种子在萌发阶段之前补充充足的水分,从而达到种子萌芽的条件。此外,浸麦还能保持种子洁净,能有效防止异物污染。
国外对苦荞发芽过程的研究集中在苦荞营养物质的变化过程[8],国内对苦荞的研究集中于黄酮的提取和生理功能[9-10],鲜见浸麦工艺对苦荞黄酮影响的研究报告。因此,通过正交试验设计优化苦荞浸麦工艺,一方面得到黄酮含量较高的萌动苦荞原料,另一方面为研究苦荞萌发过程中营养物质变化规律提供理论基础,进而为萌动苦荞在功能性食品开发的应用提供技术基础。
1 材料和方法
1.1 材料及试剂
苦荞籽粒(产自云南昭通,广东中山咀香园健康食品(中山)有限公司);次氯酸钠溶液(分析纯,天津市百世化工有限公司);无水乙醇(分析纯,湖南江虹试剂有限公司);芦丁标准品(浓度>98%,上海研谨生物科技有限公司);亚硝酸钠、硝酸铝、氢氧化钠(分析纯,上海麦克林生化科技有限公司)。
1.2 仪器与设备
TH2-82A型气浴恒温振荡器(常州市化能实验仪器厂);LHS-150/250HC-Ⅱ恒温恒湿箱(上海一恒科学仪器有限公司);THZ-82水浴恒温振荡器(常州亚特实验仪器有限公司);紫外可见光分光光度计(上海现科分光仪器有限公司);TG16G高速离心机(常州金坛良友仪器有限公司)。
1.3 试验方法
1.3.1 样品制备
选取没有破损、颗粒大小均匀、成熟饱满的苦荞种子,用蒸馏水洗净。用5%次氯酸钠溶液浸泡15 min,用蒸馏水反复洗净。每个直径15 cm的培养皿中放入消毒好的苦荞籽粒各200粒。将处理好的苦荞籽粒分别置于一定温度和湿度的恒温恒湿培养箱中进行浸麦处理,重复3次试验,浸麦后的苦荞籽粒均匀撒在铺有双层纱布的培养皿中,置于温度25 ℃、光照强度7 500 Lx、相对湿度80%的恒温恒湿培养箱中萌发48 h,3次重复,萌发结束后马上用液氮对苦荞芽进行冷冻,放入冷库预冻24 h后,置于-40 ℃、0.01 MPa环境下真空冷冻24 h,置于高速粉碎机中在液氮保护下进行磨粉,苦荞芽粉过60目筛后于-4 ℃保存,备用。
1.3.2 优化苦荞浸麦条件的单因素试验
分别考察浸麦温度(采用浸二断六浸麦方式,分别在15,20,25,30和35 ℃下,浸麦40 h),浸麦方式(分别在浸麦方式为重浸、浸二断六、浸四断四、浸六断二、不浸泡的方式,25 ℃浸麦条件下浸麦40 h)和浸麦时间(采用浸二断六浸麦方式,在浸麦温度25 ℃下分别浸麦24,32,40,48和56 h),进行单因素试验,浸麦后的苦荞籽粒均匀撒在铺有双层纱布的培养皿中,置于温度25 ℃、光照强度7 500 Lx、相对湿度80%的恒温恒湿培养箱中萌发48 h,重复3次,萌发结束后马上用液氮对苦荞芽进行冷冻,放入冷库预冻24 h后,置于-40 ℃、0.01 MPa环境下真空冷冻24 h,之后置于粉碎机中在液氮保护下进行磨粉,以总黄酮含量为评价指标,以确定各试验因素的影响和适用范围。(浸二断六方式为浸水培养2 h,后断水通风6 h;浸四断四方式为浸水培养4 h,后断水通风4 h;浸六断二方式为浸水培养6 h,后断水通风2 h。)
1.3.3 苦荞浸麦工艺优化试验
在单因素试验的基础上进一步优化试验,以浸麦方式、浸麦温度(℃)和浸麦时间(h)为考察因素,以总黄酮含量(%)为考察指标,优化浸麦参数,筛选最优工艺条件和技术参数,因素水平见表1。

表1 正交试验因素水平表
1.3.4 黄酮含量测定方法
试验方法参考张强等[11]苦荞菜中总黄酮含量的测定方法并对其步骤进行改进。
1.3.4.1 总黄酮含量标曲制作
分别吸取1,2,4,6和8 mL的0.264 g/L芦丁标准溶液于25 mL容量瓶中,加入30%乙醇定容至12.5 mL,加入48 g/L亚硝酸钠溶液0.7 mL,5 min后加入91 g/L硝酸铝溶液0.7 mL。6 min后,加入1 mol/L氢氧化钠溶液5 mL,用30%乙醇溶液定容放置10 min,以未加芦丁标准溶液的样品为空白,于波长510 nm处测定其吸光度。以芦丁质量浓度为横坐标、吸光度为纵坐标,绘制标准曲线,得出回归方程,其标准曲线见图1。由图1可知,芦丁质量浓度与吸光度的回归方程为y=9.625 2x+0.000 6,线性相关系数R2=0.999 8。

图1 芦丁标准曲线图
1.3.4.2 苦荞黄酮含量的测定
称取2 g粉碎后的苦荞,用75%乙醇,按料液比1∶30 g/mL,在50 ℃恒温水浴锅中提取4 h。冷却后,以7 000 r/min离心15 min,取上清液用75%乙醇定容至100 mL,吸取1 mL提取液于25 mL具塞试管中,加入48 g/L亚硝酸钠溶液0.7 mL,5 min后加入91 g/L硝酸铝溶液0.7 mL。6 min后,加入1 mol/L氢氧化钠溶液5 mL,用30%乙醇溶液定容放置10 min,于波长510 nm处测定其吸光度,对照标准曲线,按式(1)计算出总黄酮含量。
黄酮含量=c×V×100/(2×1 000)×100% (1)式中:c为由标准曲线查得黄酮质量浓度,g/L;V为提取液体积,25 mL;100为稀释倍数;2为苦荞芽粉质量,g。
1.4 数据处理
所有试验均进行3次重复试验,数据分析采用Graph Pad Prism 7.04软件进行,以平均值±标准差表示,显著性(p<0.05)分析采用SPSS Statistics 10.0软件进行。
2 结果与分析
2.1 浸麦工艺单因素试验
2.1.1 浸麦温度对苦荞黄酮含量的影响
浸麦前,苦荞种子含水量较低,其生理活动非常微弱,处于休眠状态。经过浸种后,苦荞种子开始快速吸水,种皮膨胀软化,溶解在水中的氧气也随之进入种子细胞,从而激活种子中的酶。在适宜的条件下,种子吸收足够的水分后其细胞开始分裂、伸长和突破硬壳。不同浸麦温度对苦荞种子影响各不相同,浸麦温度越高,种子吸水速度越快。但浸麦温度过高,会破坏种子内部结构[12]。浸麦温度对苦荞黄酮含量的影响见图2。
由图2可以看出,经过不同浸麦温度浸麦,萌发后苦荞总黄酮含量有明显上升,与原麦相比有显著差异(p<0.05)。随着浸麦温度不断升高,苦荞总黄酮含量不断减低,其中苦荞黄酮含量在浸麦温度15,20和25 ℃之前无显著性差异(p>0.05),可能是因为浸麦温度15~25 ℃时,苦荞充分吸水,增强种子萌发中的内源酶活性,从而促进生成苦荞黄酮。浸麦温度25 ℃时,苦荞黄酮含量与原麦相比提高了82.4%,故选择苦荞的浸麦温度25 ℃为宜。

图2 浸麦温度对黄酮含量的影响
2.1.2 浸麦方式对苦荞黄酮含量的影响
浸麦方式与谷物水分的吸收和二氧化碳的排出有关。适宜的浸麦方式不仅可使谷物的吸水速度加快,而且还能在种子的空气休止期排除CO2[13],从而避免种子因CO2积累而抑制种子正常生长发育,为种子萌发提供充足的水分和能量保障。浸麦方式对苦荞黄酮含量的影响如图3所示。
不同的浸麦方式对苦荞黄酮含量的影响各不相同,图3为浸麦方式对苦荞黄酮含量的影响。如图所示,浸麦方式之间对苦荞黄酮含量的影响呈显著性差异(p<0.05),浸麦方式采用浸二断六时苦荞黄酮含量达到最大值,为7.486%,与原麦黄酮含量相比增加了82.4%。浸麦方式采用浸四断四、浸六断二、对照组和重浸组与浸二断六相比,苦荞黄酮含量显著下降,这是因为连续浸麦时间不能过长,否则会导致种子萌动过程中氧气进入较少,从而抑制种子的呼吸作用,导致种子无法正常生长发育。
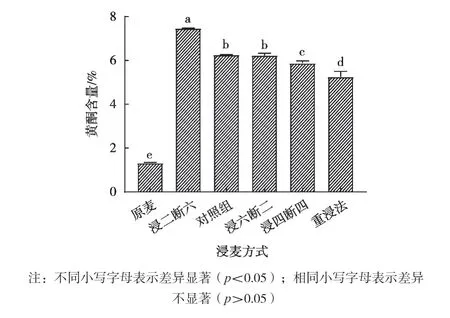
图3 浸麦方式对黄酮含量的影响
2.1.3 浸麦时间对苦荞黄酮含量的影响
浸麦时间是谷物萌发的关键因素。浸麦时间过短,会导致种子无法吸取足够的水分以维持正常的生长代谢;浸麦时间过长,会导致种子中的部分内源酶如β-淀粉酶和纤维素酶活性降低,使种子无法合成部分营养物质,从而影响种子发芽质量[14],故研究不同浸麦时间对苦荞黄酮含量的影响具有重要意义,其结果见图4。
由图4所示,随着浸麦时间延长,苦荞黄酮含量呈上升趋势,不同浸麦时间的黄酮含量与原麦相比均显著提高(p<0.05),变化趋势与Koyama等[15]研究荞麦浸泡过程中芦丁的变化趋势相似。浸麦时间由24 h延长至40 h时,苦荞总黄酮含量显著提高(p<0.05),浸麦时间40 h的苦荞黄酮含量达到最大值,为7.486%。当浸麦时间由40 h延长至56 h时,苦荞总黄酮含量显著降低(p<0.05)。这是因为苦荞种子吸收了过量的水分,导致种子部分组织结构遭到破坏,从而抑制苦荞种子正常生长发育。

图4 浸麦时间对黄酮含量的影响
2.2 浸麦工艺正交优化试验
在单因素试验基础上,选用L9(34)正交试验设计,优化影响苦荞总黄酮含量的浸麦条件。试验结果见表2,方差分析见表3。
由表2极差分析结果可以看出,3个因素对黄酮含量影响的主次顺序是C>B>A,即浸麦方式对苦荞黄酮含量影响较大,浸麦时间次之,浸麦温度对苦荞黄酮含量影响相对较小。由K值可以看出A1B2C2为最优组合,因此苦荞最优浸麦工艺为:浸麦温度20 ℃、浸麦方式采用浸二断六、浸麦时间40 h。

表2 浸麦工艺正交优化试验结果
2.3 验证性试验
在正交试验后得到的最佳工艺条件下,对苦荞进行浸麦萌发,结果表明苦荞黄酮为7.489%±0.16%,有效提高了苦荞黄酮含量。
3 讨论
黄酮作为苦荞的主要功能性成分,其含量为0.51%~6.28%[16],而且具有降血糖、降血脂、清除氧自由基及抗动脉粥样硬化等生理功能[17],是一种绿色纯天然的功能性食品,具有强大的开发前景。国内外研究表明萌发过程中的浸麦工艺条件及相关环境变量对苦荞内部萌发成分的变化有一定影响[9,17-18],因此研究苦荞的浸麦工艺对苦荞萌动过程中黄酮的影响具有现实意义。
试验表明,浸麦工艺对苦荞萌发过程中的黄酮含量有显著影响,优化浸麦工艺条件为:浸麦温度20 ℃、浸麦方式采用浸二断六、浸麦时间40 h,采用优化出的工艺条件进行制麦,苦荞黄酮含量增加了82.4%。张燕莉[19]在浸麦过程中对比喷淋、浸三断八、长断水三种浸麦方式对苦荞的影响,结果表明浸三断八为最优浸麦方式,制得多酚氧化酶活性高的苦荞,其短时间浸水与长时间断水结合的浸麦方式与试验结论相似。张琳[20]发现浸麦与发芽结合的萌发方法可以促进大麦内源赤霉素释放,从而提高麦芽质量。浸麦工艺不仅对种子内的活性成分造成影响,而且可使种子在萌发阶段之前补充充足的水分,从而达到种子萌芽的条件。此外,浸麦还能保持种子洁净,能有效防止异物污染。
4 结论
试验采用正交试验优化苦荞萌动的浸麦方法,确定了苦荞最佳浸麦工艺条件为:浸麦温度20 ℃、浸麦方式采用浸二断六和浸麦时间40 h。在此条件下制得的萌动苦荞黄酮含量为7.489%,为制备总黄酮含量较高的萌动苦荞原料提供理论依据和技术基础。
