新型6∶2氟调聚磺酸生态毒理研究进展
2020-09-30戴家银
盛 南 戴家银 郭 勇
(1.中国科学院动物研究所,中国科学院动物生态与保护生物学重点实验室,北京 100101;2.中国科学院上海有机化学研究所,中国科学院有机氟化学重点实验室,上海 200032)
0 前言
长链全氟及多氟烷基化合物(per-and polyfluoro-alkyl substances,PFASs)是一类以烷基链为骨架,氢原子被氟原子部分或全部取代的有机化合物。PFASs分子中含有高能C—F键,因此具有表面张力小、黏度低以及疏水、疏油的特性,被广泛应用于建筑、消防、化工、机械和航天等领域,具有不可或缺性[1]。2015年,瑞典化学品管理局(Swedish Chemicals Agency,KEMI)在工业产品中鉴定出2 060种PFASs,并由此推测目前已在全球投入使用的PFASs已超过3 000种[2]。近年来的研究发现,PFASs具有环境持久性、长距离迁移性和生物累积性[3-5],可引起实验动物肝脏毒性、内分泌干扰效应、免疫毒性和生殖发育毒性等毒性效应[6-8],且与多种人体健康问题和疾病存在一定的关联性[6][8-13]。
全球多个国家或地区相继出台限制多种长链PFASs生产使用的相关法规,全氟辛基磺酸(perfluorooctanesulfonic acid,PFOS)就是其中一种PFAS。2000年,全球最大的PFASs生产商3M公司协同美国环境保护署(United States Environmental Protection Agency,US EPA),自发停止对PFOS及其盐类和相关化合物的生产。2009年,联合国环境规划署(United Nations Environment Programme,UNEP)通过《斯德哥尔摩公约》,正式将PFOS及其盐类列为新的持久性有机污染物,同意减少并最终禁止使用该类物质。2016年,美国食品药品监督管理局(Food and Drug Administration,FDA)不再将3种含有PFOS类似物的产品列为食品接触材料。我国作为《斯德哥尔摩公约》履约国,于2014年联合宣布全面禁止除特定豁免和可接受用途以外PFOS的生产、使用及进出口。
鉴于PFOS等PFASs在生产和生活中具有不可替代性,替代品的研发成为各大氟化工厂的关注重点。6∶2 氟调聚磺酸(6∶2 fluorotelomer sulfonic acid,6∶2 FTSA,C6F13CH2CH2SO3H)是其中一种已投入生产使用的PFOS替代品,其结构如图1所示。
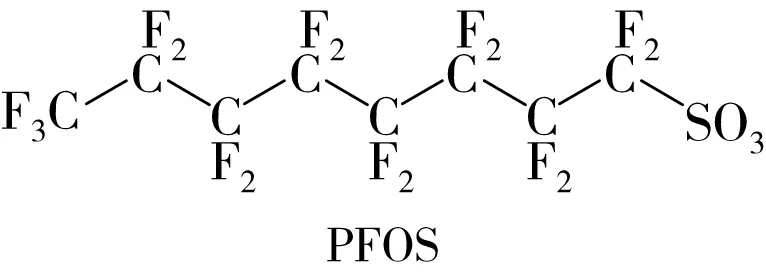
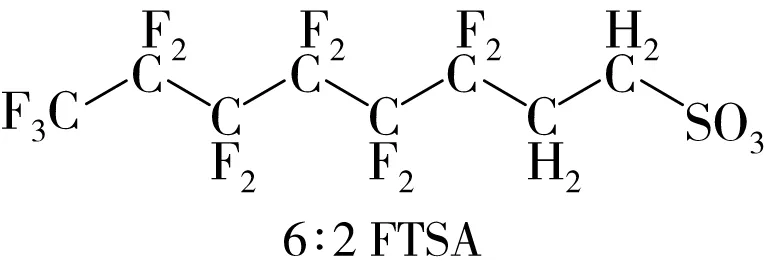
图1 PFOS和6∶2FTSA的分子结构
相较于PFOS,6∶2 FTSA中的H原子取代了PFOS中1、2号C原子上的F原子。杜邦公司以6∶2 FTSA合成了Forafac 1176[14],科慕公司也将其作为Capstone®FS-17的主要成分[14],应用于金属和塑料部件的表面处理和氟聚物乳化过程[15]。此外,6∶2 FTSA也是水成膜泡沫灭火剂中氟调聚物磺酸盐等的降解产物[15]。综述了6∶2 FTSA的环境分布、生物累积和转化及多种毒性效应,围绕目前存在的问题及未来的研究方向进行了讨论和展望,以期为6∶2 FTSA的环境污染及安全性评估提供参考。
1 6∶2 FTSA的环境分布
近年来,已在地表水体、工业废水、污泥、土壤和室内灰尘等多种环境介质中检测出6∶2 FTSA。
1.1 水体
自2007年Kim和Kannan在美国奥尔巴尼市的市区及周边湖泊和地表径流水中检测到6∶2 FTSA以来,6∶2 FTSA已在湖泊、河流和海湾等多种地表水样品中检出,见表1。近年来,我国水体中6∶2 FTSA的污染水平也有相关报道:Loi等在香港15个地区地表水中检测出6∶2 FTSA浓度为< 0.1~25.9 ng/L[16];6∶2 FTSA在我国东部城市的13条主要河流中浓度为0.1~0.3 ng/L[17];Pan等在中国、韩国、英国、德国、荷兰、瑞典和美国的16条代表性河流及湖泊样品中均检测出了一定浓度的6∶2 FTSA,但其在PFASs的总浓度占比在我国和西方国家水样间呈现明显差异,推测可能与另一种同功能产品F-53B在我国的大量使用密切相关[18]。
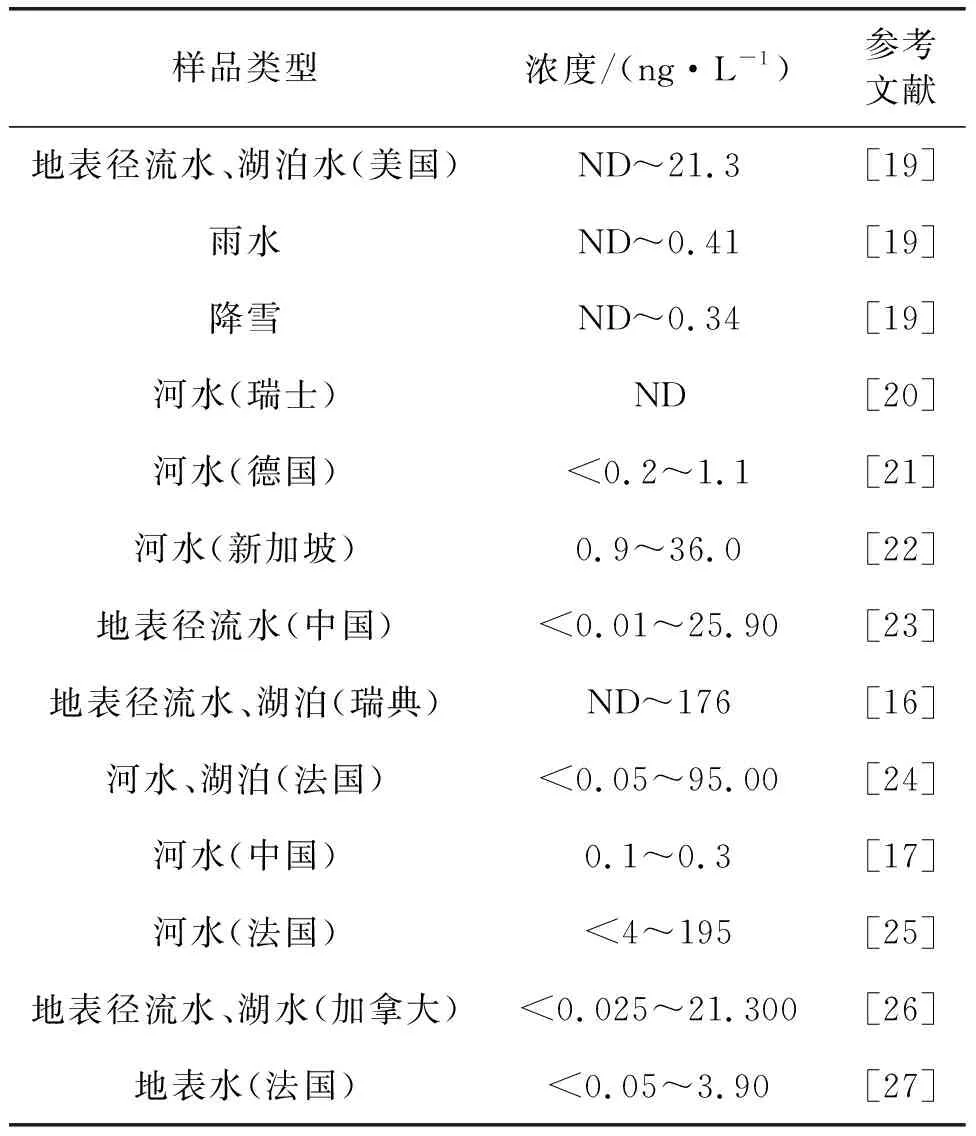
表1 6∶2 FTSA在自然水体中检出水平
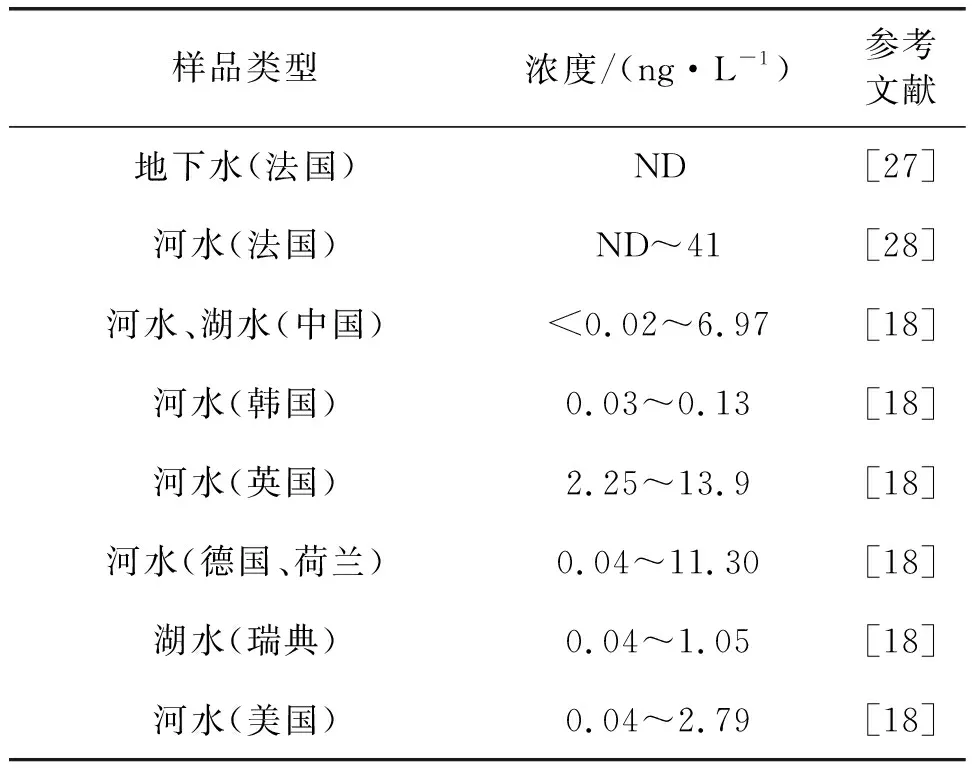
表1(续)
除自然水体外,Boiteux等在2013年采集的多个饮用水厂的进、出水及处理水样品中检测出了一定浓度的6∶2 FTSA[25]。消防培训区域采集的径流水及污水样品中6∶2 FTSA浓度可高达15 732 ng/L[29]。Houtz等在机场工业处理厂废水中检测出6∶2 FTSA中位数浓度为3.4 ng/L,最高浓度达390 ng/L[30]。
1.2 其他环境介质
2015年,Ruan等检测了我国14个城市的28个污水处理厂污泥中PFASs含量,其中6∶2 FTSA浓度最大值为13.9 ng/g dw,中位数为0.13 ng/g dw[31]。Houtz[32]和Munoz[27]等分别对土壤和底泥中6∶2 FTSA进行了检测,6∶2 FTSA在表层土中的中位数浓度为85 μg/kg,在含水层样品中为68 μg/kg,在底泥中浓度最高为0.51 ng/g dw。此外,6∶2 FTSA 已在加拿大、日本、希腊等不同国家的室内灰尘样品中检出[33],Zheng等在美国室内灰尘中检测出28种PFASs,其中6∶2 FTSA中位数浓度为12 ng/g[34]。
2 6∶2 FTSA的生物累积及生物转化
已有研究表明,PFOS具有生物累积和生物放大效应,可在生物体内,尤其是血清及肝脏中累积。作为PFOS替代品,6∶2 FTSA是否具有类似累积效应亟待研究。Hoke等评估了6∶2 FTSA在水生生物系统中的累积潜能,结果表明,6∶2 FTSA的水生生物富集因子(BAF)小于40,饮食同化效率、生长校正半衰期和食物链放大因子(BMF)分别为0.435、23.1 d和0.295,暗示其在水生生物系统中无累积效应[35]。有关PFASs在海洋生物中分布的相关研究发现,6∶2 FTSA在鱼类中基本未检出,但其在海洋无脊椎生物中的高浓度暗示了6∶2 FTSA在其中的生物累积[36]。Eriksson等检测了鹗、灰林鸮和红隼蛋及周边环境样品中PFASs含量,6∶2 FTSA仅在1个环境样品中检出,但在鹗蛋中6∶2 FTSA的检出率>60%,表明其可在鹗体内累积[37]。通过生物膜实验模拟技术,Munoz等估算了6∶2 FTSA的生物累积因子(LogBCFbiofilm)为1.4~3.6,低于PFOS(LogBCFbiofilm:3.1~3.8),暗示其在生物体中累积潜能较PFOS有所减弱[28]。6∶2 FTSA在斑马鱼体内无累积,其BCF值为35,同一实验中测得的BCFPFOS值则高达2 700[38]。蠓幼虫体内测得6∶2 FTSA和PFOS的生物-沉积物累积因子(biota sediment accumulation factors,BSAF,goc·gww-1)分别为0.018和0.023[39],沙虫体内测得6∶2 FTSA的生物-土壤累积因子[biota soil accumulation factors,BSAF,(gdw,worm/gdw,soil)-1]则较PFOS高约18倍(6∶2 FTSA:5 566;PFOS:310)[40],暗示6∶2 FTSA的生物累积效应或因物种差异而有所不同。此外,6∶2 FTSA在欧洲鲈鱼[41]、大鳞鲃和白鲑体内广泛检出,但并未发现其存在生物放大潜能[42]。
Zhou等利用温室土壤-植物系统研究了6∶2 FTSA在小麦、玉米、大豆和南瓜中的生物累积,结果表明,6∶2 FTSA可在根部累积,并通过导管转运至茎部[43]。Zhao等则围绕6∶2 FTSA及其他几种PFASs在南瓜中的吸收、转运及生物转化开展研究,发现6∶2 FTSA较PFOS具有更高的根部累积因子(RCF)和BCF[44]。
鉴于PFOS在环境中极难降解,6∶2 FTSA在环境或生物体内是否能够降解或代谢同样是研究人员的关注点。Yeung和Mabury发现6∶2 FTSA可在虹鳟体内生物降解,但其降解过程并不明确[45]。6∶2 FTSA在微生物体内的降解研究相对较多。在有氧和厌氧条件下直接培养细菌,6∶2 FTSA并未发生降解[46],但在有氧条件下,在含有污泥微生物群落的培养基中添加6∶2 FTSA,则可检测到降解产物,并推测出其降解过程。Wang等收集了美国马里兰州、宾夕法尼亚州和特拉华州3个污水处理厂的污泥,分别添加一定量的6∶2 FTSA以研究污泥中微生物对6∶2 FTSA的生物转化及转化效率。6∶2 FTSA的生物转化十分缓慢,63.7%的6∶2 FTSA在90 d后仍未被降解,所有可检测到的转化产物总量仅占6∶2 FTSA起始加入量的6.3%。6∶2 FTSA在污泥中主要的生物转化途径可描述为:6∶2 FTSA首先转化为6∶2 FTUCA,再经5 ∶2 氟调聚醇(5 ∶2 FTOH)转化为更短链的全氟戊酸(PFPeA)和全氟己酸(PFHxA)[47]。Van hamme等筛选出一种弧菌菌株(NB4-1Y)可降解6∶2 FTSA,6∶2 FTSA在该菌株内首先降解为6∶2 氟调聚磺酸(6∶2 FTCA),经6∶2不饱和氟调聚酸(6∶2 FTUCA)和5 ∶3不饱和氟调聚酸(5 ∶3 Uacid),最终转变为5 ∶3氟调聚酸(5 ∶3 acid)[48]。
3 6∶2 FTSA的毒性
结构类似的化合物或表现出相同或相近的生物毒性效应。因此,推测6∶2 FTSA的毒性效应或与PFOS类似。
3.1 细胞和微生物毒性
通过传统MTT实验,Sheng等比较了6∶2 FTSA和PFOS对人胚胎肝细胞系(HL7702)的毒性。结果表明,24 h暴露后测得的6∶2 FTSA对HL7702细胞存活率的半数生长抑制浓度(EC50)值低于PFOS,暗示其具有更强的细胞毒性[49]。Ochoa-Herrera等在PFASs对产甲烷菌毒性效应的研究中发现PFOS和6∶2 FTSA在较高浓度下对厌氧生物质中的氢营养型产甲烷菌没有或仅有很小的抑制作用[46]。
3.2 发育毒性
Abercrombie等用不同浓度的6∶2 FTSA和PFOS暴露美洲蟾蜍、虎纹钝口螈和豹蛙幼体30 d后测量吻口长度(SVL)和标度质量指数(SMI),发现6∶2 FTSA和PFOS的亚致死效应存在物种差异。6∶2 FTSA和PFOS暴露对虎纹钝口螈的SMI无明显效应,但影响了蝾螈SVL(暴露后SVL增加);无尾两栖类(美洲蟾蜍和豹蛙)暴露6∶2 FTSA和PFOS后,SVL均显著缩短,SMI在6∶2 FTSA暴露的豹蛙和PFOS暴露的美洲蟾蜍组中显著增长[50]。
3.3 水生系统毒性
2015年的一项全面评估6∶2 FTSA水生系统毒性的研究发现,6∶2 FTSA和PFOS的毒性效应明显不同。6∶2 FTSA对虹鳟、水蚤和绿藻的半数致死浓度(LC50)和EC50等急性终点指标均大于96 mg/L,PFOS的急性毒性终点范围则为48~78 mg/L。6∶2 FTSA和PFOS慢性暴露虹鳟的LD50值分别为2.62 mg/L和0.29 mg/L,表明6∶2 FTSA对虹鳟的毒性效力比PFOS至少低10倍[35]。
3.4 肝脏毒性
肝脏毒性是全氟烷基化合物具有代表性的毒性效应之一,PFOS暴露后,啮齿类动物及非人类灵长类动物肝脏出现肝细胞肿大、脂质累积及急性肝损伤等现象。研究发现,雄性小鼠亚急性暴露6∶2 FTSA后,肝脏出现明显肿大和小面积坏死,血清中谷草转氨酶(AST)和白蛋白(ALB)显著增加,暗示小鼠出现早期肝损伤。尽管如此,相较于PFOS,6∶2 FTSA对小鼠的肝脏毒性较PFOS有明显减弱[51]。
进一步的机制研究发现,6∶2 FTSA与PFOS一致,可激活肝脏细胞过氧化物酶体增殖物受体α(PPARα)通路,脂肪酸转运和代谢的相关基因表达上调。此外,6∶2 FTSA暴露后,小鼠肝脏中免疫应答和炎症相关基因及炎症因子水平显著上调,或是6∶2 FTSA引起肝脏损伤的主要原因之一[51]。
4 结语
结构类似的化合物对环境及生物的毒性效应也类似[52-53]。一个“有毒”化合物被另一个结构类似的化合物替代,这种结构类似物的替代可能仍具有相似的环境行为和毒性。综上所述,6∶2 FTSA已在水体、土壤和灰尘等多种环境介质中检出,尽管6∶2 FTSA不易被生物转化,但相较于PFOS,其生物累积潜能和毒性效应已有所减弱。现有报道多围绕其环境行为开展,对其毒性效应的研究较少,亟待开展如下研究:系统性地研究6∶2 FTSA的暴露途径及生物有效性,结合风险评估预测其对人体的健康风险;开展低剂量、长期、慢性毒性研究,整合多种组学从分子、基因等水平研究其毒性机制。以上研究结果将为“绿色、低毒和低蓄积性”的新型PFASs替代品的研发提供理论基础和技术支撑。
致谢
感谢中国科学院科技服务网络计划项目(KF-STS-QYZX-068)的资助
