宫腔灌注生长激素对子宫内膜容受性的影响
2020-09-28莫凤媚黄柳静巫晶晶
莫凤媚,黄柳静,巫晶晶
(广西医科大学第三附属医院生殖中心,南宁 530031)
胚胎质量和子宫内膜容受性是体外受精-胚胎移植(IVF-ET)治疗获得成功妊娠的两大关键性因素。一直以来临床上普遍应用于评估子宫内膜容受性的主要指标是超声测量子宫内膜厚度及观察内膜形态。临床工作中有相当一部分患者因为子宫内膜过薄被取消移植,而对于子宫内膜过薄的治疗目前仍没有绝对有效的方法,主要是通过激素治疗[1]、增加子宫血流灌注[2-3]等方法来增加子宫内膜厚度、改善子宫内膜容受性,提高临床妊娠率。我国2015年有作者首次报道宫腔灌注生长激素(GH)能提高薄型子宫内膜患者临床妊娠率[4],但关于该方法的研究报道仍较少。本研究探讨宫腔灌注GH应用于冻融胚胎移植(FET)周期对子宫内膜容受性及妊娠结局的影响,以期为薄型子宫内膜患者的临床治疗提供一定参考。
资料与方法
一、研究对象
收集2019年5~12月在我院生殖中心因子宫内膜薄而取消鲜胚移植计划行FET的38例患者为研究对象。
纳入标准:扳机日内膜厚度<7 mm;年龄<40岁;因女方输卵管因素或者男方因素行IVF/ICSI-ET,有可移植胚胎冻存;宫腔镜检查示宫腔正常。排除标准:合并肝肾功能异常患者;合并子宫肌瘤、宫腔粘连及其他宫腔畸形、甲状腺功能低下和甲状腺功能亢进以及血栓倾向性疾病的患者。
本研究经我院医学伦理会讨论通过,所有研究对象在充分知情的基础上,签署知情同意书。符合标准的38例患者按入组日期单、双日随机分为宫腔灌注组[19例,采用激素替代治疗(HRT)准备内膜+宫腔灌注GH]和对照组(19例,单纯HRT准备内膜)。
二、研究方法
1.内膜准备及FET:入组患者均采用HRT准备内膜行FET。月经第3天开始给予戊酸雌二醇片(补佳乐,拜耳,德国)6 mg/d×8~10 d,同时加用阿司匹林肠溶片(拜耳,德国)100 mg/d直至移植后14 d;B超检测内膜厚度,若厚度<8 mm,补佳乐增加至8 mg/d×3 d;再次B超检测,若内膜厚度仍<8 mm,补佳乐增加至10 mg/d×3 d,若内膜厚度仍<8 mm,补佳乐维持最大剂量10 mg/d直至黄体转换日。两组患者治疗14~20 d,当内膜厚度≥8 mm,且内膜厚度3~5 d无增长时进行黄体转化;如治疗20 d内膜厚度仍<8 mm也行黄体转化。在黄体转化的第4天移植1~2枚Ⅰ~Ⅱ级优质卵裂期胚胎,或在黄体转化的第6天移植1~2枚4BC或以上质量的囊胚。
2.GH宫腔灌注:宫腔灌注组自HRT第8~10天开始给予宫腔灌注重组GH(赛增,长春金赛药业)4.5 U,qod,宫腔灌注3~5次。每次灌注前患者均需进行外阴阴道冲洗,减少感染机会。患者取膀胱截石位,用生理盐水抹洗外阴阴道,GH 4.5 U用1 ml 0.9%生理盐水稀释,使用2 ml注射器抽取1 ml GH灌注液,连接一次性人工授精管,授精管前端进入宫颈内口上方后缓慢注入GH灌注液。灌注完毕,弃管,让患者臀部抬高15~30°,卧床休息10 min后可自由活动。
3.子宫内膜厚度及内膜下血流测量方法及参数:两组患者均在既往排卵期及黄体转化当天测量子宫内膜厚度及子宫内膜下血流。获取子宫正中长轴切面,检测子宫内膜及内膜下血流灌注情况。壳容积模式下选择内膜下区域厚度设定为1 mm[5]。根据内膜及内膜下血流灌注情况分为:Ⅰ型(内膜区域可见血流信号,并接近宫腔中线)、Ⅱ型(内膜区域可见血流信号,但≤1/2单层内膜)、Ⅲ型(内膜下区域可见血流信号)。同时测量内膜血流阻力指数(RI)、PI(搏动指数)、收缩期与舒张期流速之比(S/D)。
4.随访:移植后14~16 d测血β-HCG,移植后4~5周B超探及妊娠囊为临床妊娠(包括异位妊娠);早期流产为发生在妊娠12周以前的流产。
三、观察指标
收集两组患者的一般资料;治疗前后子宫内膜厚度/形态参数、子宫内膜下血流参数;治疗后FET妊娠结局(胚胎种植率、临床妊娠率和早期流产率)。
四、统计学方法
所有数据使用SPSS 18.0统计软件进行数据分析。计量资料比较采用t检验,计数资料比较采用χ2检验;P<0.05为差异有统计学意义。
结 果
一、两组患者基本资料比较
本研究共纳入38例子宫内膜薄型(<7 mm)患者,宫腔灌注组与对照组各19例。宫腔灌注3~5次,平均(4.7±1.3)次。共移植胚胎55枚,其中宫腔灌注组28枚、对照组27枚。
两组间年龄、不孕年限、基础FSH(bFSH)、抗苗勒管激素(AMH)、体重指数(BMI)、雌激素使用天数(指内膜行孕激素转化时雌激素用药天数)、平均移植胚胎数、移植不同时期胚胎比例等比较均无显著性差异(P>0.05)(表1)。

表1 两组患者基本情况比较[(-±s),n(%)]
二、两组患者治疗前、后子宫内膜情况比较
1.子宫内膜厚度、容积、形态:治疗前,宫腔灌注组子宫内膜厚度显著小于对照组(P<0.05),而两组间子宫容积、子宫内膜分型比较均无显著性差异(P>0.05)。治疗后,宫腔灌注组子宫内膜厚度、容积均显著增加(P<0.05),且子宫内膜厚度增长与子宫内膜容积增长幅度均显著高于对照组(P<0.05);宫腔灌注组治疗后A+B型内膜比例(94.7%)较治疗前(78.9%)略增高,但尚无显著性差异(P>0.05)(表2)。

表2 两组患者治疗前后子宫内膜厚度、容积及内膜形态情况比较[(-±s),n(%)]
2.子宫内膜血流:治疗前,宫腔灌注组内膜血流参数S/D显著大于对照组(P<0.05),其余参数比较均无显著性差异(P>0.05)。治疗后,宫腔灌注组内膜血流灌注类型Ⅰ、Ⅱ型比例较治疗前显著增加(P<0.05),但与对照组治疗后比较无显著性差异(P>0.05);其余各参数组内治疗前、后比较,或组间治疗后比较,均无显著性差异(P>0.05)(表3)。

表3 两组患者间治疗前及治疗后内膜血流参数比较[(-±s),n(%)]
三、两组患者助孕妊娠结局比较
两组患者囊胚移植比例均占大部分(>70%)。对照组3例卵裂期胚胎移植无1例妊娠,宫腔灌注组5例卵裂期胚胎移植有1例妊娠。两组的囊胚移植及总的胚胎移植HCG阳性率、临床妊娠率、胚胎着床率比较均无显著性差异(P>0.05),但宫腔灌注组的HCG阳性率(47.4% vs. 42.1%)、临床妊娠率(36.8% vs. 31.6%)、囊胚着床率(33.3% vs. 30.4%)均略高于对照组(表4)。
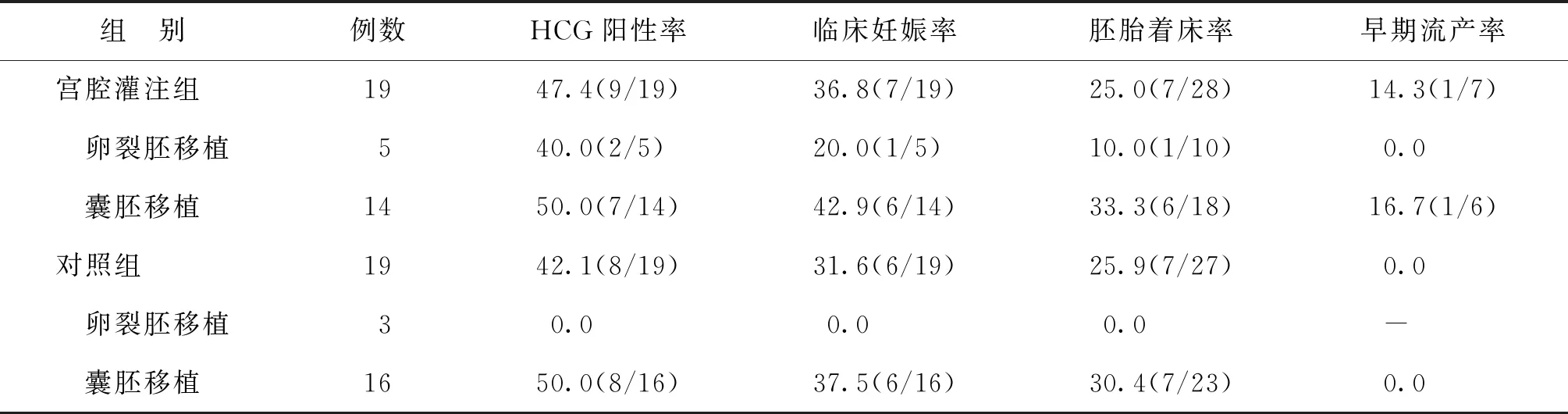
表4 两组患者助孕妊娠结局比较(%)
讨 论
子宫内膜容受性是指子宫内膜具有使胚胎粘附、侵入并着床的特殊状态,子宫内膜容受性与子宫内膜厚度、形态及子宫内膜血流状态存在紧密相关性[6]。目前经阴道多普勒超声已广泛应用于辅助生殖技术中观察患者子宫内膜状态,但是,临床上,除了内膜厚度与内膜形态外,内膜血流参数与内膜容受性关系的研究不多,且目前尚无统一标准。
薄型子宫内膜的发病机制目前仍不完全清楚,其可能继发于各种原因的内膜损伤,如各种宫腔操作造成的炎症和机械性损伤;也可能为原发性薄型子宫内膜,如先天发育异常等[7]。当子宫内膜基底层严重受损时,子宫内膜的成体干细胞数量减少和/或细胞功能异常,子宫内膜再生的能力严重下降,对雌激素刺激反应性降低甚至无反应,使子宫内膜过薄从而不能支持胚胎种植。据报道,子宫内膜厚度<6 mm时,几乎无妊娠可能[8]。目前对于薄型子宫内膜的治疗仍没有绝对合理有效的方法,常用的治疗方法有雌激素治疗、子宫内膜刺激[9]、血管扩张药物使用[10-11],以及近年来正处在临床研究阶段的干细胞治疗[12]等。一部分患者得益于这些治疗方法,但仍有一部分患者疗效甚微。
GH是人体脑垂体前叶分泌的一种肽类激素,参与人体细胞的生长与代谢,其在子宫内膜中可以通过与GH受体结合,调节胰岛素样生长因子(IGFs)分泌促使子宫内膜增厚、血管丰富、腺体生长;同时,促进子宫内膜多种炎性细胞因子的表达,协调多种细胞因子间的平衡,改善子宫内膜容受性,提高妊娠率。
本研究通过宫腔灌注GH结合人工周期为子宫内膜薄型患者进行内膜准备,行FET助孕治疗。研究结果显示宫腔灌注组治疗后子宫内膜厚度与子宫内膜容积均明显增加,且增长幅度显著高于对照组;宫腔灌注组行GH灌注治疗后A+B型子宫内膜的比例亦较治疗前明显增高(94.7% vs. 78.9%)。本研究所纳入病例中,对照组患者治疗前的既往内膜较宫腔灌注组稍厚,研究结果提示基础条件更差的宫腔灌注组患者经过宫腔灌注GH治疗后,与对照组获得了相似的胚胎着床率(25.0% vs. 25.9%)、临床妊娠率(36.8% vs. 31.6%)以及囊胚移植妊娠率(42.9% vs. 37.5%),并且在数值上还有升高的趋势。2013年吴洪波等[13]对子宫内膜生长不良患者在FET治疗中于卵泡期开始每天皮下注射GH,结果发现32例GH组移植时子宫内膜厚度明显高于30例非GH组,提示GH应用于子宫内膜薄型患者可以有效增加子宫内膜厚度;但两组的临床妊娠率比较尚无显著性差异,与我们的研究结果一致。这可能与样本量较小有关。吴洪波等[13]的研究中对于GH的使用方法与本研究不同,提示不管是注射用或宫腔灌注使用GH对于子宫内膜薄型患者均能获益,均可以提高子宫内膜厚度,改善临床结局。对于宫腔灌注GH的使用方法,禹虹等[4]于2015年报告了5例薄型子宫内膜患者行FET治疗的临床资料,给予GH宫腔灌注联合替代周期治疗,5例患者均获得临床妊娠。2017年禹虹等[14]再次报道采用同样的方法治疗25例子宫内膜生长不良患者(观察组),与非子宫内膜薄型的对照组比较,观察组获得了较满意的临床结局。本研究与其不同之处是薄型子宫内膜的纳入标准,本研究中纳入标准是子宫内膜厚度<7 mm,比禹虹等[14]研究中内膜薄的标准(<8 mm)更低,故纳入本研究的病例内膜条件更差,这可能是本研究中宫腔灌注组黄体转化日内膜平均厚度较薄、妊娠率较低的主要原因。
本研究对所有患者进行了至少两次子宫内膜血流参数的测量,包括PI、RI、S/D,及内膜血流灌注分型。子宫组织学的研究证实,子宫最内层肌血管较外层肌丰富,子宫内膜及内膜下血流灌注能直接反映胚胎着床部位的微循环情况,在子宫内膜容受性方面起重要作用[15]。2015年王锦惠等[5]利用超声检测评估子宫内膜容受性时发现妊娠组PI、RI、S/D均低于非妊娠组,利用受试者工作特征曲线(ROC曲线)下面积评估血流参数预测妊娠的价值时发现PI对内膜容受性预测价值较好。本研究中,宫腔灌注组子宫内膜血流参数S/D治疗前与对照组患者比较有显著差异,宫腔灌注GH治疗后差异消失,且治疗后内膜血流灌注类型Ⅰ、Ⅱ型较治疗前明显增多,提示宫腔灌注GH治疗子宫内膜薄型患者除改善内膜厚度与形态外,还在一定程度上改善了子宫内膜血流灌注,继而改善薄型内膜的容受性。但宫腔灌注组患者在治疗前后子宫内膜血流参数PI、RI、S/D比较无显著差异,考虑可能有两方面的原因:(1)子宫内膜过薄的患者,可能内膜受到了严重损坏,包括内膜细胞及内膜血管的损伤,其再生修复是非常困难或者微乎极微的,但只要能达到其最佳状态也可以实现胚胎种植;(2)研究纳入样本例数较少,研究结果只能起到提示作用。
本研究中,妊娠者子宫内膜最薄为5.5 mm,王锦惠等[5]的研究中亦有同样发现,提示妊娠所需子宫内膜厚度的最小值仍无确切数据。2017年Huang等[16]报道宫腔灌注药物是治疗反复移植失败患者的方法之一,宫腔灌注药物这种局部给药方式可以让药物直接作用于子宫而达到治疗的目的。之前有研究发现子宫内膜上有GH受体和胰岛素样生长因子1(IGF1)的表达[17-18],宫腔灌注可以让GH更好地直接作用于子宫内膜,促进内膜发育,诱发细胞因子的释放,增加子宫内膜厚度,改善内膜微环境,降低内膜血流阻力,增加内膜血流,从而改善子宫内膜容受性,提高薄型子宫内膜患者的妊娠率,改善临床结局。宫腔灌注GH是薄型子宫内膜患者可选的治疗方法之一。但由于本研究实验设计及样本量较少的原因,研究结果存在一定局限性,有待于扩大样本量、完善实验设计的随机对照试验(RCT)来进一步证实。
