传染性单核细胞增多症患儿外周血淋巴细胞亚群、细胞因子、TLRs的表达变化及其临床意义
2020-09-25
(杭州市儿童医院 感染科,浙江 杭州 310014)
Epstein-Barr病毒(Epstein-Barr virus,EBV)属于人类疱疹病毒γ 亚科嗜B淋巴细胞组群中的DNA病毒[1],在学龄前儿童中较为常见,是引起儿童传染性单核细胞增多症(infectious mononucleosis,IM)最主要的病原体之一[2]。在感染潜伏期,EBV 主要是附着于B淋巴细胞中,但此时B细胞并不表达EBV 核蛋白,故不具备致病性[3]。但是当极少数记忆B细胞分化成浆细胞时,可释放出病毒颗粒,激活细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL),导致炎症因子大量释放,包括肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和多种白细胞介素(Interleukin,IL)等[4]。此时EBV 从潜伏状态变为增殖状态,可引发一系列临床症状。此外,在EBV感染早期,单核细胞、树突状细胞等抗原提呈细胞表面的Toll 样受体(Toll like receptors,TLRs)可识别病毒蛋白,进而启动宿主的抗病毒免疫应答[5]。炎症反应和免疫破坏协同作用可能是导致IM 预后不良的重要原因[6]。本研究旨在分析EB 感染IM患儿外周血淋巴细胞亚群、细胞因子,以及TLR7、TLR9分子的表达情况,以揭示EBV感染对儿童免疫功能的影响及IM的发病机制,为临床检测和治疗提供新的思路。
1 资料与方法
1.1 一般资料
选取2019年1月—2019年12月杭州市儿童医院收治的98例感染EBV致IM急性期患儿作为研究对象。其中,男性58例,女性40例;年龄13个月~13岁,平均(52.39±28.35)个月。纳入标准:①符合《儿童EB病毒相关疾病的诊断标准和治疗原则》[7]中临床诊断及实验室诊断标准;②初诊为感染EBV致IM,发病1~7 d;③EBV DNA>1×103拷贝/ml,EBV-VCA IgM(+)或早期抗原IgG(+),且抗EBVEBNA1 IgG(-);④1~13岁儿童;⑤配合完成治疗及相关检查,急性期与恢复期均未使用激素、免疫调节剂。排除标准:①先天性免疫缺陷或合并免疫系统疾病,既往有变态反应疾病史;②合并恶性肿瘤、血液系统疾病;③入组前3个月服用糖皮质激素、细胞毒性药物或其他免疫抑制剂。另选取同期本院体检的健康儿童50例作为对照组,血浆EBV-DNA检查为阴性。对照组男性25例,女性25例;年龄1~13岁,平均(49.36±25.78)个月。两组年龄、性别等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准,患儿家属或法定监护人均签署知情同意书。
1.2 主要仪器与试剂
TG16台式高速离心机(上海卢湘仪离心机仪器有限公司),Cytomics FC500型流式细胞仪、流式试管及配套设备(美国Beckman Coulter公司),SpectraMax M3 多功能酶标仪(美国MD公司),Ficoll 单个核细胞分离液(北京索莱宝生物科技有限公司)。EBV特异性抗体试剂盒(深圳赛尔生物技术有限公司),FITC-CD3、RD1-CD4、ECD-CD8、PE-CD16+56+、APC-CD19 荧光标记单克隆抗体及同型对照抗体(美国Beckman Coulter公司),酶联免疫吸附试验(ELISA)试剂盒(美国R&D公司),Trizol 试剂和M-MLV 试剂盒(美国Invitrogen公司),SYBR Premix Ex TaqTM Ⅱ试剂盒(大连宝生生物工程有限公司),核酸提取试剂盒(广州中山大学达安基因股份有限公司)。
1.3 治疗
IM患儿入院后首先完成血常规、生化指标、肝肾功能检查。采用ELISA检测EBV 特异性抗体,予以卧床、退热、补充体液及维生素、保护脏器等综合性支持治疗,保持呼吸道畅通;必要时给予阿昔洛韦注射液(武汉普生制药有限公司,规格0.25 g/支,批准文号:国药准字H4202019)10 mg/(kg·d)抗病毒治疗,静脉注射,1次/8 h,连续治疗7 d。伴有细菌感染的患儿则给予抗生素治疗,并积极应对并发症,必要时纠正血清电解质紊乱和酸碱平衡。
1.4 检测指标
1.4.1 血液标本采集患儿治疗前(急性期)和病程满1个月复查(恢复期)时,由儿科护士分别无菌抽取患儿清晨空腹静脉血2、2和4 ml,置于肝素抗凝管、采血管、乙二胺四乙酸抗凝管中,分别用于检测外周血淋巴细胞亚群比例、血清细胞因子水平,以及收集外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。对照组儿童采用同样的方法采集外周静脉血,收集全血和血清,保存至-80℃备用。
1.4.2 淋巴细胞亚群检测采用全血免洗法检测CD3+、CD4+、CD8+、CD19+、CD16+56+。
1.4.3 细胞因子检测采用ELISA 抗体双夹心法检测IL-1β、IL-6、IL-8、IL-10、TNF-α、α 干扰素(Interferon-α,IFN-α)、IFN-γ。取出试剂盒及血清标本,温度平衡至室温。使用前将所有试剂充分摇匀,严格按照操作说明书进行检测。
1.4.4 TLR7和TLR9 mRNA检测采用Ficoll 密度梯度离心法分离外周全血PBMC,采用Trizol 试剂提取PBMC的总RNA,并逆转录为cDNA。以cDNA为模板,采用SYBR Premix Ex TaqTM Ⅱ试剂盒进行qRT-PCR 反应,反应体系为20μl,反应条件:95℃预变性30 s,95℃变性5 s,52℃退火10 s,72℃延伸2 min,共36个循环。以2-ΔΔCt表示目的基因mRNA相对表达量。qRT-PCR引物序列见表1。

表1 qRT-PCR引物序列
1.4.5 EBV DNA载量检测采用qRT-PCR检测全血标本EBV DNA载量。BamH1-W 正向引物:5'-GCCAGAGGTAAGTGGACTTT-3',反向引物:5'-TACCACCTCCTCTTCTTGCT-3',长度389 bp;荧光探针序列:5'-CACACCCAGGCACACACTACACAT-3'。根据标准曲线计算EBV-DNA载量。
1.5 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差 (±s)或中位数和四分位数[M(P25,P75)]表示,比较用t检验或秩和检验;计数资料以率(%)表示,比较用χ2检验;相关性分析采用Spearman 法,P<0.05为差异有统计学意义。
2 结果
2.1 两组外周血淋巴细胞亚群、细胞因子、TLRs mRNA比较
两组外周血淋巴细胞亚群百分比(CD3+、CD4+、CD8+、CD19+、CD16+56+)、细胞因子水平(IL-1β、IL-6、IL-8、IL-10、TNF-α、IFN-α、IFN-γ)、TLR7和TLR9 mRNA相对表达量比较,经t或秩和检验,差异有统计学意义(P<0.05);与对照组相比,IM组患儿急性期外周血CD3+、CD8+、IL-1β、IL-6、IL-8、IL-10、TNF-α、IFN-γ、TLR7和TLR9 mRNA相对表达量升高,CD4+、CD19+、CD16+56+降低。两组血清IFN-α 水平比较,差异无统计学意义(P>0.05)。见表2~4。
2.2 IM患儿外周血淋巴细胞亚群、细胞因子、TLRs mRNA与EBV DNA载量的关系
经Spearman相关性分析,IM患儿急性期EBV DNA载量与血清IL-1β和TLR9 mRNA呈正相关(r=0.247和0.348,P=0.017和0.000),与其他指标无关(P>0.05)。见图1。
2.3 急性期和恢复期患儿外周血淋巴细胞亚群、细胞因子、TLRs mRNA相对表达量比较
急性期与恢复期患儿外周血淋巴细胞亚群百分比(CD3+、CD4+、CD8+、CD19+、CD16+56+)、细胞因子水平(IL-1β、IL-6、IL-8、IL-10、TNF-α、IFN-γ)、TLR7和TLR9 mRNA相对表达量比较,经t或秩和检验,差异有统计学意义(P<0.05);与急性期相比,恢复期外周血CD3+、CD8+、IL-1β、IL-6、IL-8、IL-10、TNF-α、IFN-γ、TLR7和TLR9 mRNA相对表达量降低,CD4+、CD19+、CD16+56+升高。急性期与恢复期患儿血清IFN-α 水平比较,差异无统计学意义(P>0.05)。见表5~7。
表2 两组外周血淋巴细胞亚群比较 (%,±s)

表2 两组外周血淋巴细胞亚群比较 (%,±s)
组别 n CD3+ CD4+ CD8+ CD19+ CD16+56+对照组 50 67.27±5.91 36.82±5.74 27.65±6.17 19.74±3.59 17.81±5.27 IM组急性期 98 82.17±5.78 17.45±5.97 55.16±10.81 6.94±3.76 7.34±3.81 t值 14.721 18.910 16.647 19.885 13.834 P值 0.000 0.000 0.000 0.000 0.000
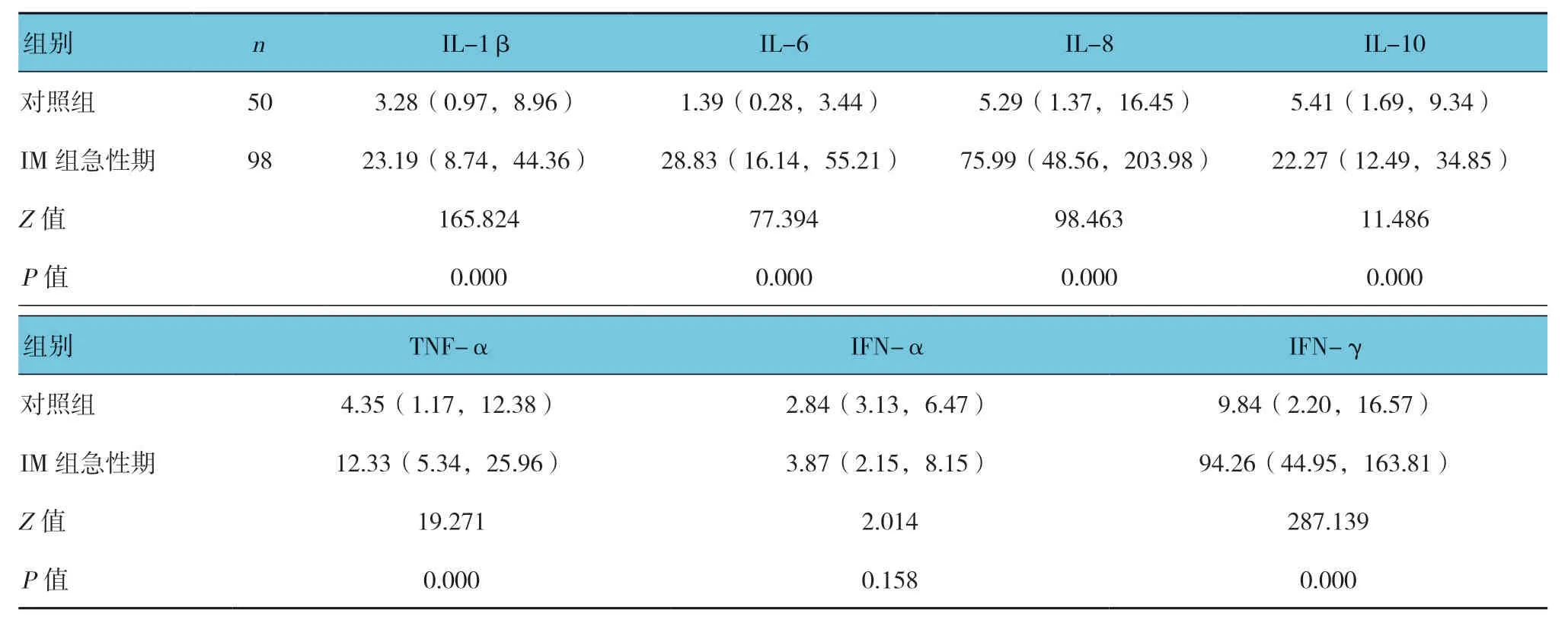
表3 两组外周血清细胞因子水平比较 [pg/ml,M(P25,P75)]
表4 两组外周血PMBCs 中TLR7和TLR9 mRNA相对表达量比较 (±s)
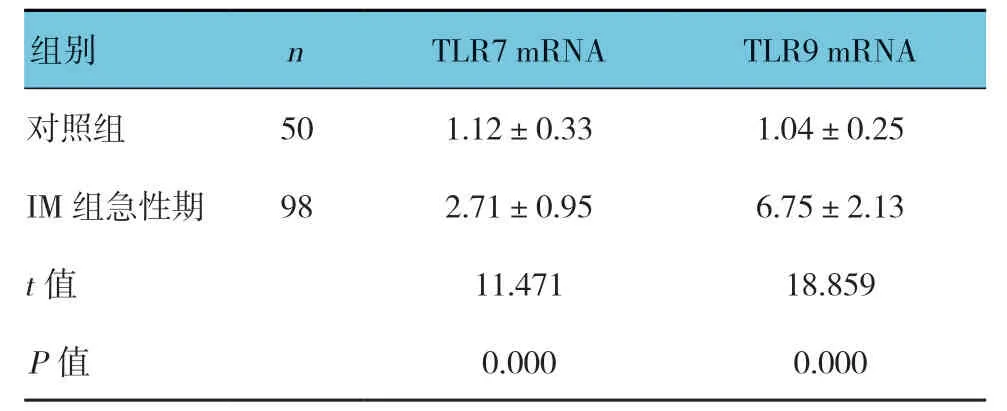
表4 两组外周血PMBCs 中TLR7和TLR9 mRNA相对表达量比较 (±s)
组别 n TLR7 mRNA TLR9 mRNA对照组 50 1.12±0.33 1.04±0.25 IM组急性期 98 2.71±0.95 6.75±2.13 t值 11.471 18.859 P值 0.000 0.000
表5 急性期与恢复期患儿外周血淋巴细胞亚群比较 (n=98,%,±s)

表5 急性期与恢复期患儿外周血淋巴细胞亚群比较 (n=98,%,±s)
时间 CD3+ CD4+ CD8+ CD19+ CD16+56+急性期 82.17±5.78 17.45±5.97 55.16±10.81 6.94±3.76 7.34±3.81恢复期 73.53±7.56 27.57±7.31 40.34±8.65 12.69±4.10 12.75±5.02 t值 8.742 17.328 10.436 13.208 9.236 P值 0.000 0.000 0.002 0.000 0.000
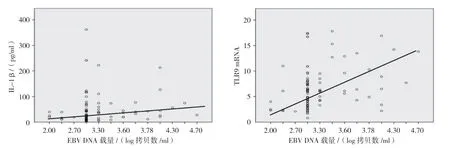
图1 IM患儿急性期EBV DNA载量与IL-1β、TLR9 mRNA的相关性

表6 急性期与恢复期患儿外周血清细胞因子水平比较 [n =98,pg/ml,M(P25,P75)]
表7 急性期与恢复期患儿外周血PMBCs 中TLRs mRNA相对表达量比较 (n=98,±s)
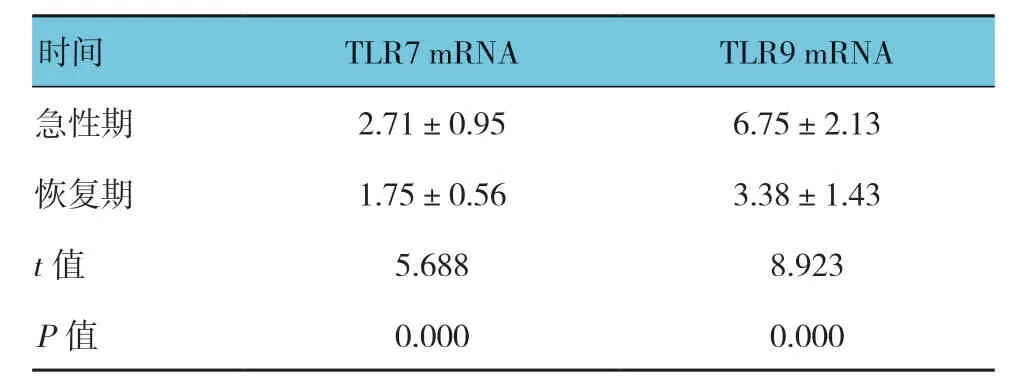
表7 急性期与恢复期患儿外周血PMBCs 中TLRs mRNA相对表达量比较 (n=98,±s)
时间 TLR7 mRNA TLR9 mRNA急性期 2.71±0.95 6.75±2.13恢复期 1.75±0.56 3.38±1.43 t值 5.688 8.923 P值 0.000 0.000
3 讨论
EBV感染在学龄前儿童中较为常见,易引起多种急性传染性疾病,其中IM 较为常见。蓝仙娥等[8]对25 185例学龄前儿童的血液标本进行EBV-EBNA1 IgG和EBV-VCA IgG 抗体检测,发现EBV 累积感染率为48.80%,其中IM患病率为7.90%。虽然IM 属于自限性疾病,预后良好,但是由于儿童机体免疫系统尚未发育完全,极少数患儿可能会伴发周围神经炎、脑膜炎、肝损伤等疾病[9],机体不同免疫状态感染EBV 导致IM的转归和预后也存在较大差异。
EBV属于嗜B淋巴细胞DNA病毒,由于B淋巴细胞表面存在EBV受体,因此EBV 进入宿主体内后,主要附着于B淋巴细胞中。在感染潜伏期,EBVEBNA2可驱动B细胞大量增殖并分化成为记忆B细胞,但此时B淋巴细胞并不表达EBV 核蛋白,故EBV无自我复制能力。随着EBV感染的进展,携带EBV的B淋巴细胞在外周血中大量增殖,可诱导机体固有免疫应答清除大部分EBV 阳性B淋巴细胞,但是仍有极少部分B淋巴细胞逃避机体免疫系统的攻击,分化成浆细胞,释放出病毒颗粒,此时EBV感染进入急性期,逐渐表现出颈部淋巴结肿大、咽痛、扁桃体肿大、发热、皮疹等临床症状[10]。CD19是B淋巴细胞表面的特异性糖基化跨膜蛋白标志分子[11]。本研究结果表明,IM急性期患儿CD19+较对照组降低,但是与EBV-DNA载量无直接关系,说明B淋巴细胞在EBV急性期并不能直接反映EBV的复制情况。这主要是由于绝大多数EBV 阳性B细胞被CTL 杀伤破坏,只有极少数B细胞被激活,进而刺激T淋巴细胞的活化和增殖,刺激机体发生获得性免疫应答。因此,在本研究中,IM急性期患儿CD3+和CD8+升高,同时CD4+降低。有研究提出,CD4+细胞不仅可以协助B细胞产生抗体,中和抗原,还能够诱导和维持CD8+细胞发挥细胞毒作用,进而影响EBV 阳性B细胞增殖,例如在CD4+细胞缺失时,CD8+细胞对EBV 阳性B细胞增殖的抑制作用不明显[12]。IM急性期患儿体内EBV 特异性CD4+细胞占血液循环CD4+细胞的1%左右,EBV特异性CD4+细胞可产生功能性细胞因子,进而抑制EBV诱导的B细胞转化;此外还可诱导特异性CD8+细胞识别EBV 裂解期抗原,进而杀伤EBV 阳性B细胞。与潜伏期相比,EBV 特异性CD8+细胞显著增殖,通过分泌穿孔素/颗粒酶直接杀伤感染EBV的B淋巴细胞,或通过肿瘤坏死因子途径诱导EBV感染的B淋巴细胞凋亡。当IM患儿进入恢复期后,CD4+升高,CD8+降低,说明机体免疫功能逐渐恢复正常,同时可避免效应T细胞的过度增殖,以及细胞因子大量分泌对机体造成的过度免疫损伤[13]。
此外,EBV在B淋巴细胞中建立潜伏感染后,树突状细胞、自然杀伤细胞均被激活,其表面TLRs可识别EBV 膜蛋白,并将信号传递给细胞内的各类接头分子,进而激活下游炎症因子,例如浆细胞样树突状细胞通过TLR9分子识别EBV 颗粒中的线性病毒DNA,而髓样树突状细胞则可通过TLR7 识别EBV 衍生的单链RNA,向初始T淋巴细胞传递EBV 抗原,并刺激初始T淋巴细胞分化为CTL、辅助性T细胞、调节性T细胞等,进而启动获得性免疫应答[14]。炎症反应与免疫破坏协同作用,可能是导致IM 预后不良的重要原因。本研究结果表明,IM急性期患儿外周血PBMC 中TLR7和TLR9 mRNA相对表达量显著升高,说明EBV感染可通过激活TLR7或TLR9 mRNA表达,使宿主B细胞存活,并借助细胞因子逃避宿主的免疫杀伤作用。EBV 除了通过影响TLRs的表达及信号传递影响B细胞增殖以外,还可以通过影响下游细胞因子的分泌,干扰机体抗病毒能力。在本研究中,IM急性期患儿血清IL-1β、IL-6、IL-8、IL-10、TNF-α、IFN-γ水平升高,也进一步证实EBV感染可通过TLRs信号通路诱发机体炎症反应,并且协助EBV的免疫逃逸。而患儿进入恢复期后,TLR7和TLR9 mRNA相对表达量降低,外周血淋巴细胞亚群逐渐恢复正常。VALENTE 等[15]研究证实,上调TLR7和TLR9 可促进干扰素调节因子IRF7的产生,进而激活EBVLMP1基因的表达。而IRF7与EBV 阳性B淋巴细胞的分化和增殖密切相关,因而干扰TLR7或TLR9 mRNA的表达有望成为治疗EBV感染的重要方法。
综上所述,IM患儿机体免疫系统、炎症反应及TLRs信号通路都与疾病的发生和转归有关,监测IM患儿不同时期外周血淋巴细胞亚群、细胞因子、TLR7和TLR9 mRNA变化,尤其是血清IL-1β和TLR9 mRNA的表达,有助于及时了解IM患儿的免疫状态及病情发展,为临床治疗提供一定的参考。
