3例不同病因所致TSH正常或增高型甲亢的临床特点与诊治分析并文献复习
2020-09-24宋明强王海静
宋明强 王海静
山东大学附属威海市立医院内分泌代谢病科,威海 264200
促甲状腺激素(TSH)正常或增高型甲状腺功能亢进症(甲亢)在临床上较为少见,它通常源于3种不同的原因:原位TSH分泌垂体瘤、异位TSH分泌垂体瘤和甲状腺激素抵抗综合征。2009年以来笔者先后收治了以上3种不同原因导致的甲亢病例,现基于代表3种不同病因类型所致的TSH正常或增高型甲亢病例,就其诊断与鉴别诊断过程进行如下汇总与分析。
1 病例介绍

病例1:原位TSH分泌垂体瘤(TSH-secreting pituitary adenomas in situ, STSH-oma),男,61岁。因多汗、心悸、体力困乏3年余,于2018年7月26日就诊山东大学附属威海市立医院。首诊检查:血清FT3>30(正常3.5~6.5) pmol/L,FT471.22(正常9~19.04)pmol/L, TSH 0.121(正常0.49~4.91) mIU/L,诊断为甲亢,始用甲巯咪唑10 mg,tid,po治疗。初始治疗3个月后,FT3、FT4降至正常,TSH 3.213 mIU/L。但在药物规律减量过程中出现甲状腺激素水平再度升高。患者抱怨其治疗效果不如周围其他甲亢患者。笔者发现患者在2015—2018年几乎每月1次共43次的甲状腺功能检查数据中,在高甲状腺激素状态下TSH均未得到充分抑制,多数呈现正常或增高。即使在甲状腺激素水平严重升高时依然如此。而在依次分布于4年中的5次前后间隔均为5~7个月的血清FT3和FT4均正常的甲状腺功能数据中,对应的血清TSH测定值依次为3.21、8.06、8.49、10.57和13.09 mIU/L,即在抗甲状腺药物使FT3和FT4降至正常时,随时间推移,TSH呈现进行性升高。病后无鼻塞、头疼及突眼,视力正常。家族中无甲亢患者。查体:脉搏89次/min, 血压 140/88 mmHg(1 mmHg=0.133 kPa)。体型消瘦,皮肤多汗。无突眼,甲状腺无明显肿大。双肺正常,心率89次/min,节律整齐,无杂音。腹部及四肢未见异常。血常规、肝、肾功能、电解质及血脂正常。甲状腺功能及相关抗体:FT312.47 pmol/L、FT435.35 pmol/L、TSH 4.676 mIU/L,促甲状腺激素受体抗体(TRAb)、甲状腺过氧化物酶抗体(TPOAb)正常;性激素6项及促肾上腺皮质激素(ACTH)正常。神经元特异性烯醇化物(NSE)16.8(正常0~17) μg/L。生长抑素抑制试验:24 h抑制率为80.67%。门诊鼻内窥镜检查:鼻咽部未见异常;甲状腺超声:甲状腺大小及形态正常,右叶下极背侧可见7.5 cm×8.3 cm×5.9 cm与6.5 cm×6.3 cm×5.1 mm两个等回声结节,边界清晰,形态规则。垂体MRI:鞍区占位,见图1中 Case1-A和Case1-B。术前诊断:原位TSH分泌垂体瘤。患者于术前采用奥曲肽100 μg, q 8 h,ih进行术前准备,术前TSH降至0.663 mIU/L,FT39.14 pmol/L,FT429.59 pmol/L。手术采用经鼻蝶垂体瘤切除术。瘤体病理组织学发现:肿瘤体积2.0 cm×2.0 cm×1.5 cm,组织呈灰红色,细胞丰富,增生活跃。免疫组化显示:TSH(+)、催乳素部分(+)、ACTH(-)、P53(﹤25+)、Ki(3%+)。术后次日TSH正常(0.663 mIU/L),FT311.53 pmol/L,FT444.88 pmol/L,仍处较高水平。术后11日FT3、FT4降至正常,TSH 0.093 mIU/L。术后5个月随访:TSH 0.708 mIU/L,FT34.80 pmol/L,FT418.15 pmol/L,完全正常。诊断:STSH-oma。
病例2:异位TSH分泌垂体瘤(ectopic TSH-secreting pituitary adenoma,ETSH-oma),男,41岁。 因多汗、心悸、消瘦两个月于半年前就诊于当地医院,体检发现有心房纤颤。甲状腺功能检测:血清FT324.08(2.8~7.1)pmol/L、FT475.73(12~22) pmol/L、TSH 7.26 (0.27~4.20) mIU/L,诊断为甲亢伴发心房纤颤。给予丙基硫氧嘧啶300 mg/d持续强化治疗,并口服心得安或心律平,1个月后心脏转为窦性心律,半年后FT311.54 pmol/L、FT427.09 pmol/L、TSH 14.08 mIU/L。提示甲状腺激素水平并未恢复正常,且TSH进一步升高。2009年9月转诊山东大学附属威海市立医院。患者无突眼,甲状腺Ⅱ°肿大,触诊无结节感,质地中等。肺部正常,心率100次/min,心音强弱不等,心律绝对不齐。腹部检查未见异常。肢体近端肌群无萎缩,双手平举轻度震颤。实验室检查:FT314.30 pmol/L、FT429.86 pmol/L、TSH 5.72 mIU/L;甲状腺球蛋白抗体(TGAb)<30%,甲状腺微粒体抗体(TMAb)<15%,生长激素 0.7(<5.0) μg/L,催乳素14.9(4.1~18.4) μg/L,NSE 22.31(<16.3 μg/L)。善宁抑制试验提示:TSH可被抑制到基础值的30.8%,促甲状腺激素释放激素(TRH) 兴奋试验:TSH不被兴奋 (TSH较基础值增加<2 mIU/L)(TRH由上海利珠东丰生物科技有限公司提供)。垂体MRI平扫蝶鞍区未见异常。头颅CT见于鼻咽顶部正中可见一分叶状软组织密度影,向鼻咽部气道突出,病灶呈不均匀强化,最大横截面积约1.9 cm×1.7 cm,边界清楚,见图1中Case2-A和Case2-B。ECT显示甲状腺摄锝功能增强。综合分析考虑异位TSH分泌垂体瘤。2009年11月20日以“鼻咽部肿物(可疑异位TSH分泌瘤?)”在威海市立医院耳鼻喉科行鼻中隔及鼻咽部区域肿物切除术。病理报告:鼻咽顶部垂体腺瘤,浸润性,累及骨组织。镜检:瘤组织位于鼻黏膜(假复层柱状纤毛上皮)下,无包膜,组织内肿瘤细胞弥漫分布,在黏膜及纤维组织间浸润性生长,瘤组织呈弥漫实性团块及窦隙状排列。细胞形态不规则,多数呈圆形、多角形,部分呈梭形,胞浆较丰富,并见微细颗粒,有的胞浆透明,核圆形及卵圆形,部分偏位,染色质纤细,可见核仁。肿瘤细胞免疫组化示:TSH(+)、生长激素弱(+)。电镜检查:细胞胞质内可见散在分布电子致密颗粒,颗粒直径约0.1~0.2 μm,圆形,无被膜,局部成簇分布。患者术前甲状腺功能FT316.07 pmol/L,FT430.28 pmol/L,TSH 6.39 mIU/L。术后次日FT34.85 pmol/L,FT413.54 pmol/L,TSH 1.86 mIU/L,甲状腺激素和TSH浓度均恢复正常。随访9年未见复发。
病例3:甲状腺激素抵抗综合征(thyroid hormone resistance syndrome,RTH),男,47岁,甲状腺肿大伴心悸、多汗与乏力7年就诊山东大学附属威海市立医院,7年前曾因心房纤颤和心绞痛于当地医院检查发现患有高脂血症,冠状动脉CT显示前降支重度狭窄而给予冠状动脉支架植入术。术后心绞痛缓解,心房纤颤持续。转诊北京阜外医院发现患者血清FT3、FT4严重升高,证实存在甲亢。始用甲巯咪唑治疗,持续治疗1年余,病情依旧时轻时重,反复无常。尤其在活动及饮酒后症状明显加重。自诉每在服用甲巯咪唑后,TSH水平升高明显,多次复查FT3、 FT4,均处升高状态,甲巯脒唑足量强化治疗也很难降至正常。平时无怕冷和便秘症状。患者自幼注意力不易集中,计算力低下、数学成绩较差。家族史:其父身材偏矮小(身高155 cm), 自诉容易困乏,反应相对迟缓,上学数学成绩差。患者身高:168 cm,体重74 kg,体重指数:26.21 kg/m2。血压125/82 mmHg,眼球无突出,甲状腺Ⅱ°肿大,质软,无结节感,甲状腺血管杂音(—),双肺正常,心率90次/min,节律不齐,心音强弱不一,无杂音。腹检正常。双手无震颤,下肢无水肿。实验室检查:谷草转氨酶35.2(正常0~33)U/L、血尿酸481(正常102~416)μmol/L、甘油三酯3.35 (0~2.30)mmol/L、总胆固醇6.49(正常3.10~5.20)mmol/L、NSE 6.0(正常<16.3) μg/L、催乳素 6.00(正常5.18~26.53)μg/L、生长激素2.35(0.16~26.00)mIU/L。生长抑素抑制试验:被抑制率为54.34%。甲状腺超声:双侧甲状腺体积增大,形态饱满,无结节,血流正常。甲状腺99mTc-O4显像:摄锝功能增强。头颅CT(平扫+增强):鼻咽部和垂体未见占位性病变未见异常。因心脏支架未做垂体MRI检查。心脏彩超示节段性的室壁运动异常、左房增大、二尖瓣少量返流、心率失常。双耳电测听:正常。家族成员筛查:父亲FT3、FT4轻中度增高,TSH 1.58 mIU/L。患者及其亲属基因检测发现其本人与父亲均为甲状腺激素受体(TR)β基因第10外显子的第453位密码子存在点突变(杂合子突变),密码子由CCT突变为ACT,编码的氨基酸由脯氨酸变为苏氨酸(P453T),见图1中Case-3。
2 讨论
本文报道的3例TSH正常或增高型甲亢病例各自在病因学上均属少见。其发病机制互有差异或不同,各自可分别代表一个类型。但3例具有共同的临床表现,均以高甲状腺激素水平引起的高代谢症候群而就诊,因此三者需要病因学鉴别。病例1和2除外因瘤体发生部位不同所致的占位效应不同以外,其垂体瘤产生的激素过多效应基本相同。病例3未见原位和异位垂体占位,家族史阳性,其父亲同为“正常TSH型甲亢”表现,经基因定位证实为患者及父亲均为TRβ基因突变所致的RTH。笔者于2014年就“TSH正常或增高型甲亢”提出过诊断与鉴别诊断流程[1]。近5年来,随着3种类型的病例报道数量逐渐增加和诊断经验的积累,原鉴别诊断流程显现出一定的缺陷,为此,笔者对其重新做了调整,见图2。
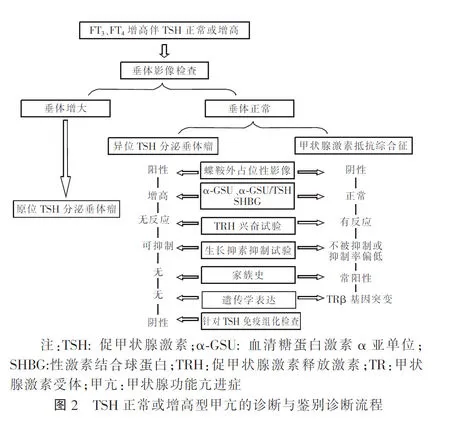
STSH-oma指原发于鞍内垂体的TSH分泌垂体瘤,它是临床上TSH正常或增高型甲亢的相当少见的原因之一,有报道仅占所有垂体瘤的0.5%~3.0%[2]。1960年由Jailer和Holub[3]首次描述,1981年施法兴[4]在国内率先报道。最近范晓静等[5]研究显示,我国在1981至2017年共有153例资料较为完整的TSH分泌垂体瘤被报道。该疾病的主要诊断依据有:(1)高甲状腺激素水平的同时,TSH不能被增高的甲状腺激素充分抑制。(2)鞍内垂体影像(CT或MRI)可见微腺瘤或大腺瘤。(3)垂体瘤切除后甲状腺激素水平和TSH可相继恢复正常。肿瘤免疫组化TSH阳性可进一步确定瘤体的性质。病例1从起病到确诊经历了近4年时间,导致延误诊断的原因可能是源于初诊时TSH呈现部分抑制,抗甲状腺药物治疗有效,对医生造成了误导。值得临床医师反省的则是该例即使初诊FT3、FT4严重升高时,TSH并没有被充分抑制,包括在以后的多次检测中均显示TSH的受抑制率与FT3、FT4增高的程度不成比例,甚至高于正常。有报告显示,原发性甲亢患者应用第3代TSH检测试剂盒测得的TSH值往往<0.01 mIU/L[6]。该例另一重要的特征是,在近4年病程中有5次间隔时间均为5~7个月的甲状腺功能检测数据均表现为游离甲状腺激素水平正常(甲巯咪唑强化治疗下),而TSH确随时间推移呈现逐年或逐月升高(由3.21 mIU/L升高至13.09 mIU/L)趋势。这些特征可由垂体TSH分泌瘤的渐进性增大得到合理的解释。
ETSH-oma是指发生于蝶鞍之外并与鞍内垂体缺乏任何联系的TSH分泌垂体瘤。该患者除因瘤体发生于鼻咽部,就诊时出现鼻塞症状之外,其他临床表现如同STSH-oma。但相对于STSH-oma的发病更为罕见。1996年Cooper等对ETSH-oma进行了首次描述,截止到2018年12月31日,笔者从英、中文数据库中仅检索到8例(包括笔者的病例)有功能的ETSH-oma[7-14]。其中7例瘤体发生于鼻咽部,仅1例发生于另外的部位鞍上区,这正是该类型接诊时往往有鼻塞症状的原因。
RTH是由于靶器官对甲状腺激素的反应性降低而引起的一种临床综合征。该文所报病例经家系调查和基因测序证实为TRβ基因突变所致的RTH[6]。患者及其父亲均为受累者,其基因突变位点为TRβ基因第10号外显子(点突变):c.1357C>A(p.Pro453Thr)见图3中Case-3。SRTH临床上同样非常少见,1967年Refetoff等[15]最先报道,也称Refetoff综合征,患病率大约为1/50 000~1/40 000[16-17]。该疾病临床上大体可分为3个类型[18-19]:(1)全身性型(generalized resistance to thyroid hormone,GRTH),患者全身组织对甲状腺激素抵抗基本一致,临床表现为甲状腺功能减退症或正常而缺乏甲亢表现。(2)选择性垂体型(selective pituitary resistance to thyroid hormone,PRTH),患者下丘脑和中枢组织对甲状腺激素的敏感性低于外周组织,所以可有不同程度的甲亢症状。(3)选择性外周型(peripheral tissue resistance to thyroid hormone,Per-RTH),为外周组织或细胞对甲状腺激素产生抵抗,患者临床表现为明显的甲状腺功能减退症症状和体征,血循环中FT3、FT4和TSH均可正常或升高。而本研究病例却表现为选择性垂体与外周抵抗的混合存在,既有垂体的抵抗,TSH不能按比例地受到抑制,同时外周脂代谢方面也表现出明显抵抗,呈现长期的高胆固醇血症,使患者很早就出现了冠状动脉狭窄和心肌缺血的表现。
STSH-oma和ETSH-oma因分别存在原位或异位垂体占位,只要能够想到,确诊过程并不复杂,借助于垂体和颅脑MRI或CT检查,常能很快发现病灶的部位。而SRTH有时诊断则相对复杂,尤其在合并TSH分泌垂体瘤时更是如此,二者合并存在的患者,在手术切除垂体瘤后会依然存在甲状腺激素抵抗,其血清FT3、FT4水平仍然会高于正常[20]。3例中SRTH患者发病到确诊所经历的时间最长,达84个月。SRTH确诊最直接的方法是通过基因诊断,绝大多数RTH是常染色体显性遗传的家族性疾病。研究显示85%的RTH主要由TRβ基因突变所致,突变的TRβ和T3的亲和力大大降低并干扰正常TRɑ和TRβ的功能。但因患者TRβ基因缺陷的严重程度及各靶器官对甲状腺激素的依赖性和反应性常常不同,导致了该疾病的临床表现呈现高度异质性。而且并非所有患者都能检测到TRβ基因的突变。非TRβ基因突变型原因可占15%左右,这部分病例常常会使诊断难以确立。因此尚需要借助于其他诊断措施以补充作为以上3类疾病的鉴别诊断依据:(1)性激素结合球蛋白(SHBG)测定:该蛋白是体内一种结合性激素甾体球蛋白,生理情况下,其在肝脏合成,可受甲状腺激素、雌二醇对其促进合成的作用调控。在RTH患者中,由于存在甲状腺激素抵抗,在甲状腺激素升高的情况下,依然不能使血中SHGB水平明显升高。(2)血清NSE测定:NSE是神经内分泌细胞的胞浆标志物,几乎在所有神经内分泌肿瘤细胞中表达,且与神经内分泌肿瘤细胞的数量呈正相关[21]。本研究中的STSH-oma和ETSH-oma患者血清NSE水平分别处于正常值的高限和高于正常,此与垂体瘤的存在相一致。而SRTH患者测定值正常。(3)功能试验的应用:理论上TRH兴奋试验和T3抑制试验是较为理想的鉴别试验。TSH分泌垂体瘤多数不被TRH兴奋,而RTH则易被兴奋。实践中虽然存在试验结果的个体差异[22],但在范晓静等[5]汇总的研究报告中显示,22例TSH瘤患者的TRH兴奋试验中有21例表现为无反应或仅为低弱反应,其特异性是高的。但TRH药品问题尚未解决[23],多数医院难能将其列为常规检查。T3抑制试验仅上海瑞金医院在国内最先报了具体的试验方法[24],且试验因在老年和冠心病患者属于禁忌,因此临床应用者很少。生长抑素抑制试验是基于TSH瘤表面存在的生长抑素受体(SSTR2和SSTR5)表达高于其他垂体腺瘤来设计的[25],药物普及,使用上并无显著禁忌要求,较易临床常规使用。只是在TSH瘤与RTH的应用结果上存在着相当程度的重叠,其特异性并非太高,但作为辅助诊断方法还是具有一定价值的。本文报道的3例患者全部采用了该试验,其在STSH-oma、ETSH-oma和RTH的抑制率依次为80.6%、69.2%和54.34%,后者明显低于前两者的抑制率。总体讲,与患者的诊断是一致的。但目前生长抑素抑制试验的结果判断标准尚不统一[5]。(4)血清糖蛋白激素α-亚单位(α-GSU)和α-GSU/TSH比值的测定:有研究表明,导致甲亢的垂体TSH分泌瘤由2种细胞组成:一种分泌α-GSU,另一种同时分泌α-GSU和TSH,即α-GSU与TSH不是等分子分泌的,因此二者的测定值均可显示增高[26]。据报道70%垂体TSH瘤患者血清α-GSU升高,80%血清α-GSU/TSH比值升高,而理论上讲在SRTH中是不应升高的[27-28]。因此,α-GSU和α-GSU/TSH比值的测定在用于TSH瘤与RTH的鉴别中是有意义的。
STSH-oma、ETSH-oma主要通过手术切除瘤体病灶,对术前准备或瘤体难以切除完全时也可分别采用短效和长效生长抑素治疗。本研究中的前两例术后均显示完全治愈,其中ETSH-oma至今已随访近10年未见复发。RTH较为有效的治疗是三碘甲腺乙酸,因其与TRβ的亲和力明显高于T3,可有效抑制TSH水平,减少T3、T4的分泌。而其本身的生物活性低下,对代谢影响较小。本研究病例目前主要依靠β肾上腺素能受体阻滞剂和持续的降脂治疗分别控制心脏的异常表现和高脂血症。
总之,在日常的甲亢诊疗工作中,对于TSH正常或增高型甲亢的病例要时刻想到以上3种病因的可能,做好诊断和鉴别诊断。
