淫羊藿总黄酮对干眼症雄兔泪腺中Bax和Bcl-2表达的作用研究△
2020-09-24王方万咪咪乐艳芝王翰墨杜莎莎张兴菊
王方 万咪咪 乐艳芝 王翰墨 杜莎莎 张兴菊
据统计,全球5%~34%的人口受到干眼的困扰,而老年人已成为受干眼困扰的最大群体,干眼造成的各种临床症状已明显影响了患者日常生活[1]。老年人干眼症发病的原因复杂多样,与基础疾病的发生、解剖结构的改变、泪液分泌量的减少、睑板腺功能障碍等均有关联,其中因年龄增加或绝经等原因致使的雄激素缺乏导致的干眼症逐渐引起了关注[2]。目前研究发现,雄激素受体存在于人及动物的泪腺、睑板腺以及结膜中,雄激素可有效避免泪腺炎症反应,加速细胞的新陈代谢,而雄激素的缺乏则与眼表稳态的破坏息息相关[3-4]。研究证实,雄激素替代疗法能增加泪液分泌量并延长泪膜破裂时间(BUT),有助于维持泪膜的稳定性[5]。还有研究证实,可拟雄激素的黄酮类化合物可以减少细胞凋亡[6]。而早在《本草纲目》中就被记载可以治疗眼疾的淫羊藿提取物就有总黄酮的成分,由此我们推测,可以通过淫羊藿总黄酮的拟雄激素作用治疗干眼症。因此,本实验基于干眼症雄兔观察淫羊藿总黄酮对泪腺Bax和Bcl-2表达的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物健康1个月龄、体质量2.0~2.5 kg的雄性新西兰大耳白兔80只(SPF级,远交系)。
1.1.2 实验仪器与试剂SDS-PAGE电泳仪和湿法转膜仪(美国Bio-Rad公司)、脱色摇床(TY-80R,金坛市医疗仪器厂)、Tanon5200化学发光检测系统(海天能科技有限公司)。丙烯酰胺、亚甲丙烯酰胺、Tris-base、过硫酸铵、TEMED、甘氨酸、SDS(上海阿拉丁生化;PVDF膜(Millipore)、ECL发光液(Thermo)、BCA蛋白浓度测定试剂盒(增强型)(碧云天)、甲醇(分析纯,南京化学试剂厂)、HCl(分析纯,南京化学试剂厂)、淫羊藿总黄酮提取物(98.13% 朝藿定A、99.94% 淫羊藿苷,成都曼思特生物公司)。
1.2 方法
1.2.1 分组及给药方式随机将大耳白兔分为A组(空白组)、B组(手术组)、C组(淫羊藿总黄酮组)、D组(雄激素组),每组20只。A组以生理盐水灌胃进行干预,每天一次,每次2 mL;B、C、D三组通过去除雄兔双侧睾丸与附睾建立干眼症模型后分别以生理盐水灌胃(每天一次,剂量为2 mL)、淫羊藿总黄酮灌胃(每天一次,剂量为0.06 g·kg-1)、丙酸睾酮肌肉注射(每天一次,剂量为0.25 mg·kg-1)进行干预。每组根据喂养时间不同又分为A1~D1组(喂养1个月)和A2~D2组(喂养2个月),每组10只。
1.2.2 干眼症雄兔动物模型建立方法B、C、D三组新西兰大耳雄兔摘除双侧睾丸及附睾:术前禁食水,30 g·L-1戊巴比妥钠以50 mg·kg-1的剂量腹腔注射,待雄兔麻醉后仰卧并固定,碘伏消毒手术区域,铺单,在阴囊中部做一2 cm的竖行切口,分离双侧睾丸包膜,将睾丸挤出后结扎睾丸动脉及输精管,切除睾丸,缝合皮肤。术后3 d肌肉注射青霉素(200×103U·kg-1)预防术后感染。
1.2.3 眼表检查及诊断A1~D1组雄兔于造模前及造模后2周、4周时,A2~D2组雄兔于造模后6周及最后一次给药后分别进行泪液分泌实验(Schirmer Ⅰ test,SIT)和BUT检查,检查标准参照文献[7]的标准。所有操作均由同一人进行,要求所有兔被检查的时刻、位置、光线、湿度及温度均一致。
1.2.4 Western blot检测各组凋亡相关因子Bax、Bcl-2蛋白的表达A1~D1组及A2~D2组分别在干预1个月、2个月后,于最后一次给药结束后2 h,应用30 g·L-1戊巴比妥钠(50 mg·kg-1)腹腔内注射麻醉,使用空气栓塞法处死兔,即刻摘取泪腺,提取其上皮细胞RNA,使用Western blot法检测。Western blot法的具体操作如下:称取30 mg组织,混入500 μL RIPA裂解液,冰块上研磨至无明显沉淀后裂解30 min。完成后,转移至预先冷却的1.5 mL离心管(冰上操作)。4 ℃下12×106r·min-1离心5 min。吸取上清,即样品总蛋白,放于-20 ℃保存。根据碧云天BCA试剂盒测定蛋白浓度。根据需要分离蛋白的相对分子质量调配相应的分离、浓缩胶,4 ℃保存。将样品总蛋白与5×SDS上样缓冲液混合至1×的浓度,于沸水中煮5 min使蛋白变性后上样电泳。浓缩胶电压60 V下30 min,进入分离胶后电压80 V下电泳90 min。电泳后转至PVDF膜,常温转移到封闭液后在脱色摇床干预1 h。一抗孵育参照说明书按11000调配后于4 ℃孵育后用TBST液漂3遍,每次10 min。再将二抗用TBST按15000稀释,常温孵育2 h后TBST漂洗3次,每次10 min。用Thermo ECL进行化学发光按电化学发光,于Tanon凝胶成像仪下拍照,获取图片。得出目标条带Bax、Bcl-2光密度值与内参GAPDH光密度值的比值。
1.3 统计学方法使用SPSS 22.0统计学软件进行统计处理。实验检测指标的计量资料表示为均数±标准差,组间比较采用方差分析。检验水准:α=0.05。
2 结果
2.1 各组基础泪液分泌量比较造模前各组雄兔SIT值相比差异均无统计学意义(均为P>0.05)。造模后2周,B、C、D组SIT值开始减小,与A组相比差异均有统计学意义(均为P<0.05),且B组与C、D组两两相比差异均有显著统计学意义(均为P<0.01),随着实验进程,B、C组SIT值进一步减小,且B组SIT值小于C组,差异仍有显著统计学意义(P<0.01),D组SIT值变化不大,C、D组SIT值相比差异无统计学意义(P>0.05)(见表1)。
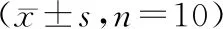
表1 各组基础泪液分泌量比较
2.2 各组泪膜稳定性比较造模前各组BUT值相比差异均无统计学意义(均为P>0.05)。造模后2周,B、C、D组BUT值开始减小,与A组相比差异均有统计学意义(均为P<0.05),且B组与C、D组相比差异均有显著统计学意义(均为P<0.01),随着实验进程,B、C、D组BUT值进一步减小,且B组BUT值小于C组,差异具有显著统计学意义(P<0.01),C组与D组BUT值相比差异无统计学意义(P>0.05)(见表2)。
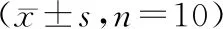
表2 各组泪膜稳定性比较
2.3 各组Bax蛋白相对表达量结果各组Bax蛋白表达量见图1。 Western blot检测结果显示,B组Bax蛋白表达高于C组、D组,差异均有显著统计学意义(均为P<0.01);C组Bax表达均高于D组,但差异均无统计学意义(均为P>0.05)(见表3)。B2组、C2组、D2组Bax/GAPDH值均分别小于B1组、C1组、D1组,差异均有统计学意义(均为P<0.05)(见表4)。以上结果说明,淫羊藿总黄酮可减少Bax在泪腺中的含量,其与雄激素的作用无明显区别,且随时间增加效果逐渐增强。
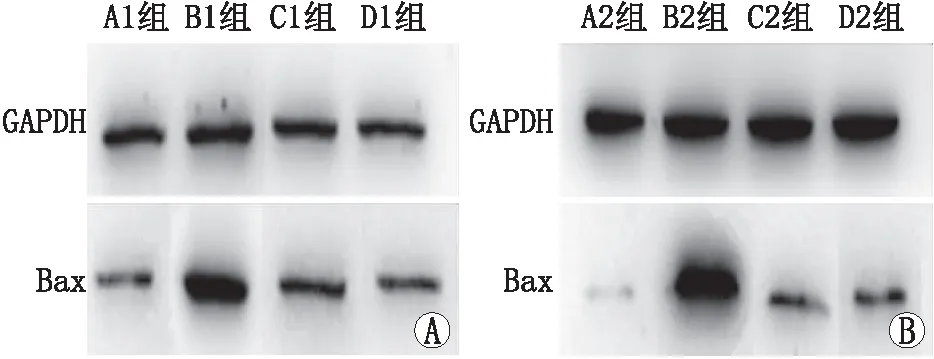
图1 各组泪腺中Bax蛋白表达结果A:A1~D1组泪腺中Bax蛋白表达结果;B:A2~D2组泪腺中Bax蛋白表达结果
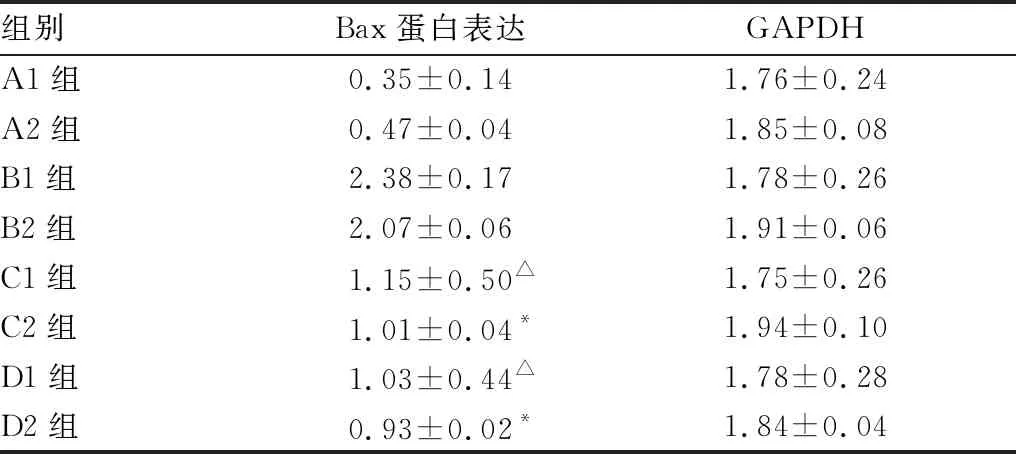
表3 各组Bax蛋白表达量
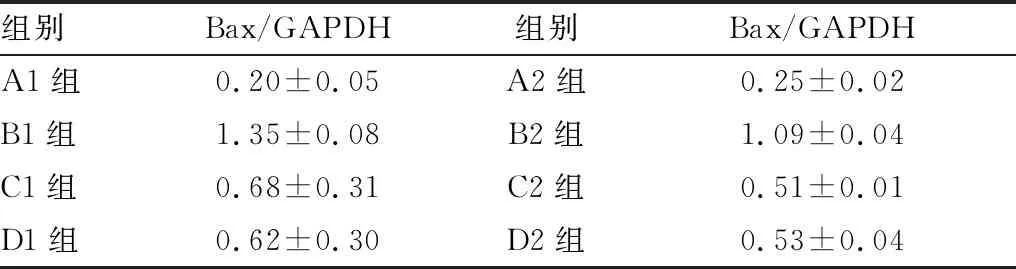
表4 各组Bax/GAPDH值
2.4 Bcl-2蛋白相对表达量结果各组Bcl-2蛋白表达量见图2。 Western blot检测结果显示,B组 Bcl-2 蛋白表达低于C组、D组,差异均有显著统计学意义(均为P<0.01);C1组Bcl-2表达低于D1组,差异有显著统计学意义(P<0.01);C2组Bcl-2 表达仍低于D2组,但差异无统计学意义(P>0.05)(见表5)。C2组较C1组Bcl-2/GAPDH值增加,差异有显著统计学意义(P<0.01);D2组较D1组Bcl-2/GAPDH值增加,差异有统计学意义(P<0.05)(见表6)。以上结果提示,淫羊藿总黄酮可提高泪腺中Bcl-2的蛋白含量,随时间增加与雄激素效果的差别逐步减小,且效果逐渐增强。
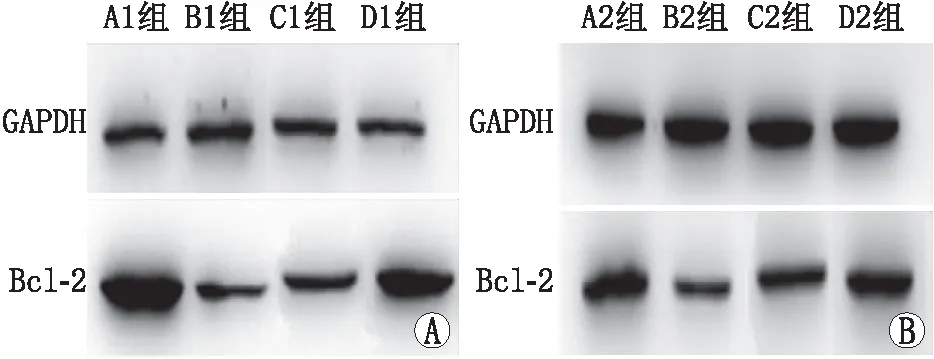
图2 各组泪腺中Bcl-2蛋白表达结果A:A1~D1组泪腺中Bcl-2蛋白表达结果;B:A2~D2组泪腺中Bcl-2蛋白表达结果
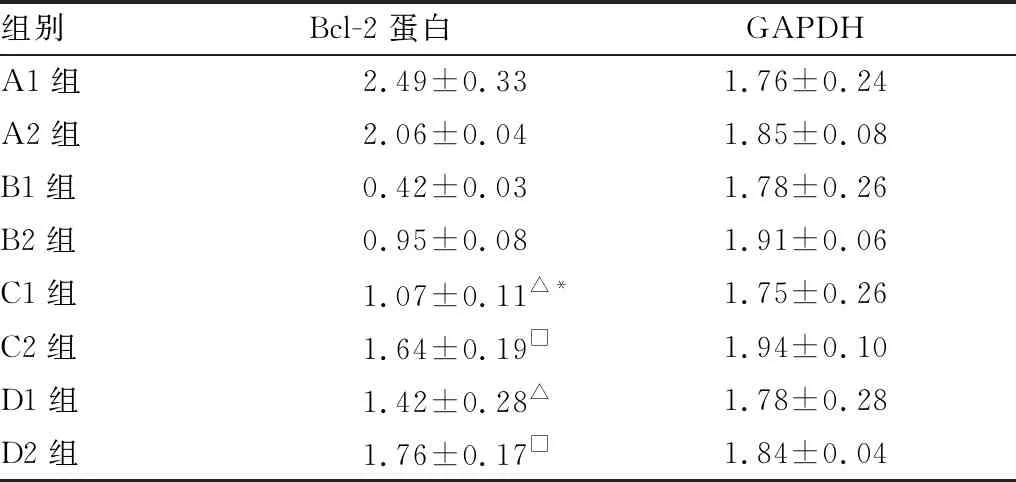
表5 各组Bcl-2蛋白表达量
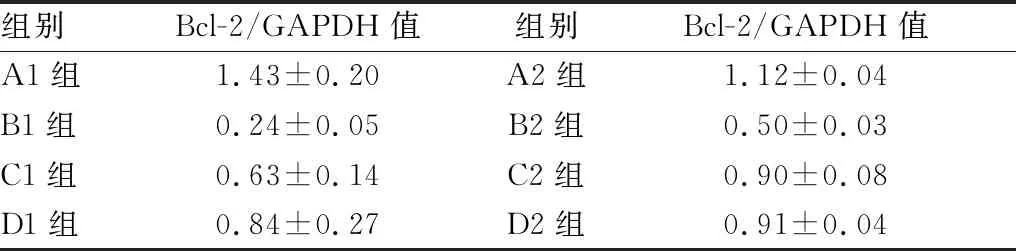
表6 各组Bcl-2/GAPDH值
3 讨论
眼部属于性激素作用的部位,泪腺、睑板腺及角膜等眼表组织均可见雄激素受体[8]。目前干眼的理论大多基于泪腺组织单位,其病变可见于细胞凋亡、组织破坏、炎症浸润,致使腺体分泌功能下降甚至丧失[9]。因此,有学者认为干眼症的起始因素之一很可能是雄激素的下降[10]。有研究显示,泪液分泌量与人体睾酮分泌水平呈正比,睾酮可抑制泪腺细胞的凋亡、坏死[11]。此外,低雄激素水平可加速Sjögren综合征的发展,并证实与泪腺炎症、重症干眼有关[12]。本实验结果显示,B组雄兔泪液分泌量减少,泪膜稳定性减低,由此可见,雄兔泪腺细胞的炎症、凋亡与去势导致的雄激素水平降低有直接关系,最终导致了干眼的形成。至少10个以上的基因构成了Bcl-2家族,它们对凋亡的调控是经构成同二聚体、异二聚体来实现的,Bcl-2和Bax是相对的一组控制凋亡的重要基因[13]。Bcl-2可提高细胞生存率,减少因各种原因诱导的细胞凋亡,Bax与Bcl-2功能相反,能够诱导细胞凋亡。 Bcl-2与Bax的比值及Bcl-2与Bax蛋白量的变化在细胞的生长与凋亡过程中起重要作用[14]。研究发现,使用雄激素后,在缓解兔泪腺炎症浸润的同时, Bax表达也同时降低,而Bcl-2、c-myb蛋白及雄激素受体mRNA都明显增加[15]。本实验结果也证实,B组雄兔的Bcl-2表达显著减少,Bax的表达显著升高,而C组与D组的Bcl-2的表达显著升高,Bax的表达显著减少。综上可知,干眼的形成脱离不了雄激素降低的因素,而因雄激素降低导致的泪腺细胞凋亡、坏死又与Bcl-2和Bax有着密不可分的关系。
迄今为止,雄激素替代是雄激素缺乏型干眼仅有的病因疗法,但长期使用雄激素会导致前列腺肥大、前列腺癌、女性男性化等副作用,给患者带来了长期的苦恼。因此,作为一个中医人,亟需从中药中找到可以替代雄激素的有效疗法。淫羊藿的根、叶、花和种子等部位含有与雄激素化学结构类似的杂环多酚类的黄酮类化合物,可起到模拟雄激素的效果。淫羊藿总黄酮是一种天然药物,资源丰富,分离提纯工艺成熟,且其疗效肯定[16]。过去,黄酮类化合物被明确证实有抗炎、抗氧化等效果,现代医学发现其可以刺激雄激素受体[17],可激活雄激素受体α与β的转录活性,表现出植物雄激素样作用,产生生物学效应[18],发挥拟雄激素效果[19],从而可以治疗某些与雄激素水平低下相关的疾病,如干眼症等。本实验结果显示,C1组和C2组均减缓了因雄激素水平降低导致的干眼的发展,使雄兔泪液分泌量增加,泪膜稳定,且C2组与D2组的疗效对比差异无统计学意义。可见,淫羊藿总黄酮疗效与雄激素相当,能够有效代替雄激素进行干眼症的治疗。
综上所述,淫羊藿总黄酮可通过抑制泪腺细胞凋亡而治疗因雄激素水平降低导致的干眼症,泪腺中Bcl-2表达上升、 Bax表达下降可能是其发挥治疗作用的机制之一。淫羊藿总黄酮可以开发为新的雄激素替代的中药,以避免使用西药进行干眼症治疗所带来的不良反应。以后可以进一步对淫羊藿总黄酮替代治疗的用量、剂型及疗程进行临床研究。同时干眼症的发病机制复杂,期待从干眼症发生的其他机制来研究淫羊藿总黄酮的治疗作用。
