不同提取方式对山楂叶多糖提取率和抗氧化活性的影响
2020-09-24李钊李宁宁王宇波陈松猛赵圣明马汉军
李钊,李宁宁,王宇波,陈松猛,赵圣明,马汉军
(河南科技学院食品学院,河南新乡453003)
山楂为蔷薇科山楂属植物,果实酸甜可口,有健胃消食、生津止渴的功效,在我国辽宁、河北、山东、江西、云南等地均有广泛栽培[1].山楂叶在我国的药用历史已有上千年,民间用其泡茶,有强心、降血脂、降血压、减肥、活血化瘀等功效[2].山楂叶的药用价值最早可见于东晋中医方剂著作《肘后方》中“茎叶煮汁,洗漆疮”的记载,《唐本草》《本草纲目》《中国药典》等书也记载有山楂叶的药理作用.现代药理研究表明,山楂叶富含黄酮类、多糖类、三萜类等多种活性成分,有理气通脉、化浊降脂、抗菌消炎等功效[3].
植物多糖具有免疫调节、抗氧化、抗衰老、镇痛、降糖降脂、抑菌、抗肿瘤等作用[4-7],在治疗糖尿病、抗肿瘤等临床治疗方面具有广阔的应用前景.随着山楂叶提取物在世界范围内广泛应用于心血管疾病的治疗[8],山楂叶的功能活性研究越来越深入.大量的动物体外实验验证了山楂叶黄酮具有抗血栓、降血脂、抗氧化、抗心肌缺血、抗动脉粥样硬化、强心等功能[9-10].山楂叶中多糖含量较高,而关于山楂叶多糖的研究报道相对较少,目前山楂叶多糖的功能活性研究仅局限于降血压、降血脂功效的研究报道[11],且国内关于提取工艺的相关研究也鲜有报道,前人的研究仅报道了常规热水提取法[12]和利用已提取过黄酮的山楂叶为原料,采用超声波法提取山楂叶多糖[13].传统热水提取法提取山楂叶多糖方法简单,使用仪器少,但多糖提取率较低.超声波具有能量大、能耗低、破碎能力强、不影响有效成分等特点;微波具有选择性强、适用范围广、省时高效、受热体系温度均匀、不产生噪声和污染等特点,这两项技术已经在快速稳定提取高纯度植物多糖等方面进行了广泛的应用[14].关于超声波和微波技术对提取山楂叶多糖是否具有良好的效果还不明晰.河南新乡南太行地区野生山楂资源丰富,研究山楂叶多糖的提取工艺,不仅可为山楂叶多糖功能活性的研究提供一定的基础,还可以变废为宝,开发山楂叶作为功能活性物质的新来源,满足日益增长的天然保健食品和天然保健药物的需求.本文以山楂叶干粉为原料,研究超声波提取、微波提取和热水提取3 种不同提取方式最佳提取工艺和对山楂叶多糖抗氧化活性的影响, 为山楂叶多糖的深化研究提供一定的参考依据.
1 材料与方法
1.1 材料与试剂
山楂叶,采自新乡太行山野生山楂树,2,2-联苯基-1-苦基肼基(DPPH),无水乙醇,硫酸亚铁(FeSO4),水杨酸,过氧化氢(H2O2),磷酸氢二钠,磷酸二氢钠,铁氰化钾,三氯乙酸,三氯化铁等化学药品均为国产分析纯.
1.2 主要仪器
HH-42 水浴锅,常州国华电器有限公司;PJ-04A 多功能粉碎机,海助邦贸易有限公司;PS-30AD 数控超声波清洗器,市洁康洗净电器有限公司;美的EV025LC7-NR 变频微波炉,佛山市顺德区美的微波炉电器制造有限公司;离心机,美国Beckman L-80-XP Ultracentrifuge;ShimadzuAUY120 电子天平,日本岛津公司;GZX-9240MBE 电热恒温鼓风干燥箱,上海博讯实业有限公司医疗设备厂;722N 型可见分光光度计,上海菁华科技仪器有限公司.
1.3 试验方法
1.3.1 山楂叶干粉的制备 选择色泽一致、大小均一、且无病虫害的山楂叶用蒸馏水洗净,阴干后放入50 ℃恒温干燥箱中干燥2 h,粉碎,得山楂叶粗粉备用.
1.3.2 热水浸提法 准确称取1 g 山楂叶干粉,按料液比为1:10、1:20、1:30(m:V)加入纯水混匀均匀后,分别在60 ℃、80 ℃、90 ℃温度条件下热水浸提3 h.浸提结束后将提取液在5 000 r/min 的转速下离心10 min,收集上清液.向上清液中加入3 倍体积无水乙醇进行醇沉,4 ℃放置过夜后,5 000 r/min 离心10 min 得沉淀物.加入少量体积的蒸馏水收集沉淀,在50 ℃恒温干燥箱中干燥得山楂叶粗多糖[15].每个样品重复3次,取平均值,确定最佳提取温度与料液比.

1.3.3 微波辅助水提法 准确称取1 g 山楂叶干粉,按料液比1:10、1:20、1:30(m:V),加入纯水混匀均匀后,放入微波炉中.微波功率分别设置为100 W、300 W、500 W,微波处理5 min 后,90 ℃热水浸提3 h[16].最后按照1.3.2 的方法离心、沉淀、干燥得山楂叶粗多糖,确定最佳提取料液比与功率.
1.3.4 超声波辅助水提法 准确称取1 g 山楂叶干粉,按料液比为1:10、1:20、1:30(m:V),加入纯水混匀均匀后,放入超声波仪器中,设置温度上限为50 ℃.超声波功率分别设置为50 W、80 W、100 W,超声波处理60 min 后,90 ℃热水浸提3 h.最后按照1.3.2 的方法离心、沉淀、干燥得山楂叶粗多糖[17],确定最佳提取料液比与功率.
1.3.5 山楂叶粗多糖的提取 准确称取山楂叶干粉20 g, 取不同提取方式的最优提取工艺进行山楂叶多糖的提取,浸提结束后将样液离心(5 000 r/min,10 min),将上清液收集.然后采用旋蒸仪将上清液体积浓缩至原来体积的1/4,再将3 倍体积无水乙醇加入到浓缩的上清液中进行醇沉,在4 ℃条件下放置12 h后,离心(5 000 r/min,10 min)得沉淀物[18].加入少量体积的蒸馏水溶解沉淀,沉淀溶解后,浓缩至一定的体积,分装至培养皿中,-20 ℃预冻后,真空冷冻干燥后得到山楂叶粗多糖.
1.3.6 不同提取方法山楂叶多糖对Fe3+还原力的测定[19]向2 mL 不同质量分数的样品溶液(0.03%,0.06%,0.09%,0.12%,0.15%)中加入2 mL 浓度为0.2 mol/L 的磷酸盐缓冲液(pH=6.6)和2 mL 质量分数为1%的铁氰化钾溶液,50 ℃水浴加热20 min 后再加入2 mL 质量分数为10%的三氯乙酸溶液, 混合均匀后经3 000 r/min 离心处理10 min,取上清液2 mL,加入2 mL 蒸馏水以及0.4 mL 质量分数为0.1%的三氯化铁溶液,室温反应10 min 后,测定其在700 nm 处的吸光值.每个样品做3 次重复试验取平均值.
1.3.7 不同提取方法山楂叶多糖DPPH 自由基清除能力的测定 向2 mL 不同质量分数的样品溶液(0.03%,0.06%,0.09%,0.12%,0.15%)加入 2 mL 浓度为 0.16 mmol/L 的 DPPH(DPPH 溶解在 95%的乙醇中)溶液,25℃水浴加热30 min 后,在517 nm 测得样液吸光度(Ai).以2 mL 蒸馏水代替上述体系中2 mL 样品测得空白吸光度(A0).同时以 2 mL 蒸馏水代替上述体系中 2 mL 的 DPPH 测得吸光度(Aj).Ai和Aj 每个质量浓度需要做3 个重复试验,A0 只需做3 个平行.最后计算清除率取平均值[20-21].
1.3.8 不同提取方法山楂叶多糖·OH 自由基清除能力的测定 在10 mL 比色管中按顺序加入2.0 mL 浓度为6 mmol/L 的FeSO4溶液,2.0 mL 浓度为 6 mmol/L 的水杨酸溶液,2.0 mL 浓度为 6 mmol/L 的H2O2溶液和2 mL 不同质量分数的样品溶液(0.03%,0.06%,0.09%,0.12%,0.15%)混合均匀,37 ℃水浴处理30 min后测定其在510 nm 处的吸光度(Ai),然后将体系中的样品改为加入2 mL 蒸馏水,测定其在510 nm处的吸光度为空白对照吸光度(A0),同时以2 mL 蒸馏水代替上述体系中2 mL 的H2O2测得本底吸光度(Aj).Ai 和Aj 每个质量样品浓度做3 个平行,A0 做3 个平行.最后计算清除率取平均值[22-23].
1.4 统计分析
试验数据平行测定3 次,测定平均值,采用Origin2018 软件作图,应用SPSS26 软件对数据进行方差分析,差异显著性水平为P<0.05.
2 结果与分析
2.1 不同参数条件和提取方式对山楂叶多糖提取率的影响
2.1.1 热水浸提法对山楂叶多糖提取率的影响 不同条件热水浸提法对山楂叶多糖提取率的影响结果见表1.

表1 不同条件热水浸提法对山楂叶多糖提取率的影响Tab.1 Effect of hot water immersion in different conditions on the rate of polysaccharide extraction of Hawthorn Leaves
由表1 可知,当提取温度由50 ℃升高到80 ℃时,多糖提取率逐渐提高;当温度由80 ℃升高到90 ℃时,多糖提取率显著提高.根据赵宁等[24]的报道热水浸提白芨多糖温度高于90 ℃后,多糖提取率反而下降,可能是温度过高使多糖发生了降解,综合考虑确定水浴最佳温度为90 ℃.在相同的温度条件下,山楂叶多糖的提取率随料液比的增大而不断提高.许瑞波[12]报道称提取山楂叶多糖时,料液比从1:30 提高到1:40 对山楂叶多糖提取率提升效果不明显,而提取液的增加会延长后续的浓缩提取时间,故热水浴最优料液比确定为1:30.
2.1.2 微波辅助水提法对山楂叶多糖提取率的影响 不同条件微波辅助水提法对山楂叶多糖提取率的影响结果见表2.

表2 不同条件微波辅助水提法对山楂叶多糖提取率的影响Tab.2 Effect of microwave-assisted water formulation on the rate of polysaccharide extraction of Hawthorn Leaves
由表2 可知,当微波功率由100 W 增大到300 W 时,多糖提取率显著提高;由300 W 增大到500 W时,提取率增加的幅度明显变低.龚盛昭等[16]报道微波提取黄芪多糖功率高于450 W 时,多糖提取率由于提取液沸腾从提取器中溢出而降低,且过高的微波功率有破坏山楂叶多糖活性的可能,综合考虑确定微波功率以300 W 为佳.在相同的微波功率条件下,山楂叶多糖的提取率随料液比的增大而不断提高,故超声波辅助水提法料液比也确定为1:30.
2.1.3 超声波辅助水提法对山楂叶多糖提取率的影响 不同条件超声波辅助水提法对山楂叶多糖提取率的影响结果见表3.

表3 不同条件超声波辅助水提法对山楂叶多糖提取率的影响Tab.3 Effect of ultrasonic-assisted water formulation in different conditions on the rate of polysaccharide extraction of Hawthorn Leaves
由表3 可知,当超声波功率由50 W 增大到80 W 时,多糖提取率明显提高;由80 W 增大到100 W时,提取率增加的幅度明显变低.吕明生等[25]报道超声波提取雪莲薯多糖功率大于80 W 时,多糖提取率反而降低,可能是多糖在持续的高功率超声作用下缓慢降解,根据前人的研究报道结合本试验的研究结果,确定超声波提取功率100 W 为最佳.在相同的超声波功率条件下,山楂叶多糖的提取率随料液比的增大而不断提高,这与热水浸提法多糖提取率随料液比的变化规律大致相似,故超声波辅助水提法料液比也确定为1:30.
2.2 不同提取方式对山楂叶多糖抗氧化活性的影响
2.2.1 对提取量的影响 以20 g 山楂叶粗干粉为提取样品,经过3 种不同提取方法提取后,最终热水提取法得到0.748 0 g,微波辅助水提法得到0.984 5 g,超声波辅助水提法得到1.081 5 g.超声波和微波辅助水提法得到山楂叶粗多糖的量明显高于热水提取的量.这可能是因为经微波处理后,细胞内温度压强升高,加速细胞壁的破坏,而超声波的震荡作用也能加速细胞壁的破坏,导致更多的多糖溶解出来.
2.2.2 总还原能力 抗氧化活性与还原力之间存在直接的关系,若抗氧化物质的还原力越强,则该抗氧化物质的抗氧化活性越强.因此,测定抗氧化物质的还原力,可以间接便显出抗氧化物质的抗氧化活性.通常向抗氧化物质的溶液中添加铁氰化钾来表现还原力,体系中的Fe3+在抗氧化剂的作用下生成Fe2+,Fe2+在700 nm 处有吸收峰,可通过分光光度计测出.当吸光度越大,则表明该体系中的Fe2+越多,还原力越强[26-27].不同方式提取山楂叶多糖的总还原能力结果见图1.
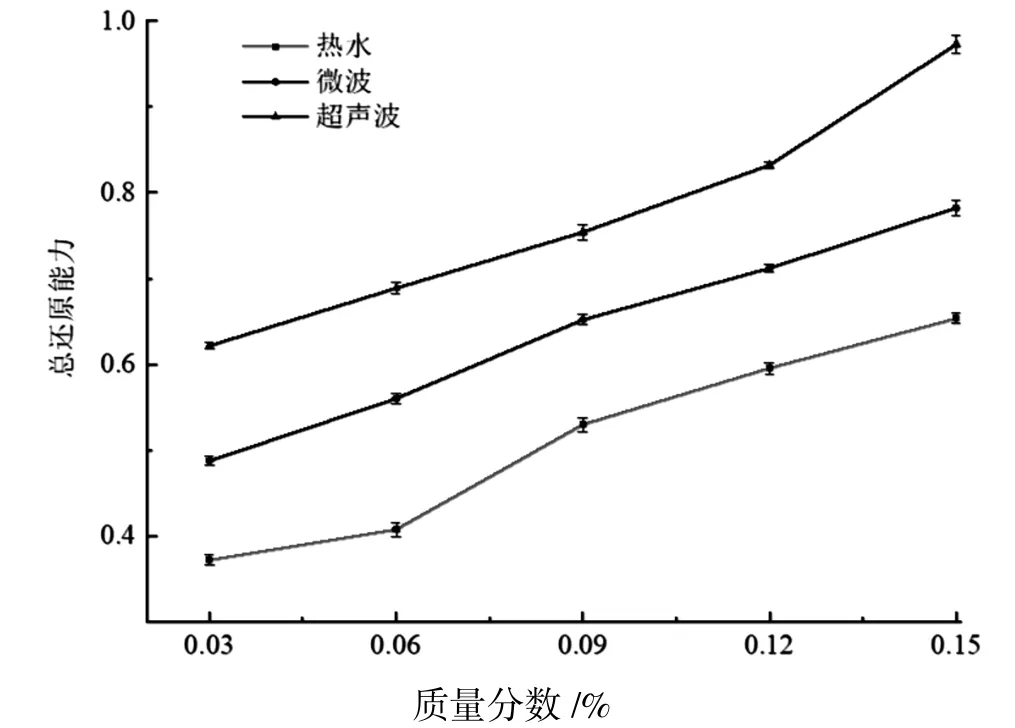
图1 不同方式提取山楂叶多糖的总还原能力Fig.1 Total reduction capacity of Hawthorn Leaf polysaccharide in different extraction methods
由图1 可知,超声波提取山楂叶多糖,微波提取多糖和水提取多糖的总还原能力与质量分数呈正比关系,随着质量分数的增加,不同方式提取山楂叶多糖的总还原能力也随之增加,同时任何一种提取多糖方式的总还原能力也显著性增加(P<0.05).超声波提取山楂叶多糖的总还原能力强于微波提取和热水提取,当质量分数大于0.12%时,超声波提取多糖的总还原能力上升幅度明显高于微波提取和热水提取.综上所述,不同方式提取山楂叶多糖的总还原能力:超声波提取>微波提取>热水提取.分析原因可能是:超声波提取时间大大缩短,对多糖生物活性损伤小,同时也避免了多余的氧化化学反应;总还原能力的差异还可能与不同提取山楂叶多糖方式对多糖分子的单糖组成和糖苷键型的不同有很大关系[28].
2.2.3 对DPPH 自由基的清除作用 测定抗氧化性的方法中,DPPH 法是较常用的一种检测方法.DPPH自由基在有机溶剂中较稳定,其DPPH 乙醇溶液呈深紫色,位于517 nm 处有吸收峰.抗氧化物质可直接与DPPH 自由基发生反应,生成稳定的抗磁分子,DPPH 乙醇溶液颜色也随之变浅.根据吸光度变化可测定抗氧化物质的抗氧化活性.通过测定超声波提取、微波提取及热水提取山楂叶多糖对DPPH 自由基的清除率,以此分析对比不同提取方式对DPPH 自由基的清除能力[29].不同方式提取山楂叶多糖对DPPH自由基的清除效果结果见图2.

图2 不同方式提取山楂叶多糖对DPPH 自由基的清除效果Fig.2 The removal effect of Hawthorn Leaf polysaccharide on DPPH free radicals in different ways
由图2 可知,随着质量分数的增加,不同方式提取山楂叶多糖对DPPH 自由基的清除率也呈正比增加,同时任何一种提取多糖方式对自由基清除率均显著性增加.当质量分数在0.06%~0.09%时,超声波提取多糖方式对DPPH 自由基清除率增长幅度明显高于微波提取和热水提取多糖对自由基的清除率.当质量分数为0.15%时,超声波提取多糖对DPPH 自由基清除率为57.47%,而微波提取多糖和热水提取多糖对其自由基的清除率仅为41.23%和35.20%.综上所述,相同质量分数时,超声波提取山楂叶多糖对DPPH 自由基清除率优于微波提取和热水提取对其清除率, 且超声波提取和微波提取山楂叶多糖对DPPH 的清除率均大于热水提取对自由基的清除率.
2.2.4 对·OH 的清除作用 羟自由基是目前已知的最强氧化剂, 可以通过H2O2与Fe2+反应生成·OH,水杨酸可与·OH 发生反应,并产生能在510 nm 处有强烈吸收峰的有色物质.由于多糖分子具有还原性的半缩醛羟基,可以与·OH 发生反应,使水杨酸竞争的·OH 减少,从而产生的有色物质减少[30].不同方式提取山楂叶多糖对·OH 的清除效果结果见图3.

图3 不同方式提取山楂叶多糖对·OH 的清除效果Fig.2 Different ways to extract Hawthorn Leaf polysaccharide to the·OH purge effect
由图3 可知,山楂叶多糖对·OH 清除能力与质量分数呈正相关.表明不同方式提取山楂叶多糖对·OH清除效果与质量分数有较大的依赖关系,随着粗山楂叶多糖质量分数的增加,对·OH 清除效果也随着增加.3 种提取方式所得的山楂叶多糖对·OH 的清除能力增长趋势大致一致,超声波提取山楂叶多糖在质量分数为0.15%时对·OH 清除率高达51.43%,表明高质量分数的山楂叶多糖对·OH 也能达到较高的清除效果,能够有效的抗氧化.相同质量分数时,对·OH 清除率最高的为超声波提取,其次为微波提取和热水提取.综上所述,不同方式提取山楂叶多糖对·OH 清除效果:超声波提取>微波提取>热水提取.
3 结论
本研究对山楂叶多糖三种不同提取方法的参数进行优化,根据试验结果确定最适工艺条件.提取温度90 ℃、料液比1:30、热水浸提3 h 多糖提取率可达到5.45%;超声波功率100 W 处理60 min、料液比1:30 热水浸提3 h,多糖提取率可达到6.82%;微波功率300 W 处理5 min、料液比1:30、热水浸提3 h,多糖提取率高达7.68%.结果表明,超声波和微波均具有良好的提取山楂叶多糖的效果,其中微波的效果更好.
不同提取方式对山楂叶多糖抗氧化活性试验表明,超声波提取山楂叶多糖、微波提取山楂叶多糖和热水提取山楂叶多糖对DPPH 和·OH 均具有较好清除效果和还原能力,随着质量分数的增加,其清除效果和还原能力也随着增加,研究结果表明山楂叶多糖具有较高的开发利用价值.超声波提取山楂叶多糖对自由基的清除率和还原能力均大于微波提取和热水提取,且时间短、效率高、节约成本,同时还可以防止提取时多糖发生其它的化学变化,可以作为提取山楂叶多糖抗氧化活性的主要手段.
