加味苓桂术甘汤对代谢综合征大鼠脂肪细胞因子和骨骼肌葡萄糖转运蛋白表达的影响
2020-09-23倪靖怡李旷怡张英俭魏华廖凯劲
倪靖怡, 李旷怡, 张英俭, 魏华, 廖凯劲
(佛山市中医院,广东佛山 528000)
代谢综合征(metabolic syndrome,MS)是一种以肥胖、血脂异常、高血糖和高血压为主要特征的慢性非传染性疾病[1],是高血压、糖尿病、冠心病、脑梗死等心脑血管疾病的重要危险因素,已成为全球性世界公共卫生问题[2-4]。积极治疗MS具有重要的意义。本课题组临床应用加味苓桂术甘汤治疗MS患者,取得了良好的疗效,可以改善患者体质量、血脂、血糖和胰岛素水平,但是具体机制尚未阐明。因此,本研究复制了MS 大鼠模型,给予加味苓桂术甘汤灌胃治疗,观察其对MS大鼠糖脂代谢紊乱和胰岛素抵抗的改善作用,并初步探讨其可能的作用机制,现将研究结果报道如下。
1 材料与方法
1.1 动物清洁级健康雄性SD大鼠50只,5 ~7周龄,体质量(170 ± 20)g,购于广州中医药大学医学实验动物中心,动物许可证号:SCXK(粤)2019-0047。普通饲料和高脂高糖高盐饲料(按质量分数配比:普通饲料50.5%、蔗糖15%、猪油20%、蛋黄5%、9.5%食用盐)均购于从化市华珍动物养殖场,许可证号:SCXK(粤)2015-0028。
1.2 药物加味苓桂术甘汤(茯苓15 g、桂枝12 g、白术12 g、甘草6 g、黄芪15 g、红花10 g、桃仁10 g、茵陈蒿15 g、法半夏10 g)由佛山市中医院中药房代煎并浓缩至生药含量为2 g/mL的药液,4 ℃冰箱中保存。罗格列酮(成都恒瑞制药有限公司,批号:20180625)。
1.3 试剂与仪器胰岛素抗体放免试剂盒购自上海信帆生物科技有限公司;血糖、血脂试剂盒购自北京博胜经纬科技有限公司;游离脂肪酸(FFA)、瘦素(LP)、脂联素(ADP)、内脂素(VF)、过氧化物酶体增殖剂激活受体γ(PPAR-γ)酶联免疫吸附分析(ELISA)试剂盒购自上海晶抗生物工程有限公司;葡萄糖转运蛋白4(GLUT-4)ELISA 试剂盒购自上海振誉生物科技有限公司。AU5800 系列全自动生化分析仪购自贝克曼库尔特公司;台式高速离心机购自赫澎(上海)生物科技有限公司;UV-1100 紫外分光光度计购自北大医疗产业园科技有限公司;DB128无创血压测量仪购自北京智鼠多宝生物科技有限责任公司。
1.4 动物分组和模型构建[5]将50 只大鼠适应性喂养1 周后随机分为空白组(10 只)和造模组(40 只)。造模组给予高脂高糖高盐饲料连续喂养8 周复制MS 模型;同期,空白对照组给予普通饲料喂养。造模结束后,若肥胖成模基础上符合甘油三酯(TG)升高,高密度脂蛋白胆固醇(HDL-C)降低,高血压和胰岛素抵抗指数(IRI)升高等4 项指标中的任意2 项,则判断MS 大鼠造模成功[6]。其中35只大鼠符合MS标准,5只不符合。将35只符合MS标准的大鼠随机分为模型组(11只)、中药组(12只)和西药组(12只)。
1.5 给药方法中药组大鼠给予加味苓桂术甘汤5.67 g·kg-1·d-1灌胃,西药组大鼠给予罗格列酮混悬液3.00 mg·kg-1·d-1灌胃,空白组和模型组大鼠给予等体积的蒸馏水灌胃,均连续灌胃8周。给药期间,除空白组给予普通饲料喂养,其余3组继续高脂高糖高盐饲料喂养。
1.6 标本采集给药结束后,禁食不禁饮16 h,给予100 g/L 水合氯醛腹腔注射麻醉,腹主动脉取血20 mL,以3 000 r/min 离心15 min,取血清,-80 ℃保存待测;取内脏脂肪组织(大网膜、肾周脂肪组织)和腓肠肌组织,-80 ℃保存待测。
1.7 观察指标与方法电子天平测量体质量。测量 体 长 。 计 算 Lee’s 指 数 , Lee’s 指 数 =应用无创血压测量仪测量大鼠尾动脉血压。应用全自动生化分析仪检测血清空腹血糖(FBG)、总胆固醇(TC)、TG、HDL-C、低密度脂蛋白胆固醇(LDL-C)。放射免疫法测定血清空腹胰岛素(FINS)。计算IRI,IRI = FBG ×FINS/22.5。称取脂肪组织加生理盐水,4 ℃研磨制成匀浆,以3 000 r/min离心15 min,取上清液,采用ELISA 法检测脂肪组织FFA、LP、ADP、VF、PPAR-γ 含量;称取腓肠肌加生理盐水研磨,以3 000 r/min 离心15 min,取上清液,采用ELISA 法检测腓肠肌GLUT-4含量。
1.8 统计方法采用SPSS 13.0 软件进行数据分析,实验数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两间比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠体质量、Lee’s 指数、收缩压(SBP)、舒张压(DBP)的比较表1 结果显示:与空白组比较,模型组大鼠体质量、Lee’s 指数、SBP、DBP 均明显升高(P<0.05);与模型组比较,中药组和西药组大鼠体质量、Lee’s 指数、SBP、DBP均明显降低(P<0.05),且2个治疗组比较,差异均无统计学意义(P>0.05)。
2.2 各组大鼠TC、TG、HDL-C、LDL-C 水平的比较表2结果显示:与空白组比较,模型组大鼠TC、TG、LDL-C水平均明显升高(P<0.05),HDL-C水平明显降低(P<0.05);与模型组比较,中药组和西药组大鼠TC、TG、LDL-C水平均明显降低(P<0.05),HDL-C水平明显升高(P<0.05),且2 个治疗组比较,差异均无统计学意义(P>0.05)。
表1 各组大鼠体质量、Lee’s指数、收缩压(SBP)、舒张压(DBP)的比较Table 1 Comparison of the levels of body mass,Lee’s index,SBP,DBP in various groups (±s)
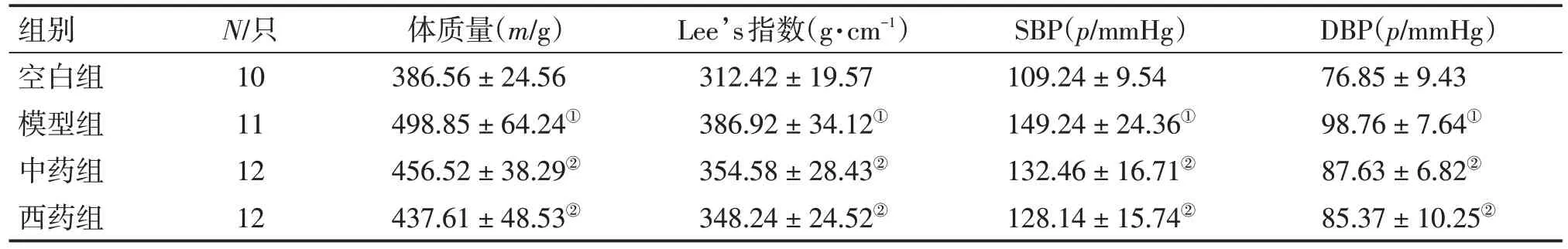
表1 各组大鼠体质量、Lee’s指数、收缩压(SBP)、舒张压(DBP)的比较Table 1 Comparison of the levels of body mass,Lee’s index,SBP,DBP in various groups (±s)
①P<0.05,与空白组比较;②P<0.05,与模型组比较
组别空白组模型组中药组西药组N/只10 11 12 12体质量(m/g)386.56±24.56 498.85±64.24①456.52±38.29②437.61±48.53②Lee’s指数(g·cm-1)312.42±19.57 386.92±34.12①354.58±28.43②348.24±24.52②SBP(p/mmHg)109.24±9.54 149.24±24.36①132.46±16.71②128.14±15.74②DBP(p/mmHg)76.85±9.43 98.76±7.64①87.63±6.82②85.37±10.25②
表2 各组大鼠TC、TG、HDL-C、LDL-C水平的比较Table 2 Comparison of the levels of TC,TG,HDL-C,LDL-C in various groups[±s,c/(mmol·L-1)]
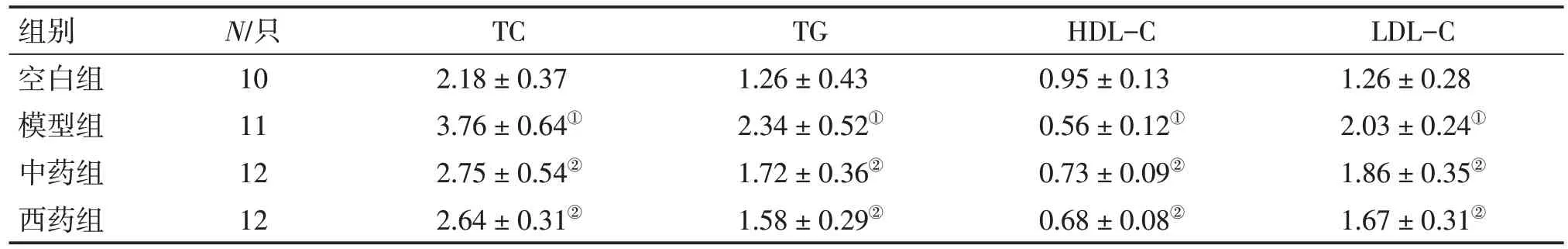
表2 各组大鼠TC、TG、HDL-C、LDL-C水平的比较Table 2 Comparison of the levels of TC,TG,HDL-C,LDL-C in various groups[±s,c/(mmol·L-1)]
①P<0.05,与空白组比较;②P<0.05,与模型组比较
组别空白组模型组中药组西药组N/只10 11 12 12 TC 2.18±0.37 3.76±0.64①2.75±0.54②2.64±0.31②TG 1.26±0.43 2.34±0.52①1.72±0.36②1.58±0.29②HDL-C 0.95±0.13 0.56±0.12①0.73±0.09②0.68±0.08②LDL-C 1.26±0.28 2.03±0.24①1.86±0.35②1.67±0.31②
2.3 各组大鼠FBG、FINS、IRI水平的比较表3结果显示:与空白组比较,模型组大鼠FBG、FINS、IRI水平均明显升高(P<0.05);与模型组比较,中药组和西药组大鼠FBG、FINS、IRI 水平均明显降低(P<0.05),且2 个治疗组比较,差异均无统计学意义(P> 0.05)。
2.4 各组大鼠内脏脂肪组织FFA、LP、ADP、VF、PPAR-γ含量的比较表4结果显示:与空白组比较,模型组大鼠内脏脂肪组织FFA、LP、VF含量明显升高(P<0.05),ADP、PPAR-γ 含量均明显降低(P<0.05);与模型组比较,中药组和西药组大鼠内脏脂肪组织FFA、LP、VF 含量均明显降低(P<0.05),ADP、PPAR-γ 含量均明显升高(P<0.05),且2 个治疗组比较,差异均无统计学意义(P>0.05)。
表3 各组大鼠FBG、FINS、IRI水平的比较Table 3 Comparison of the levels of BG,FINS,IRI in various groups (±s)
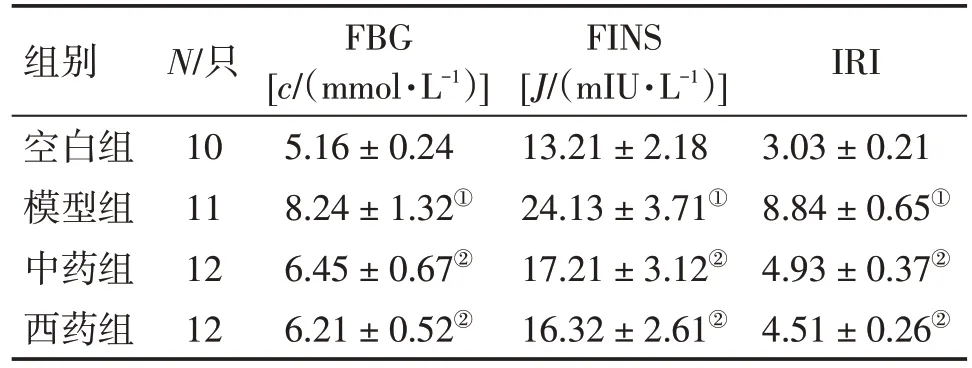
表3 各组大鼠FBG、FINS、IRI水平的比较Table 3 Comparison of the levels of BG,FINS,IRI in various groups (±s)
①P<0.05,与空白组比较;②P<0.05,与模型组比较
组别空白组模型组中药组西药组N/只10 11 12 12 FBG[c/(mmol·L-1)]5.16±0.24 8.24±1.32①6.45±0.67②6.21±0.52②FINS[J/(mIU·L-1)]13.21±2.18 24.13±3.71①17.21±3.12②16.32±2.61②IRI 3.03±0.21 8.84±0.65①4.93±0.37②4.51±0.26②
2.5 各组大鼠腓肠肌组织GLUT-4含量的比较表5结果显示:与空白组比较,模型组大鼠腓肠肌组织GLUT-4 含量明显降低(P<0.05);与模型组比较,中药组和西药组大鼠腓肠肌组织GLUT-4含量明显升高(P<0.05),且2 个治疗组比较,差异均无统计学意义(P> 0.05)。
表4 各组大鼠内脏脂肪组织FFA、LP、ADP、VF、PPAR-γ含量的比较Table 4 Comparison of the contents of FFA,LP,ADP,VF,PPAR-γ in visceral adipose tissue of various groups (±s)
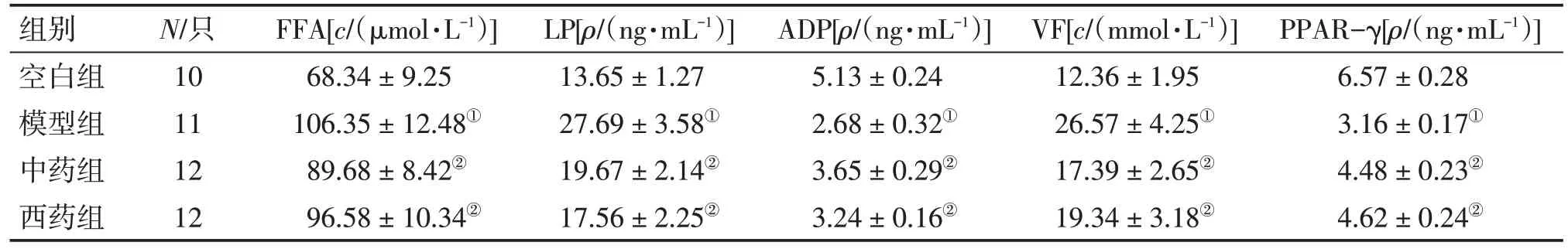
表4 各组大鼠内脏脂肪组织FFA、LP、ADP、VF、PPAR-γ含量的比较Table 4 Comparison of the contents of FFA,LP,ADP,VF,PPAR-γ in visceral adipose tissue of various groups (±s)
①P<0.05,与空白组比较;②P<0.05,与模型组比较
组别空白组模型组中药组西药组N/只10 11 12 12 FFA[c/(μmol·L-1)]68.34±9.25 106.35±12.48①89.68±8.42②96.58±10.34②LP[ρ/(ng·mL-1)]13.65±1.27 27.69±3.58①19.67±2.14②17.56±2.25②ADP[ρ/(ng·mL-1)]5.13±0.24 2.68±0.32①3.65±0.29②3.24±0.16②VF[c/(mmol·L-1)]12.36±1.95 26.57±4.25①17.39±2.65②19.34±3.18②PPAR-γ[ρ/(ng·mL-1)]6.57±0.28 3.16±0.17①4.48±0.23②4.62±0.24②
表5 各组大鼠腓肠肌组织GLUT-4含量的比较Table 5 Comparison of the content of GLUT-4 in gastrocnemius tissue of various groups (±s)
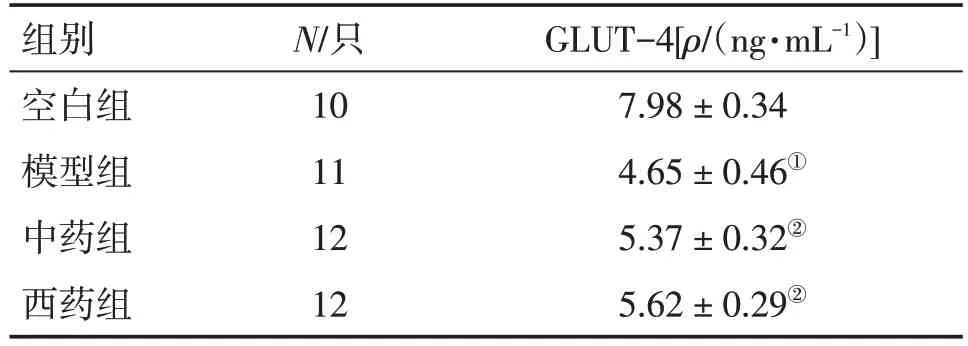
表5 各组大鼠腓肠肌组织GLUT-4含量的比较Table 5 Comparison of the content of GLUT-4 in gastrocnemius tissue of various groups (±s)
①P<0.05,与空白组比较;②P<0.05,与模型组比较
组别空白组模型组中药组西药组N/只10 11 12 12 GLUT-4[ρ/(ng·mL-1)]7.98±0.34 4.65±0.46①5.37±0.32②5.62±0.29②
3 讨论
代谢综合征(MS)属于中医学“痰湿”“消渴”等范畴。MS 的主要病机是脾虚不运,痰瘀阻滞[8-9]。苓桂术甘汤出自《伤寒论》,方中:茯苓淡渗利湿,健脾益气;桂枝温阳化气,温通经脉;白术益气健脾,燥湿利水;甘草健脾益气,调和诸药。本方在苓桂术甘汤基础上加黄芪以补中益气、健脾利水,加红花、桃仁活血化瘀,加茵陈蒿清热利湿、半夏燥湿化痰以加强化痰利湿之功效。诸药合用,共奏健脾益气、化痰祛湿、活血化瘀之功效。本研究采用高脂高糖高盐饲料喂养方法建立MS大鼠模型,观察加味苓桂术甘汤对其治疗效果。结果显示:与空白组比较,模型组大鼠体质量、SBP、DBP、FBG、FINS、TC、TG、LDL-C、IRI、Lee’s指数水平均明显升高,HDL-C、ADP水平明显降低(均P<0.05)。表明以高脂高糖高盐方法喂养成功建立了MS模型,存在明显的胰岛素抵抗。给药后,与模型组比较,中药组大鼠的体质量、SBP、DBP、FBG、FINS、TC、TG、LDL-C、IRI、Lee’s 指数水平均明显降低,HDL-C、ADP水平明显升高(均P<0.05)。表明加味苓桂术甘汤可以改善MS大鼠的糖脂代谢和胰岛素抵抗,且与罗格列酮疗效相当。
目前,多数学者认为胰岛素抵抗是MS重要的病理基础和中心环节[10]。胰岛素抵抗使糖原摄取和利用受损,肝糖原合成和糖异生障碍,继发代偿性的高胰岛素血症,由此产生一系列病理生理变化,导致MS 的发生[11]。研究[12]表明,脂肪组织是人体重要的内分泌器官,其分泌的脂肪细胞因子可以参与能量代谢,调节胰岛素生物学效应,与胰岛素抵抗具有密切的联系。胰岛素可刺激脂肪组织分泌LP,LP浓度升高可以减少摄食和增加能量消耗,并且可以与胰岛β 细胞上的LP 受体结合,抑制胰岛素分泌,改善胰岛素抵抗[13];而MS患者由于脂肪堆积,LP 分泌异常,形成LP 抵抗,导致抑制胰岛素分泌能力受损,进而导致胰岛素抵抗。脂肪组织分泌的FAA 可以抑制肝脏对葡萄糖摄取的利用,抑制糖氧化,从而刺激胰岛β细胞分泌胰岛素,导致胰岛素抵抗[14]。VF 是脂肪细胞分泌的一种具有类胰岛素作用的脂肪因子,是导致胰岛素抵抗的关键因子[15]。ADP是脂肪细胞分泌的细胞因子,具有增加FFA 氧化、减少脂质储存和增加胰岛素敏感性等作用[16]。PPAR-γ 是调控脂肪因子和胰岛素信号转导的重要因子,在调节糖脂代谢、脂肪细胞分化、增强胰岛素敏感性和抗炎进而改进胰岛素抵抗方面起着重要作用;而MS患者中PPAR-γ表达明显降低,从而导致脂肪因子分泌异常和胰岛素抵抗[17]。GLUT-4 是由脂肪和骨骼肌分泌的一种葡萄糖转运载体,胰岛素通过与细胞表面的胰岛素受体结合,刺激GLUT-4从内部转移至细胞膜,加速对葡萄糖的摄取和利用[18];全身50%~80%的葡萄糖由GLUT-4承担转运,而骨骼肌GLUT-4 承担了其中70% ~80%的葡萄糖转运,是全身葡萄糖转运的最重要场所,而脂肪组织GLUT-4仅占较少部分。MS患者若GLUT-4转位功能障碍,刺激胰岛素分泌,发生高胰岛素血症和胰岛素抵抗,可加重MS。本研究结果显示:与空白组比较,模型组大鼠脂肪组织FFA、LP、VF水平明显升高,骨骼肌组织GLUT-4、脂肪组织PPAR-γ含量明显降低(均P< 0.05)。表明MS大鼠胰岛素抵抗,可能与FFA、LP、VF、ADP 等分泌增加以及PPAR-γ、GLUT-4 水平明显降低相关。《素问·太阴阳明论》言:“四肢皆禀气于胃,而不得至经,必因于脾,乃得禀也。”MS 患者由于脾胃亏虚,生化乏源,四肢肌肉失养,故骨骼肌GLUT-4 基因和蛋白表达减少。脾虚失运,且MS患者嗜食肥甘厚腻,痰浊内生,聚集于内脏脂肪组织,FFA、LP、VF、ADP、PPAR-γ失调。给药后,与模型组比较,中药组大鼠FFA、LP、VF 水平明显降低,PPAR-γ、GLUT-4 水平明显升高(均P<0.05)。表明加味苓桂术甘汤可以改善MS 大鼠的糖脂代谢紊乱和胰岛素抵抗,与抑制脂肪组织FFA、LP、VF 的分泌,上调GLUT-4、PPAR-γ 水平有关,且与罗格列酮疗效相当。
综上所述,加味苓桂术甘汤可有效改善MS大鼠糖脂代谢紊乱和胰岛素抵抗,其机制可能与调节内脏脂肪组织FFA、LP、ADP、VF、PPAR-γ等脂肪细胞因子和骨骼肌GLUT-4表达有关。
