NaCl胁迫下罗汉果幼苗生长和生理特性的变化
2020-09-22赵英何璐洁邓平
赵英 何璐洁 邓平


摘要:为了研究盐胁迫对罗汉果幼苗生长及生理生化特征的影响,用不同浓度(40、80、120、160、200、240 mmol/L)NaCl溶液胁迫处理罗汉果幼苗,并观察其生长和生理指标的变化。结果表明:随着NaCl浓度的增加,罗汉果幼苗的生长量逐渐降低,当盐浓度为120 mmol/L时,罗汉果地下部分、地上部分鲜质量分别较CK减少26.76%、23.55%;超氧化物歧化酶(SOD)活性随着盐浓度的增加总体呈增强趋势,过氧化物酶(POD)和过氧化氢酶(CAT)活性则随盐濃度的增加先增强后减弱;随着盐浓度的增加,可溶性蛋白、可溶性糖含量先增加后减小,在盐浓度为120 mmol/L时达到最大值;随着盐浓度的增加,丙二醛(MDA)含量呈上升趋势,并且始终显著高于对照。此外,CAT活性与MDA含量、SOD活性呈极显著正相关,与POD活性呈极显著负相关,可溶性糖含量与SOD活性呈极显著正相关。由此说明不同浓度的盐胁迫对罗汉果幼苗生长和生理指标均有不同程度的抑制作用,当盐浓度达 120 mmol/L 以上时,会严重抑制罗汉果幼苗的生长,甚至会造成幼苗死亡。
关键词:盐胁迫;罗汉果;生长指标;生理特性
中图分类号: S567.901 文献标志码: A 文章编号:1002-1302(2020)15-0199-05
盐渍土也称为盐碱土,在我国的分布范围广、面积大、类型多,总面积约为1亿hm2[1]。盐渍化土壤盐分浓度过高导致植物产生渗透胁迫、氧化应激和离子毒害等;同时,由于长期盐渍化导致土壤pH值升高,也会对植物造成进一步的伤害[2]。在盐胁迫地区,植物生长受到抑制,表现为植株生长较正常、缓慢或停止生长,在高浓度的盐胁迫条件下,植物会因为其体内的细胞失水而死亡。
罗汉果是我国特有的珍贵药材,素有良药佳果之称,果实中含有丰富的葡萄糖、果糖及多种维生素等[3],用途广泛。盐害是制约罗汉果产量和质量的重要因素之一,盐胁迫会影响植物生长量、抗氧化酶活性及渗透调节物质含量。杨宏伟等研究发现,盐胁迫会抑制藜麦幼苗的株高、根系生长和叶面积等植株生长指标[4];周静等研究发现,随着盐胁迫浓度的增加,辣椒幼苗叶片中的丙二醛(MDA)含量呈上升趋势,过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)活性先升高后降低[5];韩志平等研究发现,盐胁迫会导致黄花菜幼苗可溶性糖含量逐渐降低,可溶性蛋白在黄花菜抵抗渗透胁迫的过程中没有贡献[6]。而目前关于罗汉果幼苗对盐胁迫的反应尚未见报道,因此,研究罗汉果幼苗在盐胁迫条件下的生长生理变化具有重要的现实意义。本试验旨在通过研究盐胁迫对罗汉果幼苗生长和生理特性的影响,探讨罗汉果幼苗的耐盐机制,以期为罗汉果幼苗的种植和推广提供理论指导。
1 材料与方法
1.1 试验材料
本试验于2019年在玉林师范学院苗圃基地及玉林师范学院生物与制药学院实验室进行。供试材料为1年生罗汉果幼苗,栽植于玉林师范学院苗圃基地,采用盆栽法种植,所选罗汉果幼苗生长一致,株高约35 cm,种植在内径25 cm、深 20 cm 的排水、透气性良好的泥瓦盆中。针对罗汉果对土壤的要求,种植罗汉果的土壤按照园土、基质、有机肥体积比=1 ∶ 1 ∶ 1的比例混合,将罗汉果幼苗随机分成7组,每组设5个重复,正常水肥管理,缓苗3周后开始进行盐胁迫试验。为了保证罗汉果幼苗健康生长,控制缓苗期土壤含水量为(25.4±1.23)%。
1.2 试验设计
选取长势一致的罗汉果幼苗;配制浓度梯度为40、80、120、160、200、240 mmol/L的NaCl溶液,以蒸馏水作为对照(CK),共7个处理组,每组设5个重复。试验开始后,每隔3 d对罗汉果植株浇灌1次NaCl溶液,每次浇200 mL/盆,共浇灌6次,直接浇灌根部,不得喷施叶片,以免影响结果,处理时间为16:00—18:00。胁迫结束后,取植株中部生长一致的叶片3张,每组分别从3盆植株中选取,叶片均匀混合剪碎并称取0.2 g,测定各项生理指标,每个处理设3次重复,取平均值。
1.3 试验方法
1.3.1 生长指标的测定 生长指标的测定参照李长有等的方法[7],将用不同浓度NaCl处理的罗汉果从泥瓦盆中移出,每个处理、每个重复随机选取10株罗汉果幼苗,洗净植株并吸干表面水分,根部即为植物的地下部分,茎、叶即为植物的地上部分。称取植物地上部分、地下部分的鲜质量后,分别放入烘箱中,于105 ℃杀青15 min,然后调节温度至75 ℃烘干至恒质量,称干质量。分别称量并记录地上部分干质量、地下部分干质量,取平均值。
1.3.2 可溶性蛋白含量的测定 采用考马斯亮蓝法测定可溶性蛋白含量,具体参照文献[8]。
1.3.3 可溶性糖含量的测定 采用蒽酮法测定可溶性糖含量,具体参照文献[9]。
1.3.4 丙二醛含量的测定 采用硫代巴比妥酸(TBA)显色法测定丙二醛含量[10]。
1.3.5 抗氧化酶活性的测定 采用紫外吸收法测定CAT活性[9],采用愈创木酚法测定POD活性[9],采用氮蓝四唑(NBT)光还原法测定SOD活性[9]。
1.4 数据处理
用Excel 2007制作图表,用SPSS 16.0对试验数据进行显著性检验,以P<0.05作为显著性标准。
2 结果与分析
2.1 NaCl胁迫对罗汉果幼苗生物量的影响
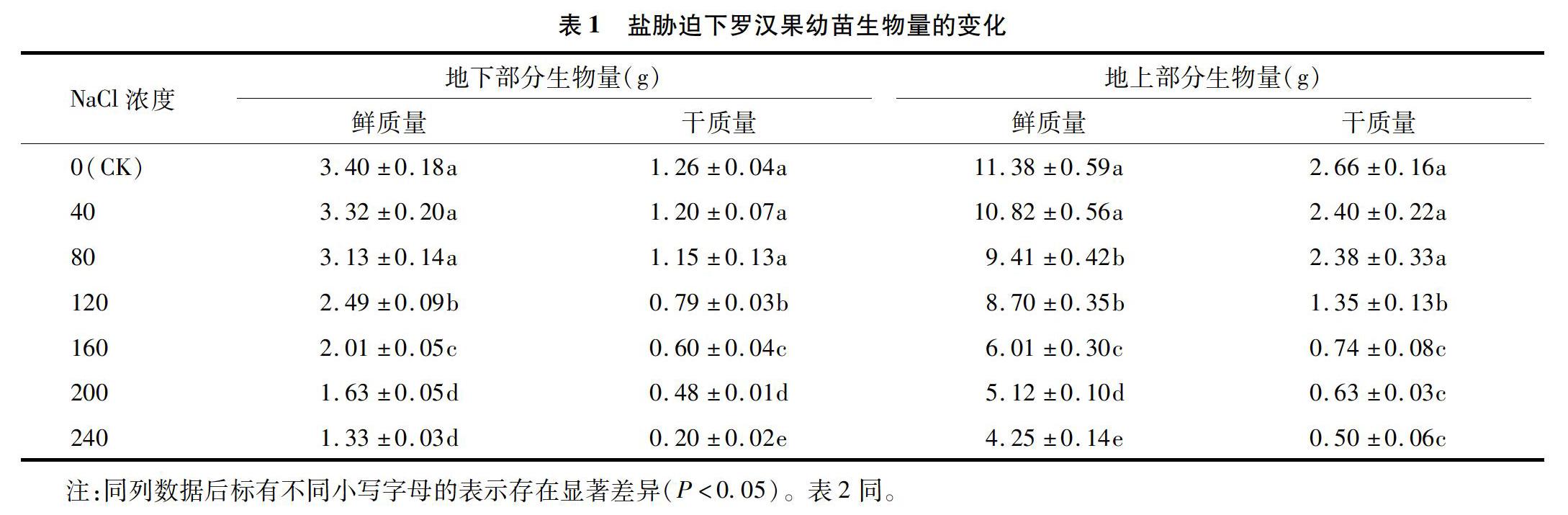
在盐胁迫处理条件下,植物受到外界高盐度环境的影响,其中直接接触外界环境的地下部分(根)受到的影响最大。外界高盐度的渗透势导致植物本身脱水,进而影响植物体一系列生理生化反应[11]。如果植物由于根系吸水量变少,会使其蒸腾作用减弱、气孔关闭,进而使其光合作用减弱,制造的有机物质减少,最终减少其生物量。由表1可知,罗汉果地上部分、地下部分的鲜质量、干质量均随盐胁迫浓度的升高而减小,当盐浓度大于40 mmol/L时,罗汉果地上部分鲜质量显著低于CK(P<0.05);当盐浓度大于80 mmol/L时,罗汉果地上部分、地下部分的干质量均显著低于CK(P<0.05);当盐浓度为120 mmol/L时,罗汉果地下部分、地上部分的鲜质量分别较CK减少26.76%、23.55%。由此可见,罗汉果幼苗的耐盐性较弱,80 mmol/L及以上的盐胁迫对其生长的影响较大,120 mmol/L以上的盐胁迫则严重抑制了罗汉果幼苗的生长。
2.2 NaCl胁迫对罗汉果幼苗MDA含量的影响
细胞生物膜透性的增加与膜脂的过氧化作用有关,经逆境胁迫(盐胁迫)后,细胞产生 O-2 · 、·OH 等,进而使脂质过氧化,表现在生物膜结构上即为膜脂过氧化,并生成MDA[12]。MDA具有一定的毒性,它能与膜结构上的蛋白质和酶结合、交联而使其失去活性,并破坏膜的结构,进而改变膜的透性。从图1可以看出,随着盐浓度的升高,罗汉果幼苗得MDA含量逐渐增加,当盐浓度大于 40 mmol/L 时,与CK相比不同盐浓度罗汉果幼苗MDA含量显著增加(P<0.05);當盐浓度为 40 mmol/L 时,与对照相比,罗汉果幼苗的MDA含量增加了1.09%,差异不显著;当盐浓度分别为200、240 mmol/L时,罗汉果幼苗的MDA含量与对照相比分别增加了79.32%、81.45%。以上结果表明,低浓度盐胁迫对罗汉果幼苗的影响较小,高浓度盐胁迫对罗汉果幼苗的影响较大,使其膜脂严重过氧化。
2.3 NaCl胁迫对罗汉果幼苗CAT、POD、SOD活性的影响
生长的植物细胞时刻在进行着分解代谢和合成代谢,同时伴随着物质代谢和能量代谢,在此过程中会产生 O-2 · 、·OH和H2O2等,并且植物体内也存在清除这些自由基的途径和还原型物质,以维持细胞内环境的稳定。SOD、POD和CAT是生物体内重要的活性氧清除酶,在消除超氧化物自由基、减轻脂质过氧化和减轻膜伤害方面起着重要作用[13]。SOD可以消除 O-2 · ,而H2O2可以被CAT分解,POD可以将H2O2分解为H2O。由表2可见,随着盐浓度的增加,罗汉果幼苗的SOD活性在一定范围内显著升高,表明在NaCl胁迫下,罗汉果幼苗细胞内产生了较多超氧自由基,SOD的合成量增加可以消除部分 O-2 · ,以保证细胞内各种代谢的正常进行。由表2还可以看出,随着盐浓度的增加,罗汉果幼苗的CAT活性先升高后降低,当盐浓度为 80 mmol/L 时,罗汉果幼苗的CAT活性与其他盐浓度处理明显不同(P<0.05);在部分盐浓度范围内,CAT活性随着盐浓度的升高而缓慢上升,当盐浓度小于160 mmol/L时,CAT活性升高;当盐浓度为160 mmol/L时,CAT活性达到最高值;当盐浓度大于160 mmol/L时,随着盐浓度的增加,CAT活性受到抑制,清除自由基的能力减弱。随着盐浓度的增加,罗汉果幼苗的POD活性先升高后降低,当盐浓度为80 mmol/L时,罗汉果幼苗的POD活性显著高于其他盐浓度处理(P<0.05)。
2.4 NaCl胁迫对罗汉果幼苗可溶性蛋白含量的影响
可溶性蛋白不仅是光合作用的产物之一,也是光合作用中的酶、电子传递体和光合色素的主要组分。在逆境胁迫处理下,植物体内的蛋白质与脯氨酸相互作用,蛋白质的可溶性增强,即蛋白质的水合作用增强[14]。由图2可以看出,随着盐胁迫浓度的增加,罗汉果幼苗的可溶性蛋白含量呈先升后降的趋势,并且均与CK间差异显著(P<0.05);当盐浓度达到120 mmol/L时,罗汉果幼苗的可溶性蛋白含量达到最大值,比CK显著提高了111.1%(P<0.05);当盐浓度等于240 mmol/L时,可溶性蛋白含量显著减小,但仍显著高于CK(P<0.05)。
2.5 NaCl胁迫对罗汉果幼苗可溶性糖含量的影响
植物细胞的渗透调节作用是使植物适应环境,其调节能力的强弱直接决定着植株抗逆性的大小以及适应性能力的强弱。大多数种类的植物在遭受环境胁迫时,能够在体内积累一些可溶性物质(如可溶性蛋白、可溶性糖等),它们对渗透势的调节具有重要作用[15]。这种作用主要表现为保护植物细胞在盐胁迫下的渗透失衡[16]、稳定亚细胞组织如细胞膜和蛋白质、清除抗氧化系统等。可溶性糖是很多植物的“渗透调节剂”,也是合成其他有机分子的框架(碳架)成分;同时,糖类是细胞生命活动的主要能源物质,能够为细胞进行的新陈代谢提供源源不断的能量[17]。由图3可知,随着盐胁迫浓度的增加,可溶性糖含量呈现先升后降的趋势;当盐胁迫浓度为40~120 mmol/L时,罗汉果幼苗的可溶性糖含量明显增加,部分处理与CK间差异显著(P<0.05);当盐胁迫浓度达到120 mmol/L时,罗汉果幼苗的可溶性糖含量达到最大值,与CK相比显著增加了7.01%(P<0.05);当盐胁迫浓度大于120 mmol/L时,随着盐浓度的增加,罗汉果幼苗的可溶性糖含量逐渐减少,并且各浓度处理间的差异不显著。在各盐胁迫处理下,可溶性糖含量仍明显高于CK,部分差异显著(P<0.05),可能是由于罗汉果幼苗通过增加可溶性糖含量来增大膨压,从而增强自身的抗逆性[18],在逆境胁迫下,植物体内积累的可溶性糖越多,其抗逆性就越强。
2.6 盐胁迫对罗汉果幼苗部分生理指标的相关性分析
植物的生理代谢是一个复杂、有序的过程。在盐胁迫下,植株的某些生理指标会发生改变,并引起其他生理指标的改变,从而影响植株的正常代谢[19]。由表3可见,可溶性糖含量与SOD活性呈极显著正相关,与可溶性蛋白含量呈显著正相关,与POD活性呈显著负相关;SOD活性与可溶性蛋白含量、MDA含量呈显著正相关,与CAT活性呈极显著正相关;MDA含量与CAT活性呈极显著正相关;POD活性与CAT活性呈极显著负相关。由此可见,可溶性蛋白含量随着可溶性糖含量的增加而增加,MDA含量与SOD、POD、CAT活性的相关性较大,随着盐胁迫的增大,最终导致膜透性增加,膜功能受损,3种保护酶的合成量改变;在各个生理指标中,可溶性糖含量与3种酶活性能较好地反映罗汉果幼苗对盐胁迫的抗性生理变化。
3 讨论与结论
盐胁迫对植物的伤害巨大,其伤害程度取决于盐胁迫浓度和植物对盐胁迫的耐受能力[20]。在逆境胁迫下,植物的活性氧清除系统功能降低,导致活性氧在植物体内大量积累,从而扰乱细胞的正常代谢,破坏细胞膜的功能,抑制植物的生长发育[21-22]。本研究通过分析盐胁迫对罗汉果幼苗生长和生理特性的影响发现,罗汉果幼苗地上部分、地下部分的鲜质量、干质量均随着盐胁迫浓度的提高而减小,在120 mmol/L及以上盐胁迫下,罗汉果地上部分、地下部分的鲜质量、干质量均显著低于CK(P<0.05)。盐胁迫使植物体内产生MDA,使得植物细胞膜系统受到破坏,膜通透性增强,电解质外渗。CAT、SOD和POD等抗氧化酶能保护膜结构,清除活性氧,维持活性氧代谢平衡,从而增强植物抵抗逆境胁迫的能力[23-25]。在本研究中,随着盐浓度的升高,罗汉果幼苗的MDA含量逐渐增加,并且当盐浓度大于80 mmol/L时,MDA含量显著增加;随着盐浓度的增加,SOD活性总体呈增加趋势。大量研究发现,在盐胁迫下,作物的MDA含量、SOD活性随着胁迫浓度的增加而升高[26-27],这与本试验结果一致。而随着盐浓度的增加,CAT、POD活性先升高后降低,分别在盐浓度为160、120 mmol/L达到最大值,说明120 mmol/L及以上浓度的盐胁迫已超过罗汉果幼苗的耐盐胁迫能力,严重时可造成幼苗死亡。
在盐胁迫下,植物会积累大量可溶性物质(包括可溶性蛋白和可溶性糖),用以维持细胞的正常渗透压,减轻水分过度损失对细胞的伤害,为盐胁迫下植物体内水分的正常供应提供保障[28]。可溶性物质在植物抵抗逆境胁迫的过程中具有重要作用,但其含量变化在不同植物中的差异较大。本试验结果表明,随着盐胁迫浓度的增加,罗汉果幼苗的可溶性糖和可溶性蛋白含量先增加后降低,均在盐浓度为120 mmol/L达到最大值,其含量的增加有利于提高罗汉果幼苗的抗盐性。当盐浓度高于 120 mmol/L 时,可溶性糖、可溶性蛋白含量降低,说明高浓度的盐胁迫对植物幼苗造成了严重伤害,这与高茜等的研结果[29]一致。
综合来看,罗汉果幼苗的耐盐性较弱,80 mmol/L 以上浓度的盐胁迫对其生长的影响较大,120 mmol/L以上浓度的盐胁迫则严重抑制了罗汉果幼苗的生长,甚至造成幼苗死亡。
参考文献:
[1]杨志莹,赵兰勇,徐宗大. 盐胁迫对玫瑰生长和生理特性的影响[J]. 应用生态学报,2011,22(8):1993-1998.
[2]王佺珍,刘 倩,高娅妮,等. 植物对盐碱胁迫的响应机制研究进展[J]. 生态学报,2017,37(16):5565-5577.
[3]张 静,吴友良,张婵娟,等. 罗汉果药理活性研究进展[J]. 中国药业,2010,19(20):84-86.
[4]杨宏伟,刘文瑜,沈宝云,等. NaCl胁迫对藜麦种子萌发和幼苗生理特性的影响[J]. 草业学报,2017,26(8):146-153.
[5]周 静,徐 强,张 婷. NaCl胁迫对不同品种辣椒幼苗生理生化特性的影响[J]. 西北农林科技大学学报(自然科学版),2015,43(2):120-125.
[6]韩志平,张海霞,周桂伶,等. 混合盐胁迫下黄花菜生长和生理特性的变化[J]. 河南农业科学,2020,49(2):116-122.
[7]李长有,胡亚忱,倪福太,等. 盐碱胁迫对虎尾草生长的影响[J]. 吉林师范大学学报(自然科学版),2008,29(4):24-27.
[8]王三根. 植物生理学实验教程[M]. 北京:科学出版社,2017:138-140.
[9]张志良. 植物生理学实验指导[M]. 4版. 北京:高等教育出版社,2009.
[10]叶宝兴. 生物科学基础实验——植物类[M]. 北京:高等教育出版社,2007.
[11]韩志平,郭世荣,冯吉庆,等. 盐胁迫对西瓜幼苗生长、叶片光合色素和脯氨酸含量的影响[J]. 南京农业大学学报,2008,31(2):32-36.
[12]郎志红. 盐碱胁迫对植物种子萌发和幼苗生长的影响[J]. 植物学通报,1998,15(2):46-49.
[13]王建华. 模拟酸雨对棉花子叶圆片膜保护酶活性和膜脂质过氧化作用的影响[J]. 生态学报,1993,13(3):228-234.
[14]王 忠. 植物生理學[M]. 北京:中国农业出版社,1999:80-85.
[15]张立全,敖登花,师文贵,等. 转红树总DNA紫花苜蓿T1代耐盐株系的生理生化特性分析[J]. 草业学报,2012,21(2):149-155.
[16]华佳敏,汪晓丽,翟福勤,等. NaCl对玉米K+和NO吸收速率的影响[J]. 扬州大学学报(农业与生命科学版),2008,29(1):71-74.
[17]刘 华,舒孝喜,赵 银,等. 盐胁迫对碱茅生长及碳水化合物含量的影响[J]. 草业科学,1997,14(1):18-20.
[18]方志红,董宽虎. NaCl胁迫对碱蒿可溶性糖和可溶性蛋白含量的影响[J]. 中国农学通报,2010,26(16):147-149.
[19]董 静,魏福友,邢锦城,等. 马齿苋幼苗对盐碱胁迫的生理响应[J]. 江苏农业科学,2019,47(13):153-157.
[20]Wang F,Yuan Q H,Shi L,et al. Alarge-scale field study of transgene flow from cultivated rice (Oryza sative) to common wild rice (O. rufipogon) and barnyard grass (Echinochloa crusgalli)[J]. Plant Biotechnology Journal,2006,4(6):667-676.
[21]白健慧. 燕麦对盐碱胁迫的生理响应机制研究[D]. 呼和浩特:内蒙古农业大学,2016.
[22]Liu Y J,Zhang S S,Tian X Y,et al. Effects of salt stress on protective enzyme system,DA content and membrane permeability of NHC foliar[J]. Grass Land and Turf,2008,2(8):30-33.
[23]刘文瑜,杨发荣,黄 杰,等. NaCl胁迫对藜麦幼苗生长和抗氧化酶活性的影响[J]. 西北植物学报,2017,37(9):1797-1804.
[24]周 艳,刘慧英,王 松,等. 外源GSH对盐胁迫下番茄幼苗生长及抗逆生理指标的影响[J]. 西北植物学报,2016,36(3):515-520.
[25]常青山,张利霞,杨 伟,等. 外源NO对NaCl胁迫下夏枯草幼苗抗氧化能力及光合特性的影响[J]. 草业学报,2016,25(7):121-130.
[26]杨发荣,刘文瑜,黄 杰,等. 不同藜麦品种对盐胁迫的生理响应及耐盐性评价[J]. 草业学报,2017,26(12):77-88.
[27]贾新平,邓衍明,孙晓波,等. 盐胁迫对海滨雀稗生长和生理特性的影响[J]. 草业学报,2015,24(12):204-212.
[28]Mii c′ D,iler B,ivkovi c′ J N,et al. Contribution of inorganic cations and organic compounds to osmotic adjustment in root cultures of two Centaurium species differing in tolerance to salt stress[J]. Plant Cell,Tissue and Organ Culture,2012,108(3):389-400.
[29]高 茜,李 毅,苏世平,等. 盐胁迫对红砂种子吸胀过程中生理特性的影响[J]. 中国沙漠,2014,34(1):83-87.
