超声辅助冷冻对鸡胸肉肌原纤维蛋白乳化稳定性的影响
2020-09-21吴宇桐孔保华
张 潮,吴宇桐,孔保华
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
冷冻是贮藏鸡肉及其制品最常用的方法之一。通过冷冻可以抑制微生物的生长,最大限度地保持肌肉原有的风味和品质。然而冷冻过程会对肌肉中的肌原纤维蛋白造成许多负面影响,例如冷冻后的肌原纤维蛋白溶解度下降,蛋白质间发生变性聚集等[1-3]。而这一系列现象主要与冷冻过程中冰晶形成的大小和分布状态有关。在慢速冷冻(主要包括空气冷冻和板式冷冻)过程中,由于细胞外液离子浓度低,因此细胞外液首先冻结形成冰晶[4],这使得细胞内外产生渗透压。在渗透压的作用下细胞内的水分不断向冰晶移动,最终形成大且分布不均匀的冰晶。这些大冰晶会对肌肉组织产生不可逆的破坏,甚至导致蛋白质变性[5]。而在快速冷冻过程中,由于冰晶的形成速度大于水蒸气扩散速度,因此会在细胞内外形成无数小冰晶。这些小冰晶的分布状态接近天然食品的分布状态,故对细胞组织破坏性较小[6]。近年来,在食品冷冻领域出现了许多通过提高冷冻速率来改善冷冻食品质量的新型冷冻技术,例如高压冷冻[7]、射频辅助冷冻[8]和超声辅助冷冻[9-10]等。
超声辅助冷冻在食品冷冻方面已经得到广泛关注,其主要原理是超声波在传播过程中,由于正负压交替会产生大量空化气泡,当空化气泡体积增加到一定尺寸时可以作为晶核促进冰晶形成。然而当空化气泡体积进一步增大时,气泡会变得不稳定,最终部分气泡破裂,破裂的瞬间会产生强烈的冲击波和微射流[11],空化气泡破裂产生的微射流不仅会带来剧烈的搅动,加快传热传质,而且还可以将溶液中已存在的大冰晶打碎形成无数小冰晶碎片,这些碎片又可以作为新的晶核促进冰晶的重结晶,从而降低溶液过冷度,缩短冷冻时间[12]。已有一些研究发现超声辅助冷冻在对水果蔬菜等领域有显著的冷冻效果。如Xu Baoguo等[9]研究发现与空气冷冻和浸渍冷冻相比,超声辅助冷冻(0.26 W/cm2)将萝卜冷冻时间分别缩短了90%和14%;Hu Songqing等[13]对面团采用超声功率为360 W的超声辅助冷冻时也发现了类似现象。此外,Sun Dawen等[14]还研究了冷冻后马铃薯组织微观结构,结果发现,经过超声辅助冷冻的马铃薯细胞间隙较小,细胞组织结构较为完整,表明超声辅助冷冻对马铃薯组织结构破坏性较小。目前有关超声辅助冷冻在肉制品领域的应用主要集中在冷冻速率及肉制品品质方面[15],而超声波对蛋白质结构及乳化性影响方面的研究还较少。因此本实验以鸡胸肉作为研究对象,研究4 种不同超声功率(125、165、205 W和245 W)冷冻、空气冷冻以及浸渍冷冻对鸡胸肉肌原纤维蛋白乳化稳定性的影响,为超声辅助冷冻在肉品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
大小、薄厚、颜色相近的新鲜鸡胸肉(雄性肉鸡,饲养时间60 d)购于哈尔滨农贸市场。
乙二胺四乙酸(elhylene diamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)美国Sigma公司;哌嗪-N,N’-双-2-乙磺酸(piperazine-N,N’-bis-2-ethanesulphonicacid,PIPES) 上海易恩化工技术有限公司;所有试剂均为分析纯。
1.2 仪器与设备
XODL型超声辅助冷冻机 南京先欧仪器设备有限公司;AT-S45温度采集器 江苏常州安柏仪器有限公司;FE20K pH计、AL-104型精密电子天平 梅特勒-托利多仪器(上海)有限公司;JD500-2型电子天平沈阳龙腾电子称量仪器有限公司;UT-1800紫外-可见分光光度计 北京普析通用仪器有限公司;GL-21M冷冻离心机 湖南湘仪实验室仪器开发有限公司;T18匀浆机 德国IKA公司;Mastersizer 2000激光粒度仪英国马尔文公司。
1.3 方法
1.3.1 鸡胸肉样品的制备
将新鲜鸡胸肉剔除脂肪和结缔组织等杂物后,分割成6 cm×6 cm×3 cm的小块,每块质量(83±4)g。将切好的鸡胸肉样品随机均分成6 组并用拉链袋包装,放入4 ℃冰箱保存12 h,以确保所有样品在冷冻时中心温度达到一致。
空气冷冻是将样品置于冰箱(-20 ℃)中冷冻;浸渍冷冻和超声辅助冷冻是将样品置于超声辅助冷冻槽内固定位置,同时设置超声波间歇模式为30 s开/30 s关,超声频率为30 kHz,超声功率为0、125、165、205 W和245 W。利用K型热电偶的温度计实时记录样品的中心温度,同时监控冷冻液温度使其始终保持恒定(-20.0±0.5)℃。当样品中心温度达到0 ℃时,开始进行超声并持续8 min。当肉块几何中心温度达到-18 ℃时取出放入-20 ℃冰箱待用。所有样品实验前均采用4 ℃冰箱解冻。以未经过冷冻的鸡胸肉作为对照组。
1.3.2 肌原纤维蛋白的提取
参照董唯等[16]的方法,并略加调整。将样品切碎后与4 倍体积的10 mmol/L、pH 7.0磷酸盐缓冲液(0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EDTA)混合,匀浆60 s。匀浆后将混合物放入离心机,温度为4 ℃,4 193×g离心15 min。离心后所得沉淀用4 倍体积的磷酸盐缓冲液重复提取两次。再用4 倍体积NaCl溶液(0.1 mol/L)按照上述操作重复洗涤沉淀物两次。最后用8 倍体积的NaCl溶液(0.1 mol/L)与沉淀物混合匀浆60 s,并用4 层纱布过滤。过滤所得匀浆液用0.1 mol/L的HCl溶液调pH值至6.0(等电点),再次离心得到肌原纤维蛋白,用15 mmol/L PIPES缓冲液(含有0.6 mol/L NaCl)溶解,采用双缩脲法测定蛋白含量。
1.3.3 蛋白质溶解度的测定
蛋白质溶解度的测定根据Wang Jingyu等[17]的方法。取8 mL肌原纤维蛋白溶液(1 mg/mL)于离心管中配平,10 000×g离心20 min。肌原纤维蛋白溶液离心后取上层清液1 mL并加入4 mL双缩脲溶液于室温下反应30 min,在540 nm波长处测定OD值,最后根据标准曲线拟合方程y=0.044 7x+0.043 1(R2=0.999 5),计算离心后蛋白的质量浓度,其与离心前蛋白质量浓度的百分比即为肌原纤维蛋白溶解度。
1.3.4 蛋白质浊度的测定
蛋白质浊度根据Jiang Shanshan等[18]的方法。将肌原纤维蛋白溶液(1 mg/mL)放入比色皿中,在600 nm波长处测定吸光度。采用15 mmol/L PIPES(含有0.6 mol/L NaCl)缓冲液调空白。所得吸光度即为蛋白浊度。
1.3.5 蛋白质粒径的测定
使用激光粒度分析仪测定鸡胸肉肌原纤维蛋白粒度分布。按照Hu Hao等[19]的方法并加以修改。用50 mmol/L PIPES(含有0.6 mol/L NaCl)缓冲液将肌原纤维蛋白配制成20 mg/mL的蛋白溶液。将蛋白溶液缓慢注入装有双蒸水的烧杯中,搅拌,直至样品的均匀性指数达到0.538~0.622。记录样品的表面积平均粒径(D32)和体积平均粒径(D43)。
1.3.6 蛋白质Zeta-电位的测定
蛋白质Zeta-电位使用激光粒度仪在常温下测定。根据Zhang Longtao等[20]的方法并稍有改动。用蒸馏水稀释1 mg/mL肌原纤维蛋白溶液到0.1 mg/mL后,取1 mL溶液注入至弯曲毛细管样品池中测定Zeta-电位。
1.3.7 蛋白质乳化活性的测定
蛋白乳化活性指数(emulsifying activity index,EAI)根据Diao Xiaoqin等[21]的方法进行测定。将8 mL蛋白溶液(1 mg/mL)和2 mL的大豆油放入2.5 cm离心管高速匀浆1 min。匀浆后立即从距离心管底部0.5 cm处取50 μL匀浆液加入到5 mL 0.1% SDS溶液中,混匀后在500 nm波长处测定吸光度,空白为0.1% SDS溶液。EAI的计算如下式所示。

式中:ρ为乳化前肌原纤维蛋白的质量浓度/(g/mL);A500nm是在500 nm波长处测得的样品的吸光度;φ为油相体积分数(φ=20%);n为稀释倍数(100)。
1.3.8 乳液液滴分布的观察
按照1.3.7节的方法制备蛋白乳液,均质后迅速从距离心管底部0.5 cm处取50 μL匀浆液滴到载玻片上,缓缓放上盖玻片后用40 倍光学显微镜观察并用相机拍照。用Image-Pro Plus软件对乳液液滴的直径进行统计分析。
1.4 数据统计分析
实验制备3 批鸡胸肉。每一批样品至少进行3 次平行。结果用平均值±标准偏差表示,采用Statistix 8.1软件包中Linear Models程序进行数据统计分析,显著性分析使用Tukey HSD程序(P<0.05表示差异显著)进行,采用Sigma Plot 12.5软件作图。
2 结果与分析
2.1 不同冷冻处理对肌原纤维蛋白溶解度的影响
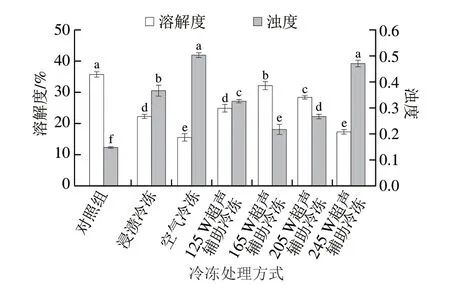
图 1 不同冷冻处理的鸡胸肉肌原纤维蛋白溶解度和浊度的变化Fig. 1 Changes in solubility and turbidity of myofibrillar protein from chicken breast with different freezing treatments
蛋白质溶解是蛋白质与水相互作用的结果[22],可以作为反映蛋白质聚集程度的重要指标[23]。如图1所示,对照组样品的溶解度显著高于冷冻处理组(P<0.05),表明冷冻过程会降低蛋白质的溶解度。这可能是由于冷冻产生的冰晶会破坏蛋白质空间结构,使蛋白聚集变性。在冷冻处理组中,经过不同冷冻处理样品的肌原纤维蛋白具有不同的溶解度,其中超声功率165 W的鸡胸肉样品溶解度显著高于其他冷冻处理组(P<0.05)。这可能是由于165 W超声波产生大量的空化气泡,其可以作为初级晶核,降低溶液过冷度,加速冷冻过程。Xu Baoguo等[24]也发现适当的超声处理(0.26 W/cm2)会减小冰晶尺寸,加快冷冻速率。此外,Wang Jingyu等[17]研究发现超声时间短于9 min时,超声作用可以提高蛋白质的溶解度,而本实验中超声作用时间在此范围内,因此蛋白溶解度便得以提高。但是,较低的超声功率(125 W)和较高的超声功率(245 W)都会导致蛋白质溶解度降低。这可能是由于超声功率较低时产生的空化气泡数量少,微射流效应较弱,从而不能达到快速冷冻的效果。因此较低的超声功率会生成较大的冰晶,并对肌原纤维蛋白造成破坏。而高功率超声波可能会分解水分子形成自由基,引起肌原纤维蛋白集聚变性,进而导致蛋白溶解度降低。空气冷冻样品的溶解度在所有样品中最低(15.36%),Wagner等[1]认为慢速冷冻产生的大冰晶会破坏蛋白质空间结构,使得蛋白质内部疏水基团暴露,所以蛋白质表面与水结合程度减弱,溶解度降低。
2.2 不同冷冻处理对肌原纤维蛋白浊度的影响
样品溶液浊度的变化可以用来评估溶液中蛋白质的聚集程度。溶液中蛋白质聚集程度越小,则溶液中悬浮颗粒粒径越小,浊度越小,反之亦然。从图1可知,对照组具有最低的浊度(0.15)。随着超声功率的增加,样品的浊度先降低后增加,在功率为165 W时最小(0.22),这可能是由于165 W超声功率所产生的剪切和湍流等空化现象会破坏蛋白质间的相互作用,从而减小了蛋白质的粒径,降低了样品的浊度[25]。空气冷冻和浸渍冷冻样品的浊度显著高于165 W超声辅助冷冻的样品(P<0.05)。这可能是因为慢速冷冻形成的大冰晶会对蛋白质结构产生不可逆的破坏,导致蛋白质聚集物形成,造成样品浊度升高。从图1中还可以看出,过高的超声功率(245 W)会导致样品浊度增加,这是因为较高的超声功率会使蛋白质变性,这进一步印证蛋白质溶解度的结果。因此,适当的超声功率(165 W)有助于降低冷冻样品的浊度。
2.3 不同冷冻处理对肌原纤维蛋白粒径分布和大小的影响
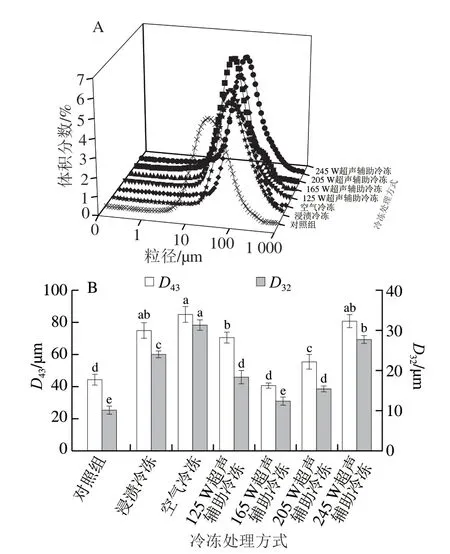
图 2 不同冷冻处理对鸡胸肉肌原纤维蛋白粒径的影响Fig. 2 Effects of different freezing treatments on the particle size of myofibrillar protein from chicken breast
鸡胸肉肌原纤维蛋白乳状液中分散相粒径分布和微粒大小会影响乳状液的稳定性,因此本实验利用动态光散射来定量检测乳状液中分散相微粒大小和分布。如图2A所示,在所有样品中,对照组具有最小的粒径。与对照组相比,冷冻组的粒径分布都不同程度地向粒径增大的方向移动。这与Degner等[2]的研究结果一致,研究发现在冷冻过程中尤其是慢速冷冻,样品粒径分布会出现400~500 μm的较大颗粒群,表明冷冻产生的冰晶破坏了蛋白质结构使蛋白质变性集聚。图2B为不同冷冻处理样品的D43和D32。可以看出随着超声功率的增加,D43先减小后增大,其中在超声功率为165 W时达到最小(40.94 μm),与对照组间没有显著性差异(P>0.05)。这可能是由于当超声功率达到165 W时产生的空化气泡可以作为初级晶核促进冰晶形成,从而加快了冷冻速率。此外超声空化产生的剪切力还可以破坏蛋白间氢键、疏水相互作用和静电相互作用,从而减小蛋白质的粒径[18]。毕爽等[26]也发现低功率超声(150 W)产生的空化效应会减小大豆分离蛋白的粒径。但是随着超声功率增加到245 W时,D43显著高于其他超声处理组(P<0.05)。这可能归因于在高超声功率(245 W)下,由空化气泡破裂和空化气泡传播而引起的机械振动会破坏肌原纤维蛋白。叶钰等[27]研究发现高功率的超声波(200 W和400 W)会使蛋清溶液粒径变大,蛋白质发生聚集。因此,适当的超声功率(165 W)冷冻处理在加快冷冻速率的同时会减小蛋白质粒径,防止蛋白质聚集。
肌原纤维蛋白D32的变化与D43的变化相似。如图2B所示,空气冷冻具有较大的D32,表明在空气冷冻过程中形成了更大的蛋白质聚集物。这可能是因为在慢速冷冻过程中形成大而不规则的冰晶,破坏了肌原纤维蛋白空间结构,使蛋白质内部疏水基团暴露并相互作用,从而导致蛋白质聚集。Zhao Juyang等[28]也发现氢键、疏水相互作用等非共价作用的形成会促进蛋白质的聚集并使平均粒径增大。而超声功率为165 W的样品较其他冷冻组具有较低的D32,表明165 W超声辅助冷冻有助于防止蛋白质聚集。
2.4 不同冷冻处理对肌原纤维蛋白Zeta-电位的影响
Zeta-电位可以反映体系中悬浮的蛋白颗粒相互作用的强弱。一般来说,电位绝对值越高,液滴之间排斥力强度越大,溶液体系的物理稳定性越强[29-30],反之,电位绝对值越低,液滴之间排斥力强度越小,蛋白质颗粒越容易聚集和絮凝。因此Zeta-电位可以作为一个重要的指标来评价肌原纤维蛋白溶液的稳定程度。图3为不同冷冻处理的鸡胸肉肌原纤维蛋白Zeta-电位的变化情况。在所有样品中对照组和165 W超声功率冷冻的样品具有最大的电位绝对值,且两组样品的Zeta-电位绝对值之间没有显著性差异(P>0.05),表明使用165 W超声功率冷冻的样品在冷冻过程中肌原纤维蛋白不容易发生凝聚和絮凝。在超声处理组中,Zeta-电位绝对值随着超声功率的增加而呈现先升高后降低的趋势,其中165 W超声辅助冷冻样品的电位绝对值最大。Zhang Ziye等[31]研究发现,超声处理能够提高蛋白质的电位绝对值。相似的结果也被Kang Dacheng等[32]报道,发现20 kHz超声会导致部分蛋白结构展开,进而增加蛋白质表面电荷的结合位点。这有利于增强蛋白质间排斥力,从而阻碍蛋白聚集。另外,蛋白质表面电位绝对值越大,表明蛋白质和水的相互作用越强,蛋白质溶解程度越好[31]。这与165 W超声辅助冷冻样品具有较高的蛋白溶解度是一致的。但是高超声功率(245 W)会使Zeta-电位绝对值降低。根据粒径的结果分析,这可能是由于较高的超声功率会分解水分子产生活性自由基促使蛋白质间发生氧化聚集,导致蛋白质粒径增大,蛋白表面负电荷减少,进而造成电位绝对值降低[33]。浸渍冷冻、空气冷冻和245 W超声辅助冷冻样品的电位绝对值之间没有显著性差异(P>0.05)。因此,适当功率(165 W)的超声辅助冷冻能够增加蛋白质表面电位绝对值,防止蛋白质发生聚集和絮凝。

图 3 不同冷冻处理的鸡胸肉肌原纤维蛋白Zeta-电位的变化Fig. 3 Changes in Zeta potential of myofibrillar protein from chicken breast with different freezing treatments
2.5 不同冷冻处理对肌原纤维蛋白乳化活性的影响
EAI是指蛋白质在形成乳状液时迅速吸附在水和油界面上,防止发生絮凝和沉淀的能力。EAI主要受到蛋白质与脂质或蛋白质间相互作用的影响[21]。如图4A所示,对照组和165 W超声辅助冷冻样品的EAI分别为13.02 m2/g和11.51 m2/g,且二者之间并无显著差异(P>0.05),表明165 W超声辅助冷冻可以提高肌原纤维蛋白的乳化稳定性。这主要与165 W超声功率可以降低样品的粒径有关。蛋白质粒径越小,表面积越大,所以蛋白质与油相吸附的可能性越大,EAI提高。还有报道发现超声作用能够引发蛋白质构象变化,促使蛋白质内部部分疏水基团暴露,而疏水基团的增加有助于蛋白质吸附于油相界面[34-36],因而可以提高蛋白质乳化活力。此外,由溶解度结果可知,超声功率为165 W的样品具有高溶解度,这也有助于肌原纤维蛋白迅速分散在水和油界面上。卢菊慧等[37]研究发现豌豆蛋白乳液的EAI随着蛋白浓度增加而增大。在所有样品中,空气冷冻的EAI最低,这可能与空气冷冻样品具有较低的Zeta-电位绝对值有关。Zeta-电位绝对值低的蛋白质容易形成大的聚集物,因此在形成乳液时蛋白质不容易吸附在水和油的界面上,导致EAI降低。此外,较高超声功率(245 W)会明显降低EAI,这是因为较高功率超声会诱导蛋白质聚集,降低蛋白质结构的灵活性,促使EAI下降。
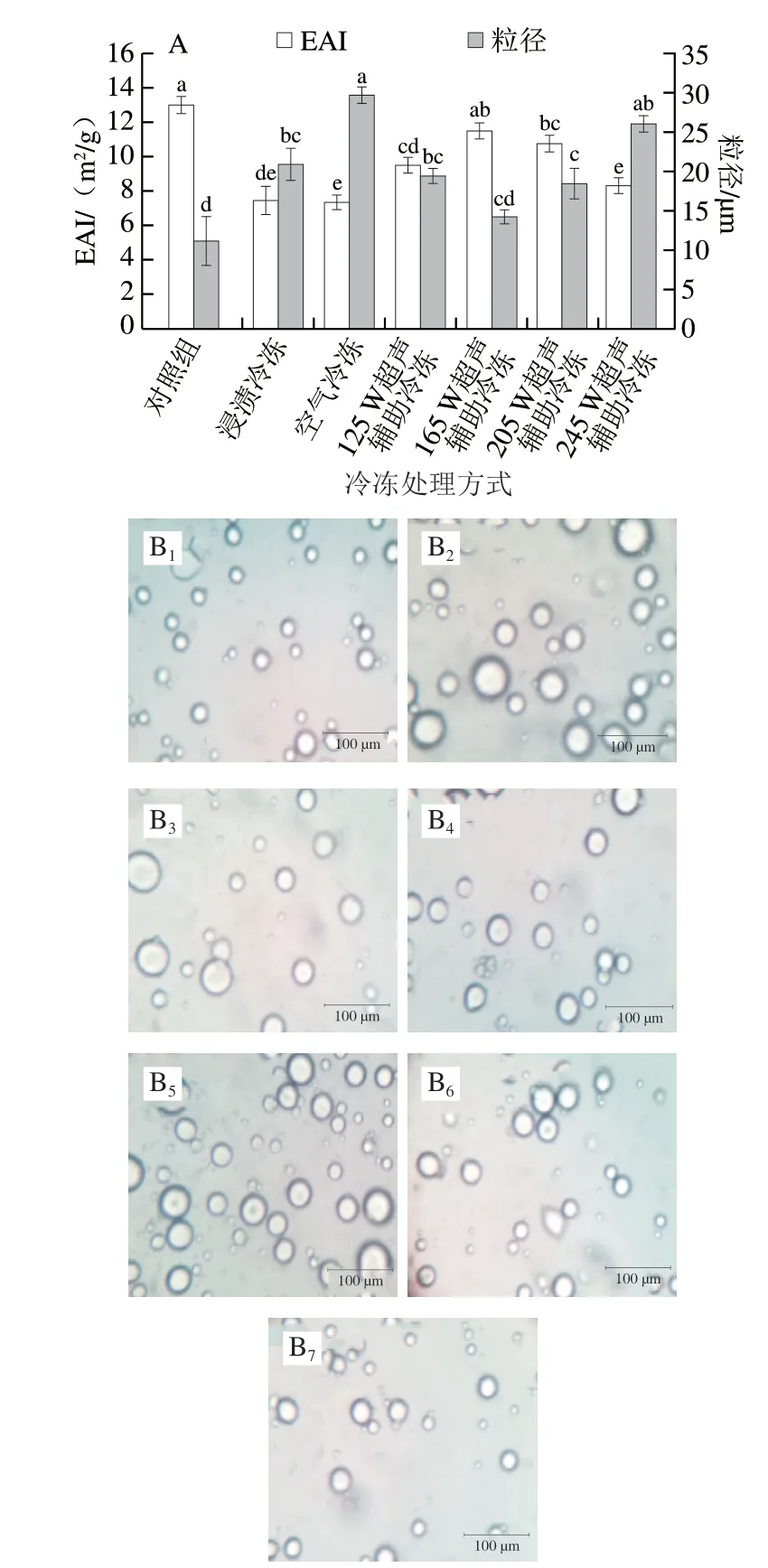
图 4 不同冷冻处理对鸡胸肉肌原纤维蛋白乳化特性的影响Fig. 4 Effects of different freezing methods on the emulsifying properties of myofibrillar protein from chicken breast
图4B为不同冷冻方式的鸡胸肉肌原纤维蛋白乳液分布的微观结构图。经过不同冷冻方式处理的样品乳液分布具有明显差异。结合图4A乳状液液滴的平均粒径发现,在所有处理组中,对照组样品的液滴平均粒径最小(11.17 μm),乳液液滴分布均匀密集。而在冷冻处理组中,超声功率为165 W的样品液滴分布较为均匀,液滴平均粒径为14.24 μm,与对照组样品平均粒径无显著性差异(P>0.05),这一结果与EAI的结果一致。Furtado等[38]发现EAI越高,蛋白质越容易形成均匀密集的乳状液液滴。与165 W超声辅助冷冻样品相比,空气冷冻和浸渍冷冻样品的平均粒径显著增大(P<0.05),液滴分布疏松。这可能是与空气冷冻和浸渍冷冻样品的蛋白溶解度较低有关。此外,较低的电位绝对值也会促使蛋白质聚集,进而导致空气冷冻和浸渍冷冻样品乳液液滴分布疏松,乳液稳定性下降。
3 结 论
本实验研究了不同冷冻方式(空气冷冻、浸渍冷冻)和不同超声功率(125、165、205 W和245 W)的超声辅助冷冻对鸡胸肉肌原纤维蛋白乳化稳定性的影响。通过分析肌原纤维蛋白的溶解度、浊度、粒径、Zeta-电位以及乳状液EAI的测定结果,发现适当功率(165 W)的超声辅助冷冻能够显著增强冷冻鸡胸肉肌原纤维蛋白乳化稳定性(P<0.05)。但是超声功率过高(245 W)则会破坏肌原纤维蛋白的结构,显著降低肌原纤维蛋白的乳化稳定性(P<0.05)。因此,采用适当功率(165 W)的超声辅助冷冻可以有效地提高冷冻鸡胸肉肌原纤维蛋白乳化稳定性。
