蚕豆多酚对过氧自由基介导的DNA损伤的保护作用
2020-09-21卢跃红陈友霞刘珍珍赵一灵高春燕
林 琳,卢跃红,陈友霞,刘珍珍,赵一灵,高春燕
(大理大学公共卫生学院,云南 大理 671000)
蚕豆(Vicia fabaL.)又称胡豆、佛豆、兰花豆等,属豆科一年生草本植物,是我国的重要豆类作物之一[1]。中国是世界上蚕豆种植面积最大的国家[2],中国的菜用和粮用蚕豆以江苏、浙江、安徽、四川、湖北和云南等省种植最多[3]。蚕豆是高蛋白、低脂肪、中等淀粉含量的作物,富含维生素和矿物质[4],其中还含有大量生物活性物质,如原花色素、活性蛋白、异黄酮等,具有抗氧化活性、抗肿瘤、抗过敏、抗炎、抗动脉粥样硬化等生理功能[5-13]。
DNA是生命活动中的重要遗传物质,控制细胞的增殖和分化[14]。有学者研究发现,DNA氧化损伤可导致细胞基因突变、癌变以及神经退行性病变[15]。而过氧自由基(ROO·)可以引起DNA氧化损伤,进而引起各种慢性疾病,其中,清除自由基、提高机体抗氧化能力是许多药物防治慢性疾病的重要途径[16]。目前研究已发现,许多植物如硬毛地笋[14]、黄杞[15]、红豆越橘[17]等的多酚提取物对自由基介导的DNA氧化损伤具有显著的保护作用,但关于蚕豆多酚对ROO·介导的DNA损伤保护作用的研究鲜有报道。我国是世界重要的蚕豆种植大国,其中云南省蚕豆品种资源丰富,通过分析云南省10 种蚕豆种皮和子叶的多酚含量及采用体外2,2-偶氮二异丁基脒二盐酸盐(2,2-azobis(2-methylpropionamidine)dihydrochloride,AAPH)引发产生ROO·损伤pBR322质粒DNA模型,研究其多酚提取物对ROO·介导的DNA损伤的保护作用,旨在为云南省蚕豆优良品种选育、指导消费者食用及提高云南省蚕豆经济价值提供理论依据。
1 材料与方法
1.1 材料与试剂
蚕豆由云南省农业科学研究院蚕豆研究室提供,2017年上半年采样。
Folin-酚试剂 美国Sigma公司;没食子酸 成都市科龙化工试剂厂;儿茶素 晶博生物科技有限公司;AAPH 美国Thermo Fisher公司;Na2CO3、亚硝酸钠、AlCl3、NaOH、甲醇、乙酸乙酯、Tris、琼脂糖均为国产分析纯。
1.2 仪器与设备
DFY-600摇摆式高速万能粉碎机 温岭市林大机械有限公司;JA3003电子天平 上海舜宇恒平科学仪器有限公司;RE-3000旋转蒸发器 上海亚荣生化仪器厂;恒温水浴箱 金坛市大地自动化仪器厂;722N可见分光光度计 上海菁华科技仪器有限公司;DYY-6C型电泳仪 北京市六一仪器厂;G:BOX-F3凝胶成像系统香港基因有限公司;CM-700d分光测色计 日本Konica Minolta公司。
1.3 方法
1.3.1 蚕豆物理参数的测定
参考《蚕豆种植资源描述规范和数据标准》[18]分别测定种皮色和子叶色、粒形、百粒质量。参考田晓红等[19]的方法分别测定蚕豆种皮质量分数、颜色(明度L*、红绿度a*、黄蓝度b*)和密度。
1.3.2 蚕豆多酚的提取
参考文献[20]的方法稍作修改,将自然成熟干燥的10 个品种蚕豆手工分离出种皮和子叶,粉碎过60 目筛。分别精密称取种皮粉末5.0 g、子叶粉末10.0 g,加入10 倍体积的体积分数80%甲醇溶液,室温下超声波(59 kHz)辅助提取3 次,每次10 min,抽滤,合并滤液,35 ℃下旋转蒸发除去甲醇,剩余水相用6 mol/L盐酸溶液调节pH值(pH 1~2),后用乙酸乙酯萃取5 次,合并乙酸乙酯相,37 ℃旋转蒸发去除乙酸乙酯,残留物用少量二甲基亚砜溶解,后用蒸馏水定容至10 mL,得蚕豆多酚提取液。
1.3.3 总酚含量的测定
采用Folin-酚法[21]测定总酚含量,得没食子酸标准曲线方程为y=0.073 7x+0.050 6(0~6.4 μg/mL),决定系数R2=0.997 9。样品中的总酚含量结果以每克蚕豆中与没食子酸相当的质量表示(mg/g)。
1.3.4 黄酮含量的测定
采用亚硝酸钠-氯化铝法[22]测定黄酮含量,得儿茶素标准曲线方程为y=0.009 6x+0.011 8(0~50 μg/mL),决定系数R2=1.000 0。样品中的黄酮含量结果以每克蚕豆中与儿茶素相当的质量表示。
1.3.5 蚕豆多酚对ROO·介导的DNA损伤保护作用的测定
参考Spanou等[23]的方法稍作修改。将蚕豆多酚提取液配制成质量浓度为25 μg/mL的待测液,反应液共20 μL,包括1 μL(0.5 μg/L)pBR322质粒DNA、11 μL(10 mmol/L、pH 7.4)磷酸盐缓冲液(phosphate buffered saline,PBS)、5 μL蚕豆多酚待测液或Trolox(质量浓度分别为6.25、12.5、25、50、100 μg/mL)和3 μL(50 mmol/L)AAPH溶液,充分混匀后置于37 ℃水浴中避光反应45 min。反应结束后吸取4 μL反应液与2 μL loading buffer(含0.15%溴酚蓝、10 mmol/L乙二胺四乙酸和40%蔗糖)混合均匀,准确吸取4 μL混合液置于1.0%的琼脂糖凝胶(含0.5 μg/mL溴化乙锭)中,并在Tris/乙酸/乙二胺四乙酸缓冲溶液中电泳50 min。待电泳结束后,利用凝胶成像系统进行半定量分析。空白对照使用PBS代替蚕豆多酚待测液,正常对照用PBS代替蚕豆多酚待测液和AAPH溶液,用Trolox作为阳性对照。按下式计算双螺旋比例。

式中:A1为双螺旋DNA的灰度;A2为开环型DNA的灰度;A3为线型DNA的灰度。
1.4 数据统计分析
所有实验重复3 次,数据用平均值±标准差表示,采用Excel、SPSS 20.0软件的Tukey HSD法进行显著性检验。
2 结果与分析
2.1 蚕豆物理参数

图 1 10 种蚕豆的外观形状Fig. 1 Appearance of 10 varieties of broad beans
由表1、图1可知,10 种蚕豆的百粒质量范围为80.71~149.59 g,其中‘云豆5932’最小,‘云豆147’最大,有两个品种百粒质量小于100 g,分别为‘云豆3145’(93.54 g)和‘云豆5932’(80.71 g),10 个品种中最大百粒质量与最小百粒质量相差68.88 g,比田晓红等[19]的研究结果低,表明云豆系列蚕豆质量性状总体上较相似。10 种蚕豆的皮占总质量的比例范围为13.26%~16.76%,变化范围较小,‘云豆5932’的最低,‘云豆459’的最高。10 种蚕豆密度范围为1.09~1.28 g/cm3,‘云豆459’最小,‘云豆5932’最大。10 种蚕豆的长度范围为1.31~2.10 cm,宽度范围为1.05~1.50 cm,高度范围为0.49~0.73 cm,‘云豆5932’的长度和宽度最小,‘云豆459’的高度最小,‘云豆1299’的长度和宽度均最大,‘云豆5932’的高度最大,‘云豆5932’长宽比较小,粒形为近球形,最有利于机械化生产。
L*值为0时表示物体为对光完全吸收的黑体;L*值为100时表示物体为对光完全反射的纯白物体[19],10 种蚕豆的L*值范围为36.86~50.69,‘云豆1299’最小,‘云豆5932’最大;10 种蚕豆的a*值范围为5.19~18.32,均为正值,表现为偏红色,其中‘云豆112’最小,‘云豆16’最大;10 种蚕豆的b*值范围为19.98~29.97,均为正值,表现为偏黄色,其中‘云豆1299’最小,‘云豆1862’最大。
2.2 蚕豆多酚提取物总酚和黄酮含量
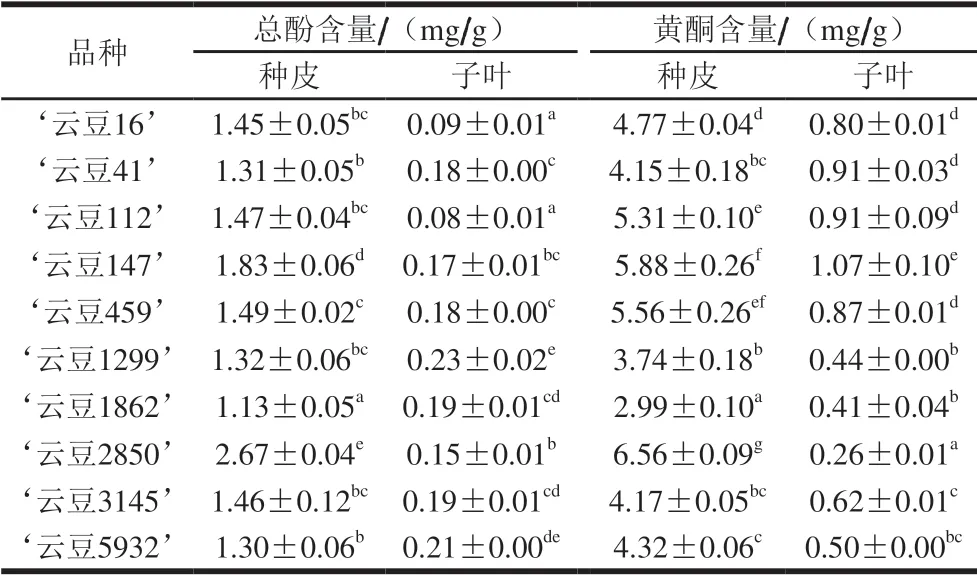
表 2 10 种蚕豆的总酚和黄酮含量Table 2 Total polyphenol and flavonoid contents of 10 varieties of broad beans

表 1 10 种蚕豆的物理参数Table 1 Physical parameters of 10 varieties of broad beans
由表2可知,种皮中总酚含量范围为1.13~2.67 mg/g,其中‘云豆1862’含量最低,‘云豆2850’含量最高;子叶中总酚含量范围为0.08~0.23 mg/g,其中‘云豆112’含量最低,‘云豆1299’含量最高。种皮中黄酮含量范围为2.99~6.56 mg/g,其中‘云豆1862’含量最低,‘云豆2850’含量最高;子叶中黄酮含量范围为0.26~1.07 mg/g,其中‘云豆2850’含量最低,‘云豆147’含量最高。
结果表明,蚕豆种皮中的总酚和黄酮含量显著高于子叶,与Chaieb等[24]的研究结果一致。儿茶素没食子酸酯、没食子酸原花青素二聚体和表儿茶素是整粒蚕豆提取物中的主要酚类物质[25],而原花青素主要分布于蚕豆种皮中,质量分数最高可达12%[26-28]。刘玉皎[29]研究得出种皮颜色可以作为鉴定原花青素含量高低的标志性状,颜色越深,原花青素含量越高,蚕豆种皮颜色较子叶深,故蚕豆种皮中总酚和黄酮含量较高。不同品种间蚕豆种皮与子叶中多酚和黄酮含量差异显著,此结果与杨希娟[30]的研究结果一致,可能与不同品种蚕豆的培育方法、培育时间、培育环境等不同有关。蚕豆种皮和子叶总酚和黄酮含量总和低于赵艳等[31]报道的结果(总酚含量8.05~8.37 mg/g、黄酮含量6.80~7.54 mg/g),结果的差异可能与蚕豆来源、品种及提取测定方法差异有关。
相关性分析结果表明,10 种蚕豆种皮中总酚含量与黄酮含量具有极显著正相关性(r=0.814,P<0.01);相反,子叶中总酚和黄酮含量呈显著负相关关系(r=-0.375,P<0.05)。表明在种皮中,黄酮是主要的酚类化合物,对总酚的含量具有显著的贡献,而在子叶中,黄酮类化合物含量较低,游离酚酸可能是其主要的酚类化合物。
2.3 蚕豆多酚提取物对ROO·介导的DNA损伤的保护作用
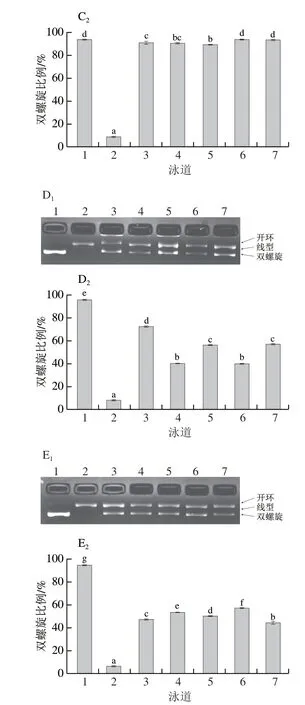
图 2 Trolox和蚕豆多酚提取物对ROO·介导的DNA损伤的保护作用Fig. 2 Protective effect of Trolox and polyphenols from broad beans on DNA damage induced by ROO· radicals
蚕豆多酚提取物对ROO·介导的DNA损伤的保护作用以DNA双螺旋比例表示,保护作用越强,DNA损伤越少,显示双螺旋比例越高。由图2A1~E1的泳道1可见,正常pBR322质粒DNA以DNA双螺旋结构为主,被ROO·损伤后(图2A1~E1泳道2),DNA双螺旋结构转变成开环型或者线型结构,当添加蚕豆多酚提取物或人工合成抗氧化剂Trolox后,DNA双螺旋结构未全部转变成开环型或线型结构,说明蚕豆多酚提取物和人工合成抗氧化剂Trolox可在一定程度上阻止由ROO·引起的DNA双链的断裂。
由图2A1可知,不同质量浓度的Trolox对ROO·介导的DNA损伤均有保护作用,在6.25~50 μg/mL范围内,DNA双螺旋比例范围为86.15%~91.80%,保护作用随着质量浓度的增加而增加,但当质量浓度增加到50 μg/mL以上时,不同质量浓度Trolox对DNA损伤的保护作用差异无统计学意义(P>0.05)。
对于蚕豆种皮来说,在25 μg/mL Trolox下,DNA双螺旋比例范围为86.38%~93.91%(图2B2和C2),其中‘云豆147’的保护作用最弱,‘云豆3145’的保护作用最强,且‘云豆3145’、‘云豆5932’可使正常pBR322质粒DNA基本不受损伤,与正常组的DNA双螺旋比例无显著性差异(P>0.05),蚕豆种皮多酚提取物的保护作用效果均较好,与100 μg/mL的Trolox的保护作用相似;对于蚕豆子叶来说,在25 μg/mL质量浓度下,DNA双螺旋比例范围为39.13%~71.90%(图2D2和E2),其中‘云豆147’的保护作用最弱,‘云豆16’的保护作用最强。
酚类化合物抗氧化机理主要是通过酚羟基递氢反应来清除AAPH引发产生的ROO·,起到抗氧化的作用,酚羟基周围的取代基对酚羟基的递氢能力有重要影响[32],所以酚类化合物自身的结构影响酚类化合物的DNA损伤保护作用。结果显示,同一多酚质量浓度,不同品种间DNA损伤保护作用具有差异,且同一品种种皮的保护作用强于子叶。因此,不同品种、不同部位蚕豆多酚提取物对ROO·介导的DNA损伤保护作用的差异,可归因于不同部位以及不同品种的蚕豆多酚提取物中所含的单体不同。此外,结果表明,种皮颜色深的蚕豆品种对DNA损伤的保护作用较好,这与Marathe等[33]的研究结果一致,表明蚕豆种皮多酚提取物具有较好的DNA氧化损伤保护活性。然而蚕豆种皮因其过硬的口感常被人们所丢弃,若能将蚕豆种皮进行开发利用,将对预防慢性疾病大有裨益。
3 结 论
不同品种的蚕豆物理参数不同;蚕豆种皮和子叶中总酚含量范围分别为1.30~2.67、0.08~0.23 mg/g,黄酮含量范围分别为2.99~6.56、0.26~1.07 mg/g,种皮高于子叶,且不同品种总酚和黄酮含量具有差异;种皮和子叶多酚提取物对ROO·介导的DNA损伤双螺旋比例范围分别为86.38%~93.91%和39.13%~71.90%,种皮的保护作用显著强于子叶。结果表明,蚕豆酚含量丰富,具有显著的DNA氧化损伤保护作用,可作为抗氧化食品食用,且在食用过程中,不应将种皮丢弃。另外,在种植加工过程中,应根据生产需要选择适宜的蚕豆品种。
