以钢渣为原料制备水滑石脱除水中重金属的研究
2020-09-17上海宝钢新型建材科技有限公司上海201999
王 林(上海宝钢新型建材科技有限公司, 上海 201999)
钢渣是钢铁工业生产中产生的主要副产物。每年产生大量的钢渣堆放不仅污染环境,而且还会浪费宝贵的土地资源。钢渣目前主要用作水泥添加料、道路路面混凝土、硅肥等,大多数为粗放、大宗式利用,效率低,难以产生良好的经济效益。钢渣的低效率利用阻碍了钢铁企业的可持续发展。钢渣利用发展需走向高效、高附加值、无污染的精细化方向。对于钢渣中的主要元素 Ca、Al、Mg、Si等要充分利用。水滑石,又被称为双羟基金属复合氧化物(LDHs),对水体中 Ni、Cr、Cu 等重金属具有较好的吸附作用。本文以钢渣酸解液制备 CaMgAl 水滑石作为吸附剂脱除水中 Ni2+、Cr6+、Cu2+等重金属离子,不仅能实现钢渣的高效、高附加值利用,而且是利用一种固体废弃物处理重金属污染的废水,对实现资源的绿色循环利用具有重要意义。
1 实验方法
1.1 原料组成
本文所用的钢渣为宝钢 S 95 白色粉状颗粒物。采用 X射线荧光光谱法对水渣 S 95 的组分进行分析,结果如表1所示。

表1 S 95 组成 %
1.2 钢渣水解
在带有搅拌器、温度计和分液漏斗的四口烧瓶中加入10 g 左右钢渣,用适量水搅拌配置成浆料,再滴加硝酸。根据钢渣中 Ca、Mg、Al 和 Fe 的含量,控制硝酸用量为理论反应量的 1.03~1.05。酸解反应是放热反应,采用水冷控制酸解温度在 45 ℃。反应结束后过滤,滤渣洗涤至中性,干燥后用 XDF 分析含量。滤液采用 ICP-AES 分析含量。
1.3 CaMgAl-LDH 水滑石的合成
采用共沉淀法,以钢渣酸解液为原料,合成钙镁铝类水滑石 CaMgAl-LDH。配制 1 mol/L 的氢氧化钠溶液作为碱溶液。在带有搅拌器、温度计和分液漏斗的四口烧瓶中将碱溶液和酸解液分别加入不同的恒压分液漏斗中。控制滴加速度,使得瓶内 pH 值保持恒定为 10.5~11.0。滴加完毕后继续搅拌 1 h,随后将反应物在 75 ℃ 下晶化 24 h。过滤、洗涤至 pH 值为 7。滤饼在 75 ℃ 下干燥、研磨得到CaMgAl-LDH。
1.4 CaMgAl-LDH 水滑石的结构表征
对合成的 CaMgAl-LDH 水滑石的组成和结构进行分析。采用日本理学公司生产的 18KW/D/max2550VB/PC 型X 射线衍射仪分析样品晶体结构,扫描范围 5°~75°。采用美国康塔公司 QUADRASORB SI 比表面积分析仪对合成的CaMgAl-LDH 粉末样品进行孔径和比表面积的分析。采用日本日立公司的 S-3400N 型发射扫描电镜,来观察和分析样品表面的形貌结构。采用美国尼高力公司 6700 型傅里叶红外光谱仪,进行 FT-IR 表征。
1.5 水中金属离子的吸附脱除方法
采用 Ni、Cr 和 Cu 标准溶液配置模拟废水,在烧瓶中加入模拟废水,恒搅拌一定时间后取出吸附溶液,离心分离,取上层清液分析吸附后水中重金属含量。水中单独存在 Ni时,其含量采用《分光光度法快速测定工业废水中的镍含量》方法分析。多种重金属离子共存时,采用美国赛默飞公司的 ICS-1100 型离子色谱仪进行测定。计算脱除率R的方法如式(1)所示。
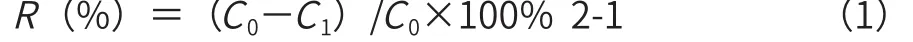
式中:R—重金属离子的脱除率,%;
C0—溶液中的重金属离子的初始浓度,mg/L;
Ct—吸附后溶液中的重金属离子的浓度,mg/L。
2 结果与讨论
2.1 钢渣酸解效果
在优化酸解条件后,发现当硝酸浓度 25%、搅拌时间 20 min、搅拌转速 160 r/min 时,酸解效果较好,滤渣中 SiO2含量 >90%,表明钢渣中酸溶性元素如 Ca、Mg、Al 等基本溶解。酸解滤液中 Ca2+、Mg2+等二价金属离子与Al3+等三价金属离子的原子比约为 2.76∶1。物料平衡核算也表明酸解过程中各元素基本平衡。硝酸滤渣的元素组成见表2,硝酸滤液的元素组成见表3,物料平衡表见表4。

表2 硝酸滤渣的元素组成 %
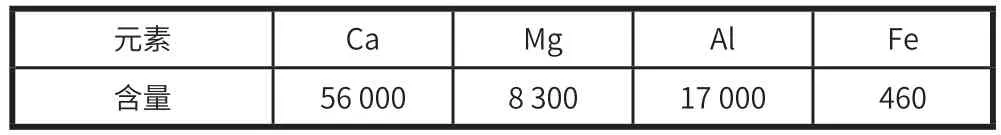
表3 硝酸滤液的元素组成 mg/L
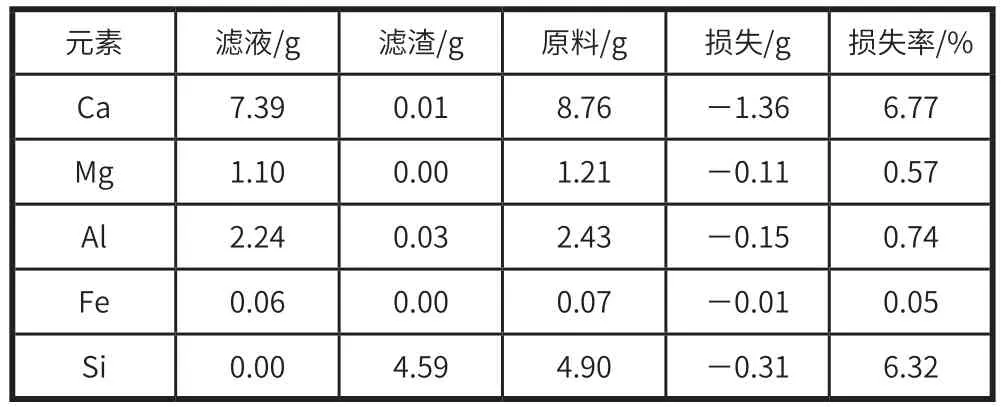
表4 物料平衡表
2.2 CaMgAl 水滑石的结构表征
以上述钢渣酸解液通过共沉淀法制备 CaMgAl 水滑石,因含有微量的铁元素,故为微黄粉末。CaMgAl-LDH 的 XRD谱图如图 1 所示。

图1 CaMgAl-LDH 的 XRD 谱图
由图 1 可以看出,合成的 CaMgAl-LDH 在 2θ分别为21.82、29.34、34.2、60.74 处都出现了强而尖锐的衍射峰,分别属于 006、012、110 和 113 特征衍射峰,并且基线低而平稳、衍射峰强度较大而且尖锐、对称性好、杂峰少。这说明,合成的 CaMgAl-LDH 具有很好的晶型,具有水滑石类材料的特征衍射峰。
CaMgAl-LDH 的扫描电镜(SEM)谱图如图 2 所示。

图2 CaMgAl-LDH 的 SEM 谱图
由图 2 CaMgAl-LDH 的 SEM 谱图可见,CaMgAl-LDH具有“花瓣”状的层状结构。因为水滑石的层板内部是通过共价键作用相互连接,而层板与层板间的阴离子之间是通过较弱的静电作用和氢键作用而连接在一起的。由于水滑石内部共价键作用较强而层板和层板阴离子之相互作用较弱,使得水滑石的取向生长强弱不同,因此更易于生长成为层状结构的片状晶粒。
采用氮气吸附法来测定 CaMgAl-LDH 的比表面积和孔分布。图 3 和图 4为 CaMgAl-LDH 的吸附脱附曲线和孔径分布。根据 Brunauer 分类法,从图 3 和图 4 中可以看出,CaMgAl-LDH 的吸附曲线存在滞后环,表明合成的这种水滑石材料为 Ⅳ 型吸附等温线,即拥有介孔材料的典型特征。根据 BET 和 BJH 公式计算可以得到 CaMgAl-LDH 的比表面积、孔径分布见表5。
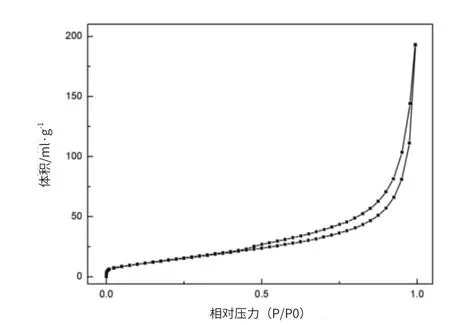
图3 CaMgAl-LDH 的吸附脱附曲线
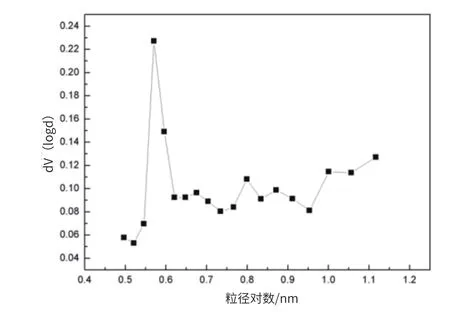
图4 CaMgAl-LDH 的孔径分布

表5 CaMgAl- LDH 的比表面积和孔结构
2.3 CaMgAl 水滑石对水中重金属吸附性能的评价
2.3.1 CaMgAl 水滑石脱 Ni2+ 性能评价
在 Ni2+质量浓度为 20 mg/L 的 100 mL 废水中加入吸附剂 100 mg,在温度 35 ℃、吸附时间 6 h 的条件下,以钢渣酸解液制备的 CaMgAl-LDH 与市售 MgAl 水滑石(MgAl-LDH)和 S 95 钢渣对模拟含 Ni 废水的脱除效果见表6。由实验结果可知,CaMgAl-LDH 对水体中 Ni2+的脱除率可达到86.45%,其脱镍效果优于 MgAl-LDH 和 S 95 钢渣。
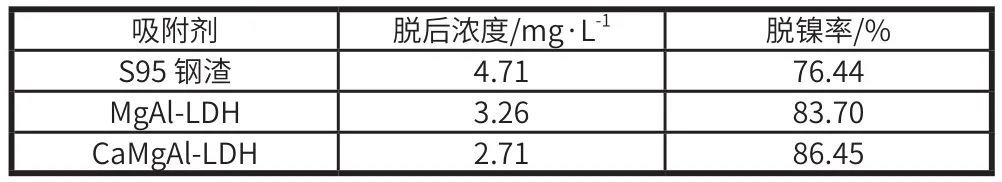
表6 不同吸附剂对 Ni2+ 的吸附
2.3.2 吸附条件对 CaMgAl 水滑石脱 Ni2+ 效果的影响
(1)吸附时间对镍离子吸附的影响。在 25 ℃、20 mg/L的 100 mL 含镍废水中加入 100 mg 的 CaMgAl-LDH 进行吸附,结果见表7。由表7 可见,CaMgAl-LDH 脱除镍离子的效果优于钢渣。随着吸附时间的延长,2 种吸附剂去除镍离子的效率均逐渐增大并达到平衡。在吸附初始阶段时,镍离子的吸附率随时间的增加而增大得较快。随着时间的增加,镍离子吸附速率逐渐变小,直至镍离子的吸附率基本保持不变。钢渣、CaMgAl-LDH 达到吸附平衡时间分别为 50 min 和40 min,对水中镍离子的吸附率分别为 69.45% 和 86.10%。在吸附过程的初始阶段,吸附剂的表面有大量的未被吸附的吸附位点,而此时溶液中镍离子的浓度较高,吸附剂表面和溶液中镍离子浓度差越大,所以传质动力高、吸附快。随着吸附过程的进行,吸附剂表面上的吸附位点逐渐被镍离子填充,传质动力降低,使得吸附速率降低,吸附逐渐平衡。
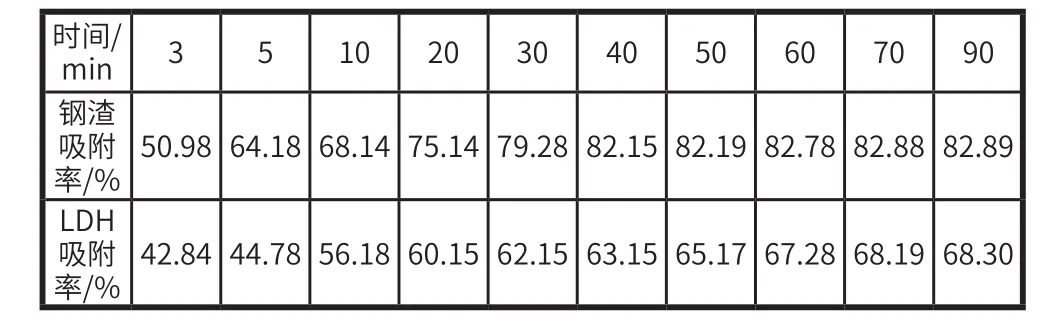
表7 吸附时间对镍吸附效果的影响
(2)吸附温度对 Ni2+吸附的影响。在吸附时间为 2 h,其他条件如上所示的条件下,在 20~60 ℃ 范围内考察温度对吸附效果的影响,结果见表8。由试验结果可知,随着温度的升高,吸附率逐渐提高;当温度达到 40 ℃ 时,随着温度的升高,吸附率增加缓慢。由此可见,40 ℃ 时CaMgAl-LDH 吸附镍离子效果较好。

表8 吸附温度对镍吸附效果的影响
(3)CaMgAl-LDH 加入量对吸附效果的影响。在吸附时间为 1 h,考察CaMgAl-LDH 加入量对水中镍离子的脱除效果。吸附剂加入量对镍吸附效果的影响见表9。由表9 可知,随着 CaMgAl-LDH 用量的增加,Ni2+的脱镍率增加。当CaMgAl-LDH 的用量增加到 200 mg 时,Ni2+的脱镍率达到99%,再增加用量对脱镍效果的改善影响不大。这主要是因为在吸附过程中,随着吸附剂用量的增加,能够与镍离子反应的活性位点增加,吸附量增加,脱除率提高。

表9 吸附剂加入量对镍吸附效果的影响
(4)初始 pH 对 Ni2+吸附的影响。镍离子在溶液中的存在形态受到溶液pH 的影响,pH 也会影响到水滑石表面电位、表面电荷密度,进而会影响水滑石对镍离子的吸附作用。制备一系列质量浓度为 20 mg/L 的 Ni2+水溶液,用硝酸和氨水溶液调节 pH,将 pH 值分别调节至 2~12,常温下加入 100 mg 的钢渣、CaMgAl-LDH 搅拌吸附 2 h 。由前序试验结果可知,在相同 pH 的条件下,CaMgAl-LDH 对水溶液中 Ni2+的吸附优于钢渣。随着 pH 的增加,CaMgAl-LDH 对镍离子的脱除率先增加。当 pH 达到 8 以后,再增加 pH,脱镍效果基本不变。这是由于 Ni(OH)2的沉淀稳定常数为 6×10-16,所以在溶液中的 Ni2+的浓度为 20 mg/L时,当溶液的 pH 超过 8 时会产生沉淀。当溶液呈较强的酸性时,CaMgAl-LDH 对 Ni2+的吸附率较低,当 pH 达到5~8 时,CaMgAl-LDH 对 Ni2+的吸附率增加幅度较大。pH达到 8 时,CaMgAl-LDH 对 Ni2+的吸附率达到 94.93%。当溶液为碱性时,CaMgAl-LDH 对 Ni2+的吸附率基本上稳定在 95% 或者更高。导致该现象的主要原因是 pH 影响了CaMgAl-LDH 表面上吸附镍离子的吸附位点数量。当 pH<7时,H+与 Ni2+共存时会争夺 CaMgAl-LDH 表面有限的吸附位点,从而降低吸附率。当 pH>7 时,CaMgAl-LDH 中的铝羟基、镁羟基发生水解,可以另外提供吸附位,提高吸附效率。pH <7.5 时,Ni2+在溶液中主要以 Ni2+和 NiOH+形式存在,水滑石会与这两种形式的离子发生离子交换作用,但是由于 H+的大量存在抑制了该反应的进行,甚至大量的 H+还会将初期被吸附的部分 Ni2+和 NiOH+从水滑石中交换出来,水滑石的吸附效率低。当 pH>7.5 后,Ni2+形成 Ni(OH)2沉淀,吸附率提高。当 pH>10.2 后,会形成Ni(OH)3-,同时水滑石表面解离出 OH-使其带正电,因此能够与 Ni(OH)3-发生静电吸附从而有利于镍离子的净化。

表10 溶液 pH 对镍吸附效果的影响
2.3.3 多金属共存对吸附效果的影响
由于废水中较少存在单一重金属污染的情况,因此也考察了 CaMgAl-LDH 在多种重金属共存时的吸附效果。铬的形态存在一般为三价和六价,属于一种毒性较强的重金属元素。其中六价铬的危害较大,易被人体吸收且积累从而导致皮肤过敏、遗传性基因缺陷等。六价铬广泛应用于电镀、制革、印染等工业。在冶炼、金属加工、有机合成和其他工业的废水中铜含量较高,曾经在一些小河中也发生过铜污染而引起的水生生物的急性中毒事件。当水源受到污染时,现有的自来水处理工艺无法去除重金属。同时,由于历史原因,大多数的城市输水管网是金属管,随着水管老化会释放出不同量的有害重金属到自来水中,现代家庭中又广泛使用铜管及不锈钢管都有可能在使用过程中释放出 Ni、Cu 和 Cr 等重金属。长期饮用受到重金属污染的水,会对人体造成各种危害。因此,本文考察 CaMgAl-β-CD-LDH 对 Ni、Cu 和 Cr 3种金属的吸附效果。模拟废水中 Ni2+、Cu2+和 Cr6+的浓度均为 30 mg/L,向模拟废水中加入 100 mg 的 CaMgAl-LDH 作为吸附剂,其实验结果如图 5 所示。由图 5 可以看出,就 3种金属的吸附效果而言:CaMgAl-LDH 对 Cr6+的吸附效果最好,吸附容量可达 19 mg/g;其次为 Cu2+,吸附容量为18 mg/g;对 Ni2+的吸附效果最差,吸附容量为 15.5 mg/g。溶液中 Cu2+和 Cr6+的存在,对 CaMgAl-β-CD-LDH 吸附Ni2+产生了一定的抑制作用。

图5 CaMgAl-LDH 对 3 种重金属的吸附效果
3 结 语
以钢渣酸解制备的 CaMgAl-LDH 脱除水溶液中镍离子的效果优于钢渣。当 pH 为 8 时,CaMgAl-LDH 对镍离子的吸附效果较好。CaMgAl-LDH 对重金属的吸附容量排序为:Cr6+>Cu2+>Ni2+, Cu2+和 Cr6+对 CaMgAl-LDH 吸附 Ni2+的效果具有一定的抑制作用。
