3种热带植物幼苗的耐盐性
2020-09-17徐张俊吴向崇崔正坤
赵 斌,徐张俊,吴向崇,郭 昊,崔正坤,陈 颖
(1.南京林业大学南方现代林业协同创新中心,江苏 南京 210037;2.南京林业大学生物与环境学院,江苏 南京 210037;3.三亚新大兴园林生态有限公司,海南 三亚 572000)
土壤盐渍化是影响植物生长的主要因素之一,目前全球约有8×109hm2土地盐渍化[1]。在我国约有3.6×108hm2盐渍化土壤,占全国可利用土地面积的4.9%[2]。盐胁迫对植物产生的伤害有形态和生理的表现,其中,生理表现包括质膜伤害、渗透胁迫、离子平衡失调、代谢紊乱等[3]。有些植物具有耐盐性,它们的耐盐机制主要包括渗透调节与离子分布、盐分的外排和细胞内区隔化、活性氧清除及基因的转录调节等几个方面[4-5]。筛选耐盐植物在盐碱地栽植,可以对盐碱地进行修复和改良,对发挥耐盐植物的防护、观赏、绿化和经济等效能具有重要意义。
凤凰木[Delonixregia(Boj.) Raf]为豆科(Leguminosae)凤凰木属(Delonix)的高大落叶乔木;洋金凤[Caesalpiniapulcherrima(L.) Sw.]为豆科云实属(Caesalpinia)的直立常绿灌木或小乔木;雨树[Samaneasaman(Jacq.) Merr.]为豆科雨树属(Samanea)无刺大乔木。这3种植物是我国热带地区重要的常绿植物,凤凰木和洋金凤都具有鲜艳绚丽的花序,因而具有较强的观赏价值,凤凰木还被多个城市选为市树,如厦门市、中山市等[6-7],雨树生长迅速、抗性强,其荚果含有较多糖分还可用作牛饲料[8]。尽管这3种植物都引自国外,但都已引种多年,有的已成为当地的乡土树种[9]。目前,对凤凰木的药用价值与抗寒性[10-11]、洋金凤种子萌发与活力[12]、雨树在园林绿化中的应用[13]等方面已有研究,但对它们的耐盐性的研究鲜有报道。鉴于此,以凤凰木、洋金凤和雨树3个具有代表性的热带树种为研究对象,对其进行盐胁迫处理,测定其生长和生理指标,并采用隶属函数法对其耐盐性进行综合评价,筛选出耐盐性强的树种,为南方沿海地区耐盐碱植物的选育提供理论依据和指导。
1 材料与方法
1.1 试验材料
2019年3月,于海南省三亚市采集凤凰木、洋金凤和雨树的种子,采集后进行发芽、苗木培育。洋金凤和雨树用蒸馏水直接浸泡发芽,凤凰木用酸处理腐蚀种皮后再进行蒸馏水浸泡发芽。当种胚发芽后,胚根长度达到1 cm以上时,将幼苗播种于盛有基质(V珍珠岩∶V泥炭土∶V园土=5 ∶ 3 ∶ 2)的育苗钵中,每钵1棵,初次浇水浇透,以后每隔3 d浇1次水,一周浇1次1/4 Hoagland营养液,培养3个月。当苗木长至3片羽状叶时,分别选择生长一致、无病虫害的植物苗木进行对照(0 mmol· L-1, CK)、低盐(100 mmol· L-1, N1)、高盐(200 mmol· L-1, N2)的NaCl处理,每个处理20株,3次重复。期间,每隔5 d用各处理所对应的盐溶液20 mL浇灌1次,共浇灌2次,并在育苗钵底部放置托盘回收渗出的盐溶液,保持盐胁迫状态,15 d时测定苗高等生长指标,每个处理随机选取6株,将根剪下,分别测定根和茎叶的质量含水量,剩余植株取叶片用于其他生理指标的测定,3次重复。
1.2 指标测定
根、茎叶质量含水量的测定:分别称其根和茎叶鲜质量(fresh weight, FW),分别放入60 ℃烘箱中24 h,取出分别称其干质量(dry weight, DW),计算含水量,含水量(%)=(根或茎叶鲜质量-根或茎叶干质量)×100/根或茎叶鲜质量。
生理指标的测定:相对电导率、丙二醛(malondialdehyde, MDA)含量、超氧化物歧化酶(superoxide dismutase, SOD)活性、过氧化物酶(peroxidase, POD)活性和过氧化氢酶(catalase, CAT)活性的测定均采用CHENetal[14]的方法。抗坏血酸过氧化物酶(ascorbic peroxidase, APX)活性测定参照NAKANOetal[15]的方法,其中,3 mL的反应体系中包含100 mmol· L-1的磷酸缓冲液(pH值6.8)1.8 mL、6 mmol· L-1的抗坏血酸(ascorbic acid, AsA)0.1 mL,60 mmol· L-1的H2O2溶液1 mL和酶提取液0.1 mL,在290 nm波长下测定吸光度值,以1 min内光密度(optical density, OD)值减少0.1为1个酶活性单位(active unit, U)。AsA含量测定参照UEDAetal[16]的方法。
1.3 数据处理
采用SPSS 20.0软件进行数据的显著性分析,采用Origin 8.0软件绘图。用隶属函数法进行3种植物幼苗的耐盐性综合评价。隶属函数值计算公式如下:
f(xi)=(Xi-Xmin)/(Xmax-Xmin)
(1)
反隶属函数值计算公式如下:
f(xi)=1-(Xi-Xmin)/(Xmax-Xmin)
(2)
式中:f(xi)为隶属函数值;Xi为指标测定值;Xmin、Xmax分别为所有参试材料某一指标的最小值和最大值[17]。
2 结果与分析
2.1 盐胁迫对植物幼苗生长的影响
盐胁迫对3种植物幼苗生长的影响如表1所示。盐胁迫显著抑制了凤凰木幼苗根系的生长,盐浓度越大,抑制越严重;N2处理下,凤凰木的根长生长比对照减少了36.4%。N1处理促进了洋金凤和雨树幼苗的根长生长,分别比对照增加了12.1%和23.2%;N2处理下洋金凤幼苗的根长生长与对照相比有增加但都没有显著差异。总体来说,低盐胁迫促进了洋金凤和雨树幼苗根长的生长,高盐胁迫没有明显抑制,凤凰木根长的生长随着盐浓度的增加而被显著抑制。从表1可以看出,N1处理下,凤凰木的苗高显著低于对照23.5%,而洋金凤和雨树的苗高则显著高于对照28.0%和15.3%。N2处理下,凤凰木的苗高与对照比显著降低了24.8%,而洋金凤和雨树的苗高与对照比都有所下降,但差异不显著。低盐胁迫促进了洋金凤和雨树幼苗苗高的生长,高盐胁迫抑制了这两种植物幼苗苗高的生长但并不显著,在不同浓度盐胁迫下凤凰木幼苗苗高的生长都被抑制。N1处理下,凤凰木幼苗的根含水量比对照增加了3.2%,茎叶含水量与对照比没有显著变化;洋金凤幼苗的根和茎叶的含水量与对照比都显著降低。N2处理下,凤凰木的根和茎叶含水量与对照比均无显著差异;洋金凤的根和茎叶含水量比对照分别显著下降了11.90%和3.3%。不同浓度盐胁迫对雨树的根含水量和茎叶的含水量均无显著影响。N1处理下,凤凰木和洋金凤幼苗的根冠比显著增加,分别比对照增加了13.3%和50.0%,而N2处理对这两种植物幼苗的根冠比均无显著影响。不同浓度盐胁迫显著增加了雨树的根冠比,其中N1处理增加最明显,比对照增加了28.6%。在低盐胁迫下,3种植物幼苗为适应盐胁迫根冠比都有所增加,雨树增加量最显著;高盐胁迫下,雨树的根冠比也显著大于对照,而凤凰木和洋金凤的根冠比则没有显著变化。
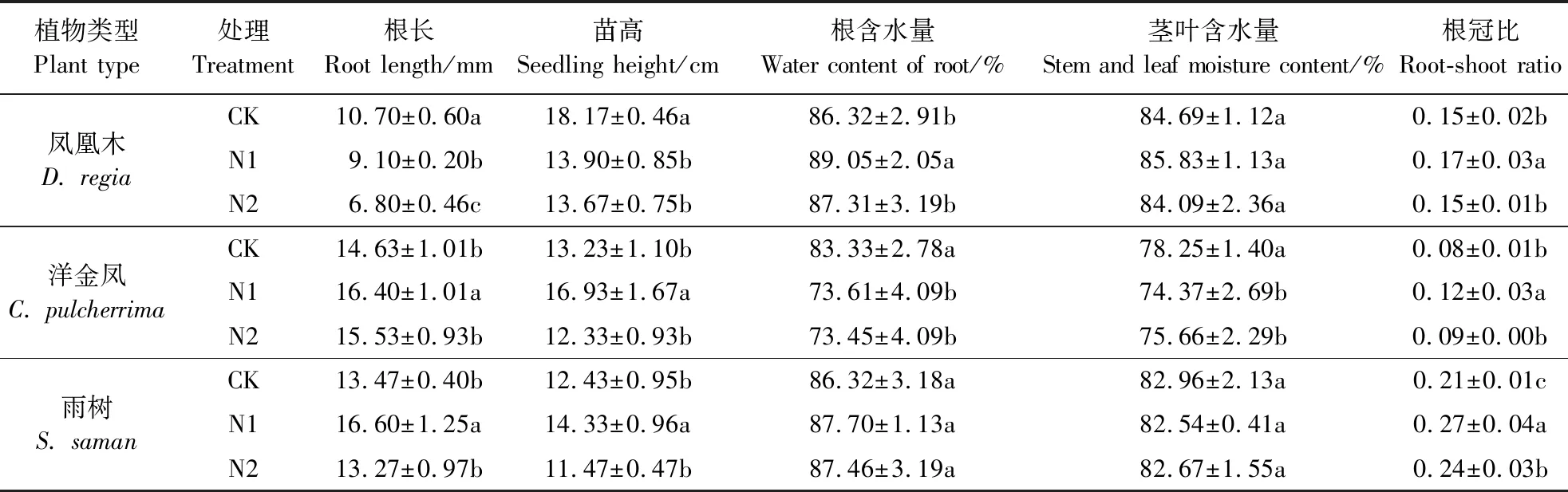
表1 不同盐胁迫对3种热带植物幼苗生长的影响
2.2 盐胁迫对植物幼苗相对电导率和丙二醛含量的影响
盐胁迫对植物幼苗相对电导率的影响如图1(a)所示,3种植物幼苗的相对电导率都随着盐胁迫浓度的增加而增加,且与对照相比差异均达显著水平。在N2处理下,凤凰木和洋金凤幼苗的相对电导率达到最大值,分别比对照增加了22.7%和54.6%。雨树幼苗在不同浓度盐胁迫下的相对电导率相等,且比对照增加了40.7%。在N1和N2处理下,洋金凤和雨树的相对电导率都没有显著差异,表明低盐和高盐胁迫下对这两种植物的膜透性影响差距不大。随着盐浓度的增加,3种植物幼苗的细胞膜透性都受到显著影响,在高盐胁迫下,洋金凤受影响最严重,其次雨树,最后为凤凰木。
盐胁迫对植物幼苗MDA含量的影响如图1(b)所示。凤凰木幼苗的MDA含量在N1处理下尽管有所降低但不显著,而在N2处理下,凤凰木的MAD含量比对照增加了32.0%。洋金凤幼苗的MDA含量在N1和N2之间无显著变化,但是与对照比分别显著增加了30.8%和33.0%;雨树幼苗的MDA含量在N1处理下稍有增加,在N2处理下显著增加,比对照增加了21.4%。低盐胁迫下,凤凰木和雨树的细胞膜基本没受到影响,而在高盐胁迫下凤凰木和洋金凤的细胞膜过氧化程度都高于雨树。

注:不同小写字母表示同一树种在不同浓度盐胁迫处理间差异显著(P<0.05)。Note: different lowercase letters indicate significant differences among different salt concentrations for the same tree species(P<0.05).
2.3 盐胁迫对植物幼苗抗坏血酸含量的影响
盐胁迫对植物幼苗AsA含量的影响如图2所示。不同浓度盐胁迫下,凤凰木幼苗的AsA含量降低,在N1处理下降最明显,比对照降低了38.8%;洋金凤和雨树幼苗的AsA含量与对照相比均显著升高,在N1处理下分别比对照提高了42.8%和87.5%,雨树幼苗的AsA含量增幅最大。表明在不同盐胁迫下与对照比,凤凰木的AsA含量是降低的,而洋金凤和雨树均升高。
2.4 盐胁迫对植物幼苗抗氧化酶活性的影响
盐胁迫对3种植物幼苗酶活性的影响如图3所示。与对照相比,在N1处理下凤凰木幼苗的SOD、POD活性有所下降,CAT和APX活性没有显著变化;洋金凤幼苗的SOD活性有所增加,POD、CAT、APX活性无显著变化;雨树幼苗的SOD活性显著降低,POD、CAT、APX活性都显著增加。与对照相比,在N2处理下,凤凰木幼苗的SOD、CAT、APX活性无显著变化;洋金凤幼苗的SOD活性显著下降,CAT活性显著增加,POD和APX活性无显著变化;雨树幼苗的SOD活性显著下降,POD、CAT、APX活性也都显著增加。3种植物的酶活性对盐胁迫的敏感程度不一,因此,单一的酶活性无法判断它们的耐盐性。

注:不同小写字母表示同一树种在不同浓度盐胁迫处理间差异显著(P<0.05)。Note: different lowercase letters indicate significant differences among different salt concentrations for the same tree species(P<0.05).
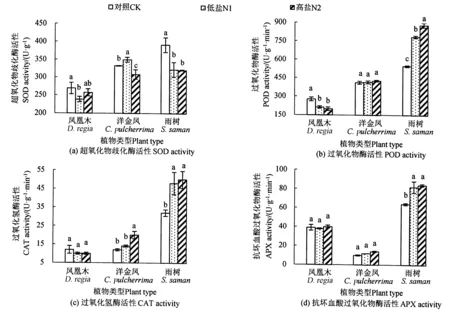
注:不同小写字母表示同一树种在不同浓度盐胁迫处理间差异显著(P<0.05)。Note: different lowercase letters indicate significant differences among different salt concentrations for the same tree species(P<0.05).
2.5 3种热带植物幼苗耐盐性的综合评价
耐盐性强的植株根长、苗高、根含水量、茎叶含水量、根/冠比、相对电导率、SOD、POD、CAT、APX和AsA活性受盐分影响相对较小,变幅小,MDA的增幅小,反之受影响较大。采用隶属函数法将上述12种指标进行综合评价,分别计算隶属函数值,比较平均隶属函数值,值越大耐盐性越强。由表2可以看出,耐盐性从强到弱依次排序为:雨树>洋金凤>凤凰木。

表2 耐盐性综合评价相关指标的隶属函数值
3 讨论与结论
植物在逆境胁迫下的生理生化变化以及对逆境适应能力是近年来研究的热点[18],本研究以3种热带植物的幼苗为研究对象,分析逆境下植物的生长和生理响应,用隶属函数法对3种热带植物的耐盐性进行评价。盐胁迫下,幼苗的生长情况更能体现植物对盐的耐受程度,主要通过苗期根长、苗高和生物量等指标来体现[19-21]。与对照相比,不同浓度盐胁迫处理下,凤凰木幼苗的根长和苗高均减少,而洋金凤和雨树幼苗则在低盐胁迫下升高。与对照相比,凤凰木幼苗根含水量在低盐胁迫下减少,洋金凤幼苗的根和茎叶含水量在不同浓度盐胁迫下均减少,雨树则无显著变化。随着盐胁迫浓度的增加,3种植物幼苗的根冠比均表现出先增后减的趋势。然而,从单个生长指标无法清楚的看出哪一种植物耐盐性比较好,需要进一步分析与总结。
植物组织电解质渗漏量的高低代表环境胁迫细胞膜损坏的程度,是评价植物抗逆性的有效指标,MDA是膜脂过氧化作用的最终产物,其含量高低可以表征膜脂的过氧化程度[22]。研究表明,相对电导率的大小与盐浓度成正比[23]。3种植物幼苗的相对电导率随着盐胁迫浓度的增加而增加,并在高盐胁迫下达到最高,说明盐胁迫增加了这些植物的膜透性。随盐胁迫浓度的增加,MDA的含量一般都会升高[24],然而,凤凰木幼苗在低盐胁迫下降低,可能是因为低盐能促进其生长,在高盐胁迫下3种植物幼苗的MDA含量都显著大于对照,从增加量来看凤凰木和洋金凤大于雨树,说明雨树耐盐性较强。
植物在遭受盐胁迫能够产生大量的活性氧,造成膜脂的过氧化,而此时植物体内的SOD、POD、CAT、APX等酶系统和AsA非酶抗氧化系统开始发挥作用清除过多的活性氧,以维持植物体内的动态平衡[25]。当活性氧积累超过抗氧化系统的清除能力时,就会造成抗氧化酶活性的降低[26]。已有研究表明[27-28],随盐胁迫浓度的增加,酶系统活性表现出先升后降的趋势。在不同浓度盐胁迫下,3种植物幼苗在活性氧代谢方面表现出了一定的差异:高盐胁迫下凤凰木幼苗的抗氧化酶活性下降,说明高盐对其产生了氧化胁迫,膜脂过氧化产物(MDA)和质膜相对透性(相对电导率)的增加,从而导致活性氧清除系统和活性氧积累的平衡打破,产生盐胁迫症状;洋金凤和雨树幼苗在高盐胁迫下,尽管SOD活性降低,但POD等其他清除过氧化氢的酶仍保持较高的活性,清除多余的H2O2,降低膜脂过氧化程度,产生耐盐性。从盐胁迫对3种植物幼苗抗氧化系统的影响来看,其耐盐性强弱为:雨树>洋金凤>凤凰木。
综上所述,盐胁迫对3种植物的生长和生理代谢具有显著的影响。植物的耐盐性受生理生化特征和遗传表现的综合作用,因此,单靠某一个或几个指标很难对其耐盐性强弱做出准确的评价,本研究采用隶属函数法对3种植物的12项生长和生理指标进行耐盐性综合评价,得出3种植物的耐盐性强弱为:雨树>洋金凤>凤凰木。
