深海嗜冷希瓦氏菌Shewanella psychrophila WP2的基因组学分析
2020-09-16侯佳林王寅炤蹇华哗
聂 唱,侯佳林,王寅炤,蹇华哗*
(1.上海交通大学生命科学技术学院,上海 200240; 2.上海交通大学微生物代谢国家重点实验室,上海 200240)
希瓦氏菌属(Shewanella)属于γ-变形菌纲,广泛分布于全球海洋和淡水环境中,并且是深海中丰度最高的变形菌类群之一[1]。Shewanella菌具有多样的呼吸能力,厌氧呼吸电子受体包含十几种甚至几十种底物。它不仅能够利用铁、锰等常见金属,还能够将很多不常见的金属或者非金属物质作为电子受体,如碲、硒、碘、钒、钚、铬等等,甚至还有一些菌株能够还原芳香化合物[2],这些特性使得Shewanella菌在环境生物修复和微生物燃料电池方面有着巨大的应用潜力[3]。同时,Shewanella菌还具有较强的环境适应能力,可以在不同盐度、温度、静水压力的环境条件下生存[4]。对于Shewanella菌基因组的研究将有助于了解其适应机制,进一步阐释该属细菌在自然环境中的生态意义。
深海嗜冷希瓦氏菌ShewanellapsychrophilaWP2(以下简称为WP2)和ShewanellapiezotoleransWP3(以下简称为WP3)分离自西太平洋水深1 914 m深海沉积物。WP2是革兰氏阴性兼性厌氧菌,最适生长温度为10~15 ℃,最适生长压力为20 MPa,具有嗜冷嗜压特性[5]。WP2可以利用葡萄糖、蔗糖、N-乙酰氨基葡萄糖和多种氨基酸等种类丰富的碳源,厌氧呼吸可以利用硝酸盐、氧化三甲胺(TMAO)和二甲基亚砜(DMSO)作为电子受体[6]。虽然WP2和WP3已经完成全基因组测序[6],但是WP2的进化地位、基因组特征和代谢潜能仍未有深入研究。WP3为兼性厌氧细菌,最适生长温度为15~20 ℃,最适压强为20 MPa。与WP2相似,WP3也可以利用多种碳源,厌氧呼吸时可以利用硝酸盐、延胡索酸、TMAO、DMSO和三价铁作为电子受体[5,7]。通过基因组分析发现WP3具有两套鞭毛系统和DMSO呼吸系统、丰富的细胞色素c相关基因簇,大量与结构RNA修饰功能、二十碳五烯酸(EPA)生物合成和转运相关的功能基因,这些都表明它在寡营养的深海环境中具有较强的趋化移动、获取营养、产生能量以及合成大分子的代谢潜能[8-9]。此外,据报道WP3的ABC转运子(LIV-I)在低温和高压的环境下会上调表达以吸收更多的支链氨基酸,使膜脂中不饱和脂肪酸的含量增加[10]。WP3中的丝状噬菌体SW1在低温下会被显著诱导[11]。这些很可能都有助于WP3适应深海极端环境条件。
本研究基于已有的基因组测序结果,对S.psychrophilaWP2的系统发育、代谢潜能以及功能基因进行了深入的分析,并与S.piezotoleransWP3进行比较,进一步探究WP2的基因组特征在深海环境中的生态意义。
1 材料与方法
1.1 菌株来源及电子受体检测
S.psychrophilaWP2分离自西太平洋水深1 914 m的深海沉积物中,菌株由本实验室保藏(CGMCC 1.6159)。本研究中,培养基为LMO-812海水培养基,外加碳源为5 mmol/L N-乙酰氨基葡萄糖。厌氧培养时电子受体为5 mmol/L硝酸钠和20 mmol/L二甲基亚砜(DMSO)。细胞生长情况用分光光度计测量OD600可得。
1.2 数据来源
本研究中的基因组序列可在NCBI (National Center for Biotechnology Information)基因组数据库中获得(http://www.ncbi.nlm.nih.gov/genome),包括S.psychrophilaWP2 (NZ_CP014782)和S.piezotoleransWP3 (NC_011566)。
1.3 功能基因的预测和注释
使用Prodigal (V2.6.3)[12]对下载的基因组核酸序列进行ORF (Open Reading Frame)预测以及蛋白编码序列的翻译,将翻译后的蛋白编码序列使用Emapper 4.5在eggNOG 数据库[13]中进行功能注释,阈值为e-value小于1×e-5。 使用antiSMASH数据库[14]进行次级代谢产物基因簇注释。
1.4 系统发育树的构建
为了确定WP2的发育进化地位,选取了NCBI物种数据库中已发表测序结果的74个Shewanella菌株,并选取了Moritellaviscosa、PhotobacteriumprofundumSS9、PseudoalteromonashaloplanktisATCC 14393等4个γ-变形菌纲细菌作为外群,基于古菌和细菌共有的37个保守标记基因用极大似然法构建系统发育树[15]。首先,合并目标基因组和参考基因组中对应的蛋白序列, 使用MAFFT[16]进行序列比对,使用默认参数;随后,根据序列所在基因组,将比对好的每一组序列按照相同顺序重新首尾连接, 用空位补齐缺失的蛋白;接着,将连接得到的序列使用TrimAl[17]去空位, 参数为-automated1,手动删除比对引入的大量空位。使用IQtree (V1.16)[18]构建系统发育树,参数为LG+C60+F+G-alrt 1 000-bb 1 000,通过1 000次重复计算得到自展值。
1.5 基因组岛的预测
使用IslandViewer 4[19]基于Integrated、IslandPath-DIMOB和SIGI-HMM等方法对基因组进行基因组岛预测,使用默认参数。
2 结果与讨论
2.1 WP2在希瓦氏菌属中的系统发育地位
为了探究WP2的进化地位,我们使用了Shewanella属的74个菌株的基因组和4个相近的γ-变形菌纲细菌菌株,基于全基因组序列建立系统发育进化树(图1)。结果显示,Shewanella属在分类学上被分为两个分支,一支(Group 1)具有能够适应高静水压力和低温的特征,另一支(Group 2)则是常温且对压力敏感,这与之前的研究结果是一致的[1]。WP2属于嗜冷菌株,并属于Group 1,与来自同一生境的嗜冷菌株S.piezotoleransWP3却是分别存在于两个单独的进化分支中。与WP2亲缘关系最近的是S.violaceaDSS12、Shewanellasp.NORP143和S.benthicaKT99。S.violaceaDSS12是从菲律宾琉球海沟5 110 m深处的沉积物中分离得到的[20]。Shewanellasp.NORP143是大西洋中脊一侧北池(The North Pond)地壳流体样品的宏基因库中的一个拼接基因组[21]。S.benthicaKT99分离自从太平洋Tonga-Kermadec 海沟9 000 m处采集的样本[22]。而与WP3亲缘关系最近的是Shewanellasp. GutCb、Shewanellasp.GutDb-MelDb、Shewanellasp.Bg11-22、Shewanellasp.Choline-02u-19,它们都是北冰洋靠近美国阿拉斯加州近海海上浮冰样品的宏基因组中的拼接基因组(项目序号:PRJNA420923)。这些来自于宏基因组重建得到的菌株暂未分离得到可培养微生物,目前尚未使用传统方法进行鉴定和命名。
此外,通过对这74个Shewanella菌株的基因组进行统计,我们发现WP2的基因组大小为6.4 Mb,是目前已经完成测序的Shewanella菌株中最大的,而其他Shewanella菌株的基因组大小均小于5.9 Mb。
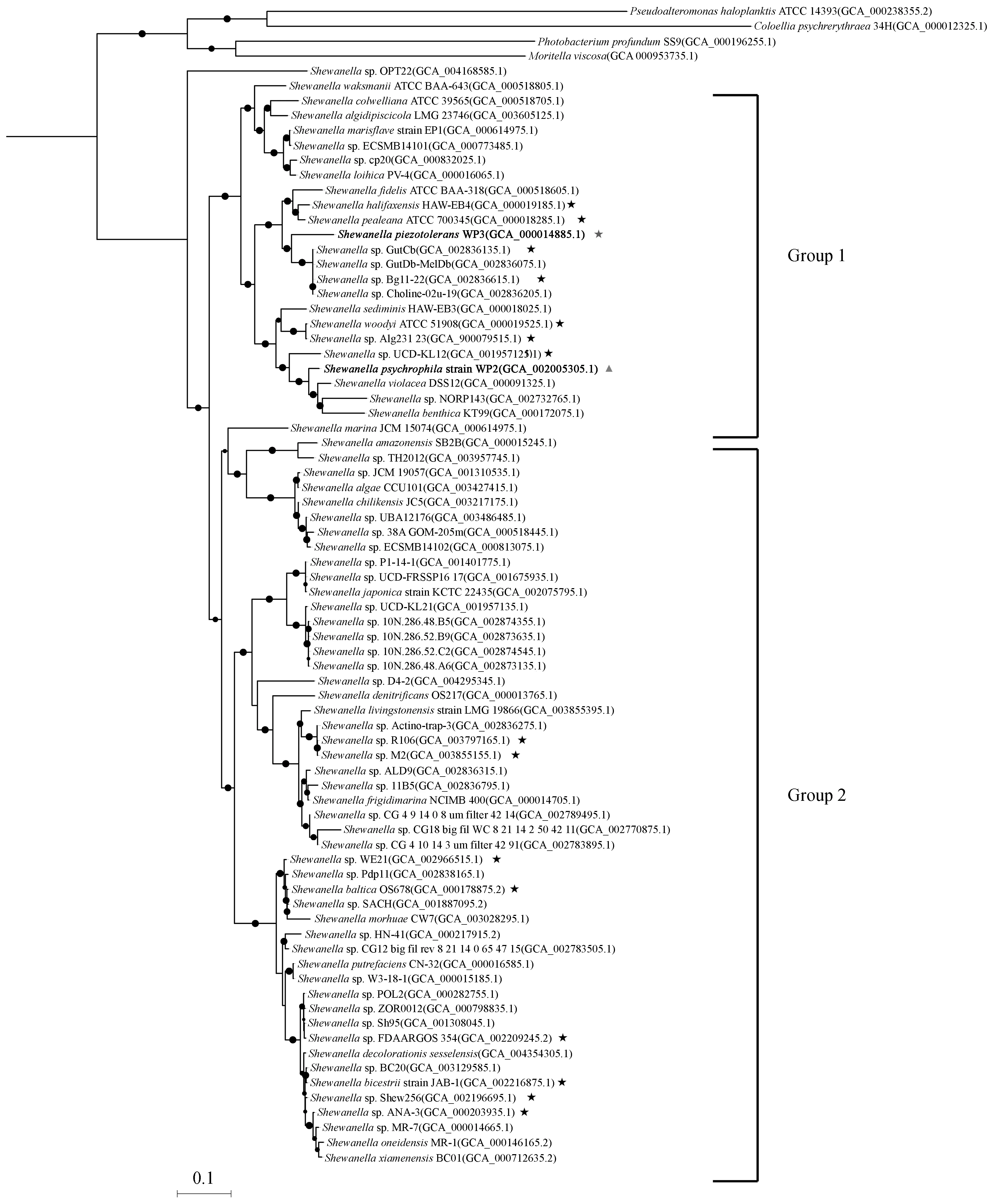
图1 基于37个单拷贝保守蛋白构建的Shewanella基因组系统发育树Fig.1 Phylogenetic tree of Shewanella genomes based on 37 single copy conversed genes“•”表示自展值大于75,其直径与自展值的大小成正比。“★”星表示该菌株的基因组大于5.0 Mb,“▲”形表示该菌株的基因组大于6.0 Mb。
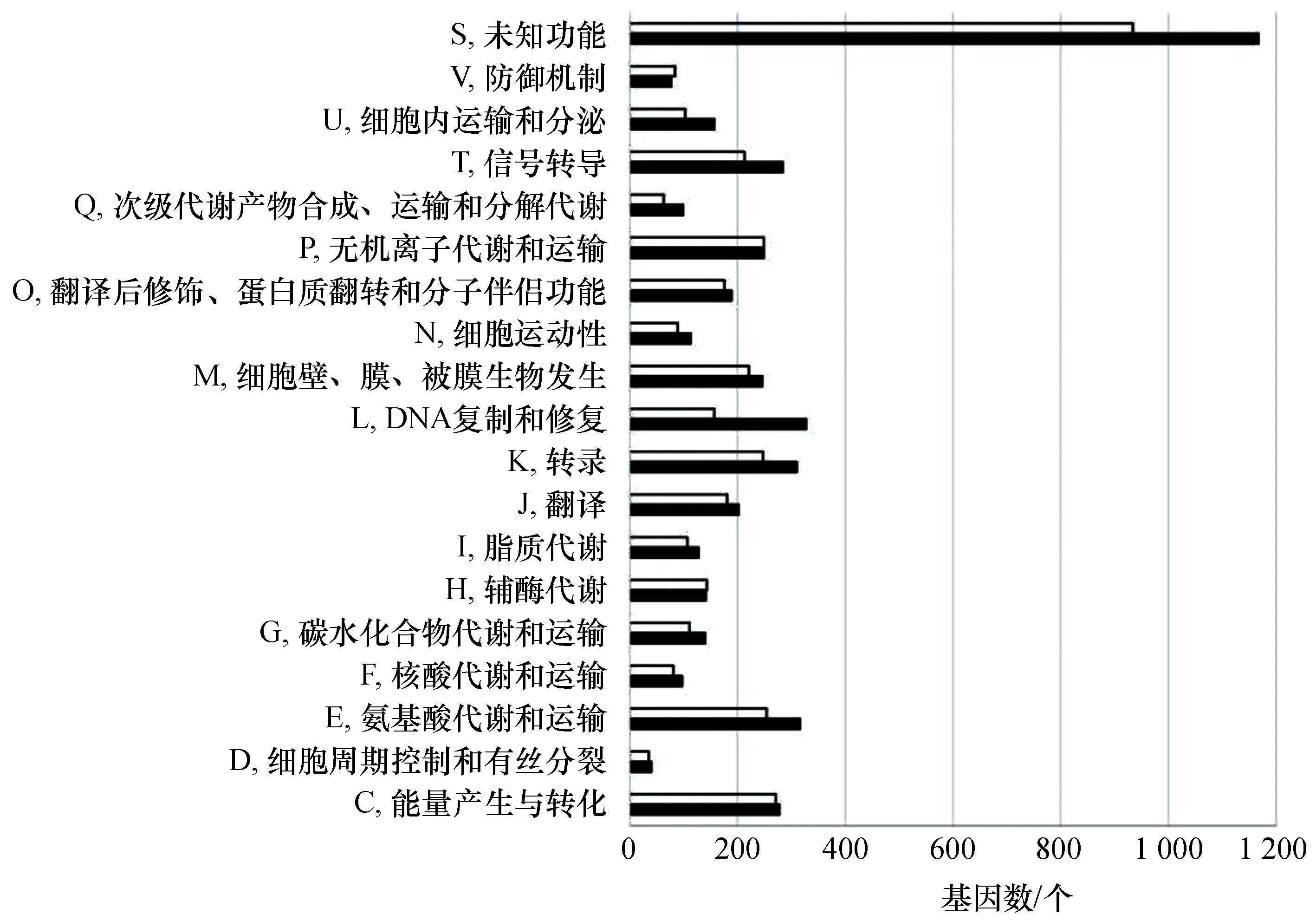
图2 S. psychrophila WP2 和 S. piezotolerans WP3的基因功能分类和比较Fig.2 Functional classification and comparison of S. psychrophila WP2 and S. piezotolerans WP3 genes“”代表S. piezotolerans WP3的基因数目,“”代表S. psychrophila WP2的基因数目。
2.2 基因功能分类及比较
将WP2基因组的功能分类COG(直系同源群集)[23]与同样分离自深海环境、嗜冷嗜压WP3菌株的基因组的功能分类进行比较(图2)。结果显示,在氨基酸代谢和运输(E)、DNA复制和修复(L)、次级代谢产物合成、运输和分解代谢(Q)、信号转导(T)、细胞内运输和分泌(U)方面,WP2参与的基因数明显多于WP3;在核苷酸代谢和运输(F)、碳水化合物代谢和运输(G)、脂类代谢(I)、翻译(J)、转录(K)、细胞壁、膜、被膜生物发生(M)、细胞运动性(N)和翻译后修饰、蛋白质翻转、分子伴侣功能(O)方面参与的基因数略高于WP3。WP3仅有参与防御机制(V)方面的基因数略高于WP2。WP2中未知功能蛋白有1 167个,占基因总数的20.07%。
另外,WP2的基因组中共有327个与复制和修复(L)相关的功能基因。相对于WP3,WP2具有17个特有的与DNA复制和修复功能相关的基因,其中有7个基因序列编码转座子酶(K07483、K07484、K07482、K07485、K07493、K07498、K18320)。除此之外,编码有效激活转座子酶并提高整合效率的Mu B蛋白[24]的基因、通过Fanconi anemia途径参与DNA修复的FANCM基因[25]、以及参与修复DNA双链断裂的非同源性DNA连接酶ligD基因[26]等也是WP2基因组相对于WP3所特有的。
基于antiSMASH在线数据库注释结果显示,WP2中有10个合成次级代谢产物的基因簇,其产物包括I型聚酮合酶(PKS)、高丝氨酸内酯、细菌素、非核糖体多肽酶(NRPS)、蛋白酶抑制剂、芳基多烯、多不饱和脂肪酸等。WP3中只有5个合成次级代谢产物的基因簇,并且不具有合成I型聚酮合酶(PKS)、高丝氨酸内酯、非核糖体多肽酶(NRPS)和多不饱和脂肪酸的功能。
2.3 代谢潜能分析
在WP2基因组中,我们发现了与糖酵解通路相关的所有基因。WP2通过糖酵解产生ATP、丙酮酸和NADH。丙酮酸可以经pdc编码的丙酮酸脱羧酶和adh编码的乙醇脱氢酶转化为乙醇,或经ldh编码的乳酸脱氢酶转化为乳酸。此外,在WP2的基因组中也找到了编码完整柠檬酸循环和戊糖磷酸途径的系列基因,还有一系列涉及蔗糖、果糖、乳糖、半乳糖、核糖和氨基酸糖等代谢途径的基因(图3)。WP3与WP2的中心碳代谢通路几乎一致,然而WP3比WP2缺少异柠檬酸裂合酶(AceA),缺少与戊糖磷酸途径相关的核糖激酶(RbsK)。
在硫代谢方面,WP2和WP3中都含有一定拷贝数的硫酸酯酶(AslA)基因和完整的同化硫还原途径的功能基因(cysND、cysC、cysH、cysJI),没有自养硫氧化系统。我们通过BLAST序列比对发现WP2基因组中含有编码DMSO还原酶的dms基因。
氮代谢方面,WP2和WP3中都含有异化硝酸盐还原途径相关的功能基因,如:napAB(编码周质硝酸盐还原酶)和nirBD(编码亚硝酸盐还原酶),缺少nos(编码氧化亚氮还原酶)。WP2不含有nor(编码一氧化氮还原酶),但是WP3中含有norBC。
根据氮代谢、硫代谢基因注释结果,我们分别使用NaNO3和DMSO作为电子受体,使用LMO-812海水培养基为培养体系,N-乙酰氨基葡萄糖作为碳源,在15 ℃常压条件下,对WP2进行厌氧培养(图4),同时在同样条件下进行有氧培养作为阳性对照,每个条件分别设置3个平行。经过数次的重复实验发现,WP2在15 ℃常压条件下不能利用NaNO3和DMSO作为电子受体正常生长。
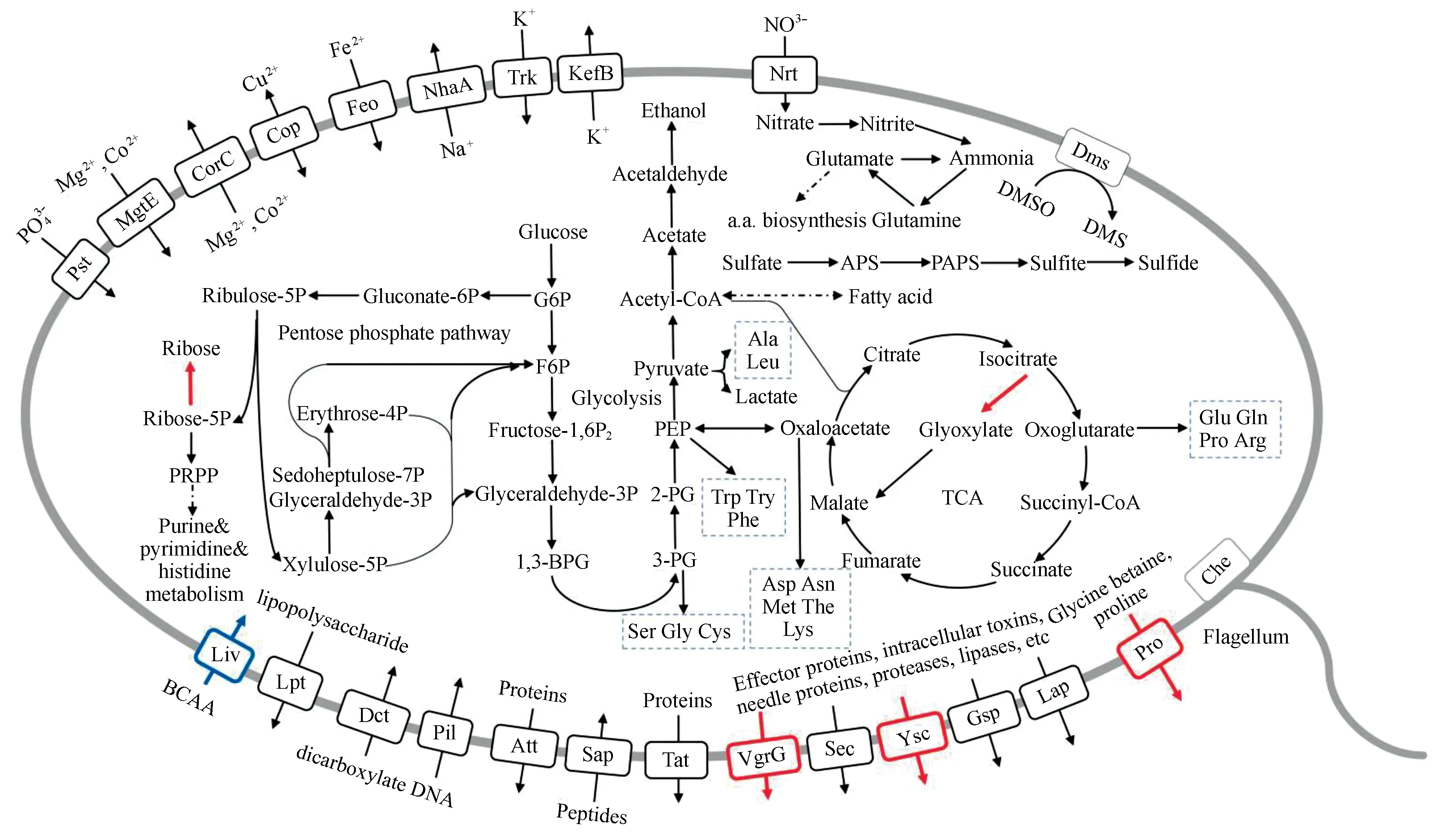
图3 S. psychrophila WP2和S. piezotolerans WP3的关键代谢通路Fig.3 Key metabolic pathways of S. psychrophila WP2 and S. piezotolerans WP3红色方框及箭头表示S. psychrophila WP2特有的代谢途径,而蓝色方框表示S. piezotolerans WP3特有的蛋白。
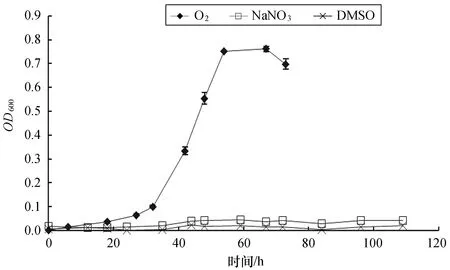
图4 S. psychrophila WP2不同电子受体条件下的生长曲线Fig.4 Growth curve of S. psychrophila WP2 with different electron acceptors
WP2和WP3基因组中都包含丰富的金属和无机离子的转运蛋白,如:PstABCS (磷酸盐转运子)、MgtE和CorC (镁离子、钴离子转运子)、Cop (铜离子转运子)、Feo (亚铁离子转运子)、NhaA (钠离子转运子)、Trk和KefB (钾离子转运子)、Nrt (硝酸盐转运子)的编码基因。同时,还具有DctPQM (二羧酸转运子)、Pil (DNA转运子)、Att和Sap (ABC转运子协同转运多肽和蛋白)、LptFGB (脂多糖转运子)的编码基因。然而,在细菌分泌系统方面,WP3仅具有Gsp (普通分泌系统)、Sec (Sec-SRP分泌系统)和Tat (Tat 分泌系统),WP2比WP3具有更多的转运蛋白,如:VgrG (VI型分泌系统)和Ysc (III型分泌系统)。除此之外,WP2还拥有WP3所不具有的Pro (甘氨酸甜菜碱和脯氨酸转运子)。但是,WP2却缺少LivKGF (支链氨基酸转运子)。
研究报道,WP3中具有两套鞭毛基因[8]。同样,基因组数据显示WP2也具有两套鞭毛基因,包含完整的与鞭毛组装、运动和调控相关的基因,如flg,mot,fli等,还有趋化性相关的功能基因che等。
2.4 基因组岛分析
WP2的基因组比WP3的基因组大了约1 Mb,同时也是其他Shewanella菌中最大的,且WP2中包含有1 872个特异于WP3的基因(图5),推测这其中部分基因可能是来自水平转移来的基因组岛。因此,使用细菌基因组岛鉴定工具IslandViewer 4进行分析,发现在WP2中共有17个基因组岛,其GC含量均低于基因组平均GC含量(44.3%),且每个基因组岛上都含有转座酶和/或整合酶。它们的大小在4.3~35.3 kb之间,分别被命名为WP2GI1~WP2GI17(表1)。

图5 S. psychrophila WP2和S. piezotolerans WP3的基因比对Venn图Fig.5 Venn plot of comparision between S. psychrophila WP2 and S. piezotolerans WP3 genes右边椭圆代表S. piezotolerans WP3的基因数目,左边椭圆代表S. psychrophila WP2的基因数目,灰色阴影部分表示经序列比对WP2和WP3共有的功能基因。
这17个基因组岛上携带了大量的附加功能基因,编码的蛋白主要与核心代谢、金属离子代谢、运动趋化以及群体感应等功能相关。与氨基糖代谢相关的有:糖转移酶(Glycosyltransferase)、转氨酶(Aminotransferase)、转乙酰酶(Acetyltransferase)和dTDP-葡萄糖4,6-脱水酶(RfbB)等。与嘌呤代谢相关的有:鸟嘌呤脱氨酶(GuaD)、鸟嘌呤渗透酶(PbuG)、尿囊素酶(Alc)、脲基咪唑啉脱羧酶(HpxQ)、脲基乙醇酸裂解酶(AllA)和羟基异尿酸水解酶等(HiuH)。与其他有机小分子代谢相关的有:肽酶(Peptidase)、乙醇脱氢酶(Alcohol Dehydrogenase)、苹果酸脱氢酶(MaeB)、丙氨酸消旋酶(Alanine Racemase)、丝氨酸脱水酶(TdcB)、丙氨酸乙醛酸转氨酶(AGXT)等等。与金属代谢相关的有:二价铁离子转运蛋白(FeoB)、铁转运蛋白(FeoA)、铜耐受蛋白(CopC)和铜氧化酶(CopB)等。与运动趋化性相关的有:纤毛组装蛋白(Pilus Assembly Protein)、鞭毛蛋白修饰蛋白A(Flagellin Modification Protein A)、趋化性蛋白(CheX)和鞭毛蛋白(MotX)等。与群体感应功能相关的有高丝氨酸/高丝氨酸内酯外排蛋白(RhtB)。
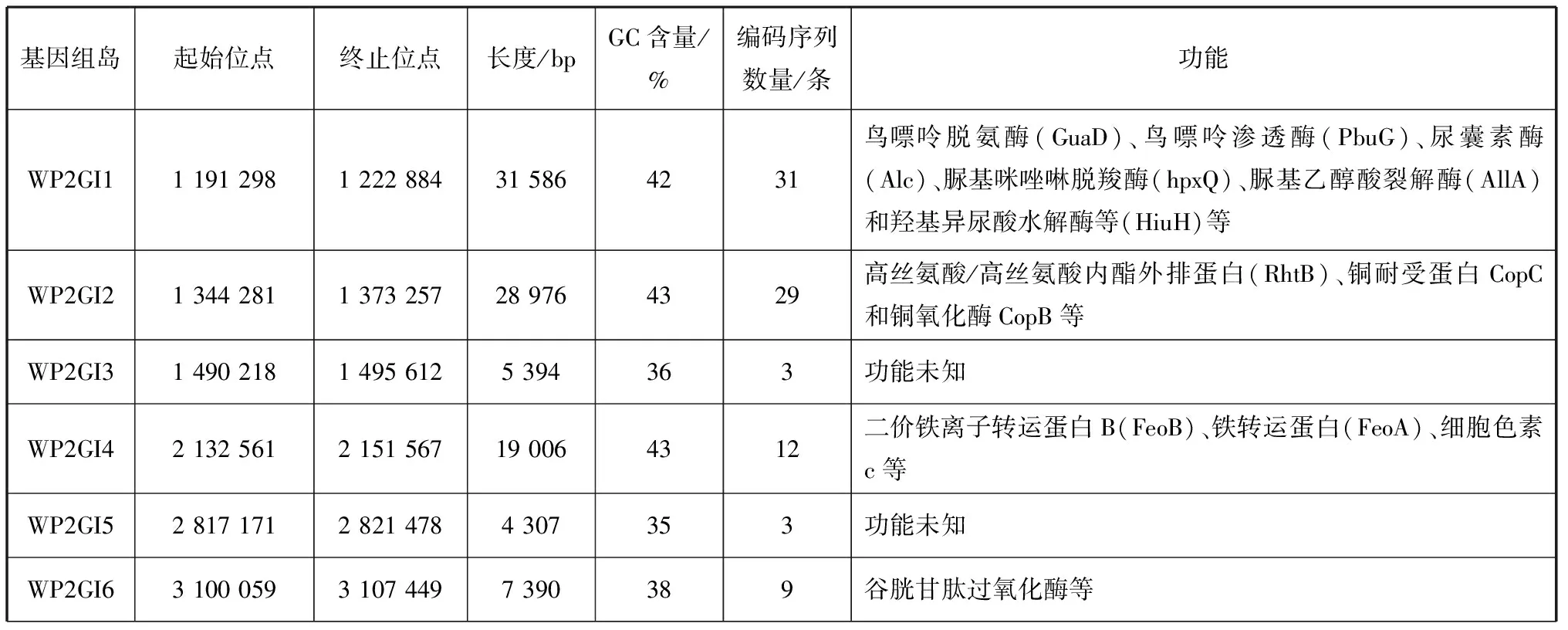
表1 S. psychrophila WP2中基因组岛的基本信息
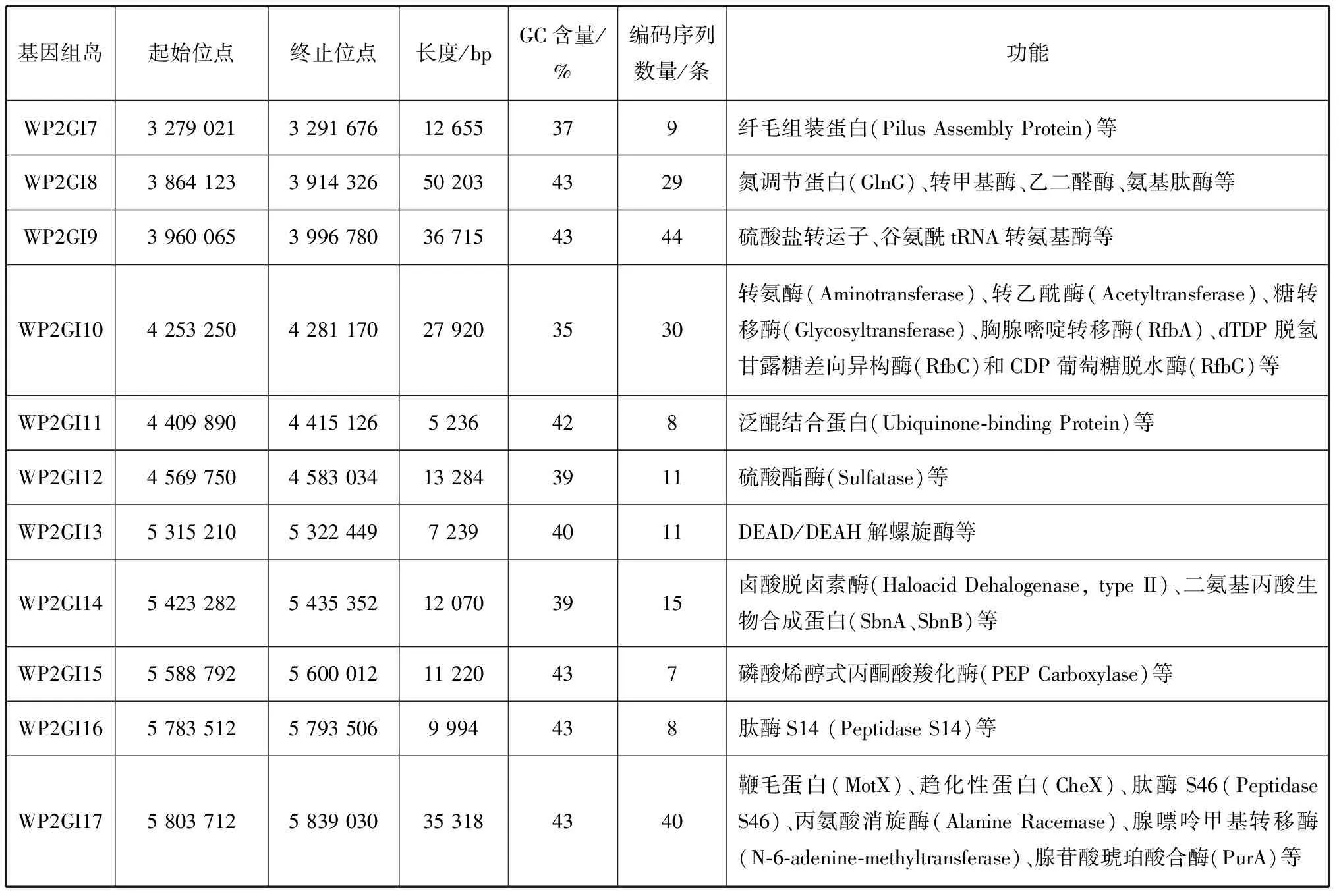
续表1
2.5 讨论
Shewanella菌的强大呼吸能力和对于不同盐度、温度、静水压等因素的适应性使得它可以在不同环境中生存[4],对于它多样的生理表现的研究一直在持续深入中。基因组学对理解Shewanella菌的生理表现和生态意义上发挥着至关重要的作用。在本研究中,我们对从深海沉积物中分离得到的一株嗜冷希瓦氏菌S.psychrophilaWP2的基因组进行了系统发育分析、功能基因分析和代谢途径重建,并与同属菌株WP3基因组进行了比较分析,揭示了WP2在Shewanella菌中的进化发育地位和代谢潜能,并发现了其中存在携带大量功能基因的可移动基因组岛,对其基因功能分析和环境生态位研究提供了重要依据。
系统发育分析结果显示,Shewanella菌可被划分为两个分支,Group 1是嗜冷耐高压菌株,Group 2是常温压力敏感菌株。有研究报道,Group 1 中的Shewanella菌大都分离自深海环境[1],如:深海海水、沉积物、海沟等,说明深海来源的Shewanella类群具有独特的系统发育地位,同时表明深海环境在其物种的演化历史中很可能发挥着关键作用。WP2和WP3均属于Group 1,与其生存环境和嗜冷嗜压的生理特征一致。
在WP2基因组中,我们发现了完整的异化硝酸盐还原途径的功能基因,nrt(编码硝酸盐/亚硝酸亚转运子)、napAB(编码周质硝酸盐还原酶)和nirBD(编码亚硝酸盐还原酶)。WP2也具有编码DMSO还原酶的dms基因,这都证实了WP2可以利用硝酸盐和DMSO作为电子受体[6]。然而,通过实验我们发现在最适温度15 ℃、常压的条件下,菌株WP2不能生长,说明这些基因可能只在一定的温度和压力条件下得到表达,暗示着WP2的电子受体利用能力受到环境因素的调控,这还需要进一步研究证实。
WP2和WP3都具有嗜冷嗜压特性,但在极端环境适应性上存在着一些差异。对于LIV转运蛋白,目前仅在具有冷适应特性的Shewanella菌中被鉴定。在低温下S.piezotoleransWP3的LIV转运子被诱导表达,大量支链氨基酸(BCAA)被转运进入细胞,支链脂肪酸(BCFA)合成量增加,有助于其膜结构抵御极端环境,这一机制被认为是Shewanella菌适应低温的重要策略[10]。但是具有嗜冷特性的S.psychrophilaWP2菌株中并不含有LIV转运子,这暗示着WP2或许具有新的、不同于BCFA和LIV相关的冷适应机制,其膜结构如何抵御低温高压环境所带来的损伤还存在着一些尚未发现的适应机制等待着更加深入的研究去发现。
我们在WP2中共发现了17个基因组岛,携带了大量的辅助功能基因,主要与核心代谢、运动趋化性和金属离子代谢等功能相关。在WP2GI1上,我们发现了一系列与嘌呤代谢相关的功能基因。经序列比对,我们发现这些基因编码的蛋白与Colwellia属中对应的功能蛋白有着较高的相似性(76.51%~91.62%),暗示着该基因组岛很有可能来自Colwellia属。鸟嘌呤脱氨酶、尿囊素酶等均为嘌呤转化为氨、次黄嘌呤或黄嘌呤的关键酶。嘌呤中富含氮元素并广泛分布在生物圈。当环境中氨的含量受到限制时,许多微生物都会利用腺嘌呤或者鸟嘌呤[27]。因此,我们推测该基因组岛可能有助于WP2在寡营养环境中最大化地利用氮源。在WP2GI2中编码的高丝氨酸/高丝氨酸内酯外排蛋白与弧菌属(Vibrio)相应功能的蛋白序列有着很高的相似性。在变形菌中,高丝氨酸和高丝氨酸内酯是细胞间信号传导的重要小分子化合物[28]。这说明通过获得基因组岛,WP2在调节基因表达与协调细菌种群密度方面的能力得到了增强。WP2GI7中编码着一个菌毛组装蛋白,通过序列比对发现它与Vibrio属相应的蛋白序列相似。革兰氏阴性菌中,菌毛可以使细菌附着在其他表面或彼此相互作用,还可以通过提供分泌导管使细菌与外部环境产生连接[29]。这有助于WP2在复杂环境形成生物膜,以及分泌次级代谢产物。另外,在WP2GI10中,我们发现了一系列与氨基糖代谢相关的酶:糖转移酶、转氨酶、转乙酰酶和dTDP-葡萄糖4,6-脱水酶等,他们均与Vibrio属中相应功能的蛋白序列相似。其中,转氨酶和dTDP-葡萄糖4,6-脱水酶等均与链霉素的合成相关。研究显示,氨基糖是许多生物大分子和微生物次生代谢产物(包括抗生素)的重要成分[30]。该基因组岛可进一步增强合成次级代谢产物的能力,这或许有助于WP2在复杂的极端环境中增强防御能力。同时,WP2GI10中还编码了鞭毛蛋白修饰蛋白A,也与Vibrio属的蛋白序列相似。鞭毛修饰在革兰氏阴性菌中十分普遍,该基因与鞭毛合成和运动性等等表型相关[31],增强了WP2在极端环境中对于营养富集区域的趋向性和对潜在危险的躲避能力。可见,WP2从Colwellia和Vibrio等属通过水平转移的基因组岛获得了嘌呤代谢、细胞群感、运动和抗生素合成的相关基因。这些辅助功能基因使得WP2具有更强的氮源利用能力,更突出的运动和趋化能力,以及应对复杂环境的群体感应能力和抗生素合成功能。
3 结论
Shewanella菌广泛分布在自然环境中,可以利用多种电子受体和碳源,并且其生存环境不受盐度、温度、静水压力等环境因素的限制。微生物基因组研究可以从组学分析角度解释其特殊的生理特性,并进一步揭示微生物适应环境的内在原因。我们基于已有的基因测序结果对深海沉积物中分离得到的一株嗜冷嗜压希瓦氏菌S.psychrophilaWP2的系统进化发育地位、基因功能和代谢潜力进行了深入的研究。结果显示,WP2的基因组为目前已测序的Shewanella属中最大的。系统发育进化树显示,WP2属于聚类了嗜冷嗜压Shewanella菌株的Group 1分支。WP2基因组中与DNA修复、次级代谢产物合成和转运分泌相关的基因数明显多于WP3。与同样嗜冷嗜压的WP3相比,WP2缺失支链脂肪酸转运子LIV,说明WP2在支链脂肪酸合成等方面与WP3的深海适应机制有所不同。通过基因组岛水平转移,WP2获得了大量的辅助功能基因,增强了氮源利用能力、运动和趋化能力、应对复杂环境的群体感应能力和抗生素合成的功能,从而更加适应生活在寡营养、环境复杂的生态位。本研究针对WP2基因组进行了详细的系统进化发育分析和代谢分析,不仅对其代谢潜力进行了深入的探索和研究,也为将来关于Shewanella菌和微生物的环境适应机制的研究提供了更多数据参考和理论基础。
