柱前衍生-毛细管电泳法分离测定苦荞壳中的8种黄酮类化合物
2020-09-15
(六盘水师范学院 化学与材料工程学院,六盘水 553004)
苦荞学名鞑靼荞麦,别名荞叶七、野兰荞、万年荞,属蓼科,被誉为“五谷之王”[1-5]。苦荞内含人体所需的多种微量元素[6-7]、氨基酸[8-9]、黄酮类化合物[10-11]等营养成分,具有降低血脂和胆固醇的作用,其中的芦丁[13]等黄酮类化合物具有抑菌、抗病毒、抗氧化和增强免疫力等作用。苦荞壳是苦荞生产过程中的副产物,常作为废弃物丢弃,不仅造成了资源的浪费还会污染环境。苦荞壳由于富含黄酮类化合物,对其中的黄酮类化合物进行的定性和定量分析工作,对于开发苦荞壳的经济价值具有重要的指导意义。
目前,黄酮类化合物最常用的分析方法是高效液相色谱法[14],此方法存在溶剂消耗量大、分析时间长、色谱柱价格昂贵等缺点。毛细管电泳法作为一种快速高效的新型液相分析技术[15-18],在黄酮类化合物的分离分析方面有较好的应用前景[19-22]。
本工作以双三甲基硅烷基三氟乙酰胺(BSTFA)为柱前衍生剂对黄酮类化合物进行衍生,采用毛细管电泳对黄酮类化合物衍生物进行分离和测定,以期为苦荞壳中黄酮类化合物药物和保健品的开发提供技术参考。
1 试验部分
1.1 仪器与试剂
HP-3D 型毛细管电泳仪,配二极管阵列检测器。
8种黄酮类化合物单标准储备溶液:称取适量8种黄酮类化合物标准品,用乙腈溶解并定容,配制成2.0×10-4mol·L-1单标准储备溶液,其他所用质量浓度均由该溶液用乙腈稀释制得。
衍生剂溶液:2.0×10-4mol·L-1,在安培瓶中加入0.052 mg BSTFA,用乙腈溶解并定容至2.0 mL,密封备用。
儿茶素(Cat)、芦丁(Rut)、山奈酚(Kae)、槲皮素(Mel)、金丝桃苷(Hyp)、异槲皮苷(Hir)、杨梅素(Myi)、槲皮苷(Que)等8 种标准品的纯度均大于98%,衍生剂BSTFA 的纯度为96%;乙腈为光谱纯;所用试剂均为分析纯;试验用水为去离子水。
1.2 仪器工作条件
DB-624毛细管柱(50 cm×75μm,5μm),柱温25 ℃;工作电压18 k V;分析波长为254 nm;运行缓冲溶液为15 mmol·L-1硼酸盐缓冲溶液[p H 9.3,内含15 mmol·L-1β-环状糊精(β-CD)];每次进样前,需分别用0.1 mol·L-1NaOH 溶液、水、运行缓冲溶液冲洗毛细管柱3 min,更换缓冲溶液时,需分别冲洗7 min。
1.3 试验方法
按照文献[23]对样品进行预处理,称取约1 g苦荞壳,加入80%(体积分数)乙醇溶液5 mL,在70 ℃搅拌提取2 h,经0.22μm 滤膜过滤,滤液用80%乙醇溶液定容至25.0 mL,在80 ℃水浴中灭酶30 min,冷却,分取10 mL样品溶液,加入40 mL衍生剂溶液,于80 ℃水浴中反应30 min,按照仪器工作条件测定。
2 结果与讨论
2.1 色谱行为
按照试验方法对8种黄酮类化合物混合标准溶液进行衍生并测定,其电泳谱图见图1。
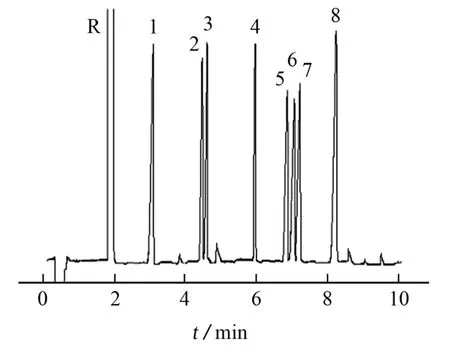
图1 8种黄酮类化合物衍生物的电泳谱图Fig.1 Electropherogram of derivatives of the 8 flavonoid compounds
2.2 分离条件的优化
硼酸盐缓冲溶液是毛细管电泳中常用的缓冲溶液体系,是毛细管电泳分析过程中进行调控分离的重要介质,其浓度会直接影响目标物的分离效率;β-CD 是一种常用于毛细管电泳分离的有机添加剂[24],对提高分离效率有重要作用。试验考察了运行缓冲溶液中硼酸盐的浓度(5,10,15,20,25 mmol·L-1)对8种黄酮类化合物分离效果的影响,结果见图2。

图2 硼酸盐缓冲溶液的浓度对8种黄酮类化合物迁移时间和分离度的影响Fig.2 Effect of concentration of borate buffer solution on migration time and resolution of the 8 flavonoid compounds
由图2 可以看出:当硼酸盐缓冲溶液浓度为5 mmol·L-1时,迁移时间较短,但分离度较差;随着硼酸盐缓冲溶液浓度的增加,迁移时间和分离度都随之增加;当硼酸盐缓冲溶液浓度为15 mmol·L-1时,迁移时间适中,分离度较大。试验选择硼酸盐缓冲溶液的浓度为15 mmol·L-1。试验还对15 mmol·L-1的硼酸盐缓冲溶液的酸度(pH 8.9~9.3)进行了优化,结果显示:硼酸盐缓冲溶液的p H由8.9增至9.3时,黄酮类化合物的分离度随之增加;当pH 为9.4时,基线漂移严重,推测是OH-浓度较大,导致离子强度增大,电流强度明显增大所致。综合考虑,试验选择硼酸盐缓冲溶液的p H 为9.3。
试验还考察了硼酸盐缓冲溶液中β-CD 的浓度(5,10,15,20,25 mmol·L-1)对8种黄酮类化合物衍生物分离效果的影响,结果见图3。
由图3可以看出:当运行缓冲溶液中β-CD 浓度为15 mmol·L-1时,迁移时间适中,分离度最高。因此,试验选择运行缓冲溶液中β-CD 的浓度为15 mmol·L-1。
2.3 标准曲线和检出限
按照试验方法对8种黄酮类化合物混合标准溶液系列进行衍生化和测定,以8种黄酮类化合物衍生物的浓度为横坐标,其对应的峰面积为纵坐标绘制标准曲线,线性参数见表1。
以3倍信噪比(S/N)计算检出限(3S/N),8种黄酮类化合物衍生物的检出限见表1。
由表1可以看出,8种黄酮类化合物衍生物的检出限为0.022~0.039 mmol·L-1。
2.4 精密度和回收试验
按照试验方法对苦荞壳样品进行2个浓度水平的加标回收试验,每个浓度水平平行测定5次,计算测定值的相对标准偏差(RSD)和回收率,结果见表2。
由表2可知:8种黄酮类化合物测定值的RSD为1.3%~3.2%,回收率为99.1%~101%。
苦荞壳样品中黄酮类化合物衍生物的电泳谱图见图4。

图3 运行缓冲溶液中β-CD浓度对8种黄酮类化合物迁移时间和分离度的影响Fig.3 Effect of concentration ofβ-CD in running buffer solution on migration time and resolution of 8 flavonoid compounds

表1 线性参数和检出限Tab.1 Linearity parameters and detection limits

表2 精密度和回收试验结果(n=5)Tab.2 Results of tests for precision and recovery(n=5)

图4 苦荞壳样品中黄酮类化合物衍生物的电泳谱图Fig.4 Electropherogram of derivatives of the flavonoid compounds in tartary buckwheat shell sample
由图4可以看出,苦荞壳样品中检出了儿茶素、芦丁、山奈酚、槲皮素、异槲皮苷,其质量分数为3.35~5.19 mg·kg-1。
本工作以毛细管电泳分离和测定了苦荞壳中的黄酮类化合物,该方法有较高的精密度和回收率,对发掘苦荞壳潜在的经济价值提供了一定的参考,可为提升苦荞附加值和拓宽苦荞产业链服务。
