普鲁士蓝/纳米金修饰电极上H2O2电催化还原的研究
2020-09-15许胜南金葆康
许胜南,金葆康
(安徽大学 化学化工学院,安徽 合肥 230601)
过渡金属六氰合铁酸盐(MHCFs)的研究是从普鲁士蓝(Prussian blue, 简称PB)的发现开始的.普鲁士蓝是已知的最古老的配位化合物,人们花了两个半世纪才发现它是一种电活性物质.到目前为止,有关普鲁士蓝电化学研究的相关文献超过3 000余篇,它是所有MHCFs中最知名和研究最深入的化合物.普鲁士蓝可以不同的形式存在,这取决于Fe中心的氧化态,其完全还原形式普鲁士白(Prussian white,简称PW)可以有效电催化还原H2O2[1-3].因此,它被广泛用于检测H2O2的传感器、基于氧化酶的生物传感器以及能量存储设备[4].
最早的普鲁士蓝电化学合成方法一般是在铁氰化物[Fe(CN)6]3-和Fe3+的稳定混合液中还原Fe3+得到的.严格来说,这种方法合成的是特恩布尔蓝(Turnbull’s blue),但其结构与普鲁士蓝相同[5-6].值得注意的是,混合溶液的pH应该足够小以避免铁离子水解,否则Fe3+/2+将被羟基离子而不是氰化物桥占据,从而影响PB的稳定性.在PB被还原后,需要用钾离子进行电荷补偿[7].
过氧化氢是氧化酶生物催化作用的产物,氧化酶是90%以上酶基生物传感器和分析试剂盒的末端产物[8-9].过氧化氢本身是雨水和地下水中的化学污染物,是工业和原子能发电站的废物.此外,过氧化氢浓度的检测在糖尿病的诊断和治疗方面也占有着举足轻重的地位[10-12].在所有检测H2O2的可行方法中,例如近红外光谱、荧光光谱、液相色谱质谱和电化学方法等,研究已证明电化学方法更为灵敏、选择性更高且成本较小[13-14].在较低电位下检测H2O2是基于氧化酶生物传感器的基本要求,其目的是在易氧化的化合物共存下实现高选择性和高灵敏度的测定.Karyakin等[15]首次提出通过PB修饰电极来选择性检测H2O2.PB对氧和H2O2的催化作用归因于其特殊结构.PB的立方晶胞为10.2 Å,通道直径约为3.2 Å,其类沸石结构可以使低分子量分子通过晶体扩散[16],因此Itaya等[17]将PB形容为三维的催化剂.Moscone等[18]在铁氰化物溶液中将PB电沉积到固体石蜡制备的碳糊电极上,所制的碳糊-普鲁士蓝传感器在中性和弱碱性介质中显示出高操作稳定性.Jia等[19]在纳米多孔金膜电极上电沉积PB,制备的复合电极对H2O2显示出非常高的电催化活性,其活性大约是PB修饰的抛光金电极的20倍.
由于贵金属纳米粒子通常具有良好的催化活性,为了提高PB修饰电极的灵敏度和稳定性,笔者采用先在裸金电极上自组装4,4’-联苯二甲硫醇,随后电沉积纳米金,然后再沉积普鲁士蓝的方法来制备修饰电极,并且对该修饰电极的电化学行为和其对H2O2电催化还原性能进行研究.基于纳米金较高的比表面积,可以为PB的电沉积提供异相晶种,所以与传统的直接在电极上电沉积普鲁士蓝相比,有效地提高了对H2O2检测的灵敏度,从而降低了H2O2的检出下限.
1 实验部分
1.1 实验仪器与试剂
CHI660d电化学工作站,上海辰华仪器公司;SL202电子天平,上海精密科学仪器有限公司;S-4800冷场发射式扫描电镜,日本日立公司;S6104超声清洗器,芯硅谷;电化学实验的进行以修饰电极为工作电极、饱和甘汞电极(SCE)和铂电极为参比电极和对电极.所用试剂均为分析纯,4,4’-联苯二甲硫醇(MTP)为实验室合成[20].
1.2 PB/AuNPs/Au修饰电极的制备
金电极首先依次用0.3 μmol·L-1和0.05 μmol·L-1与水混合的三氧化二铝粉进行打磨抛光,超声清洗10 min.随后将电极浸泡在Piranha溶液(V(98%H2SO4)∶V(30%H2O2)=3∶1)中10 min,依次用无水乙醇和二次水清洗,重复操作3次,最后将电极用氮气吹干备用.
将处理干净的金电极浸泡在0.5 mmol·L-1MTP乙醇溶液中6 h后取出,用乙醇洗净表面未吸附的MTP,氮气吹干后将电极置于2 mg·mL-1的HAuCl4溶液中,采用恒电位沉积法,在-0.2 V的电位下进行电化学还原,制得AuNPs/Au电极.
将AuNPs/Au电极放入新鲜配制的4 mmol·L-1FeCl3与4 mmol·L-1K3Fe (CN )6的混合液中,以0.1 mol·L-1KCl 和0.1 mol·L-1HCl为支持电解质.普鲁士蓝(PB)的修饰采用循环伏安法进行,在0.8~0.4 V的电位范围内以50 mV·s-1的扫速进行循环扫描20圈,即可制得PB/AuNPs/Au电极.用二次水冲洗干净后将其放入浓度为0.1 mol·L-1KCl和0.1 mol·L-1HCl的溶液中,在0.4~-0.1 V范围内循环扫描15圈,直到获得稳定的循环伏安图.最后将制好的电极放于烘箱中80 ℃下烘干1 h.
2 结果与讨论
2.1 实验条件的优化
2.1.1 纳米金电沉积时间的影响
探究纳米金不同电沉积时间(60,120,180,240,300 s)对修饰电极电化学行为的影响.在保持其他修饰条件不变的情况下,只改变纳米金的电沉积时间来制备电极,并将电极置于0.1 mol·L-1KCl和0.1 mol·L-1HCl的溶液中以50 mV·s-1的扫速进行CV扫描,结果如图1所示.
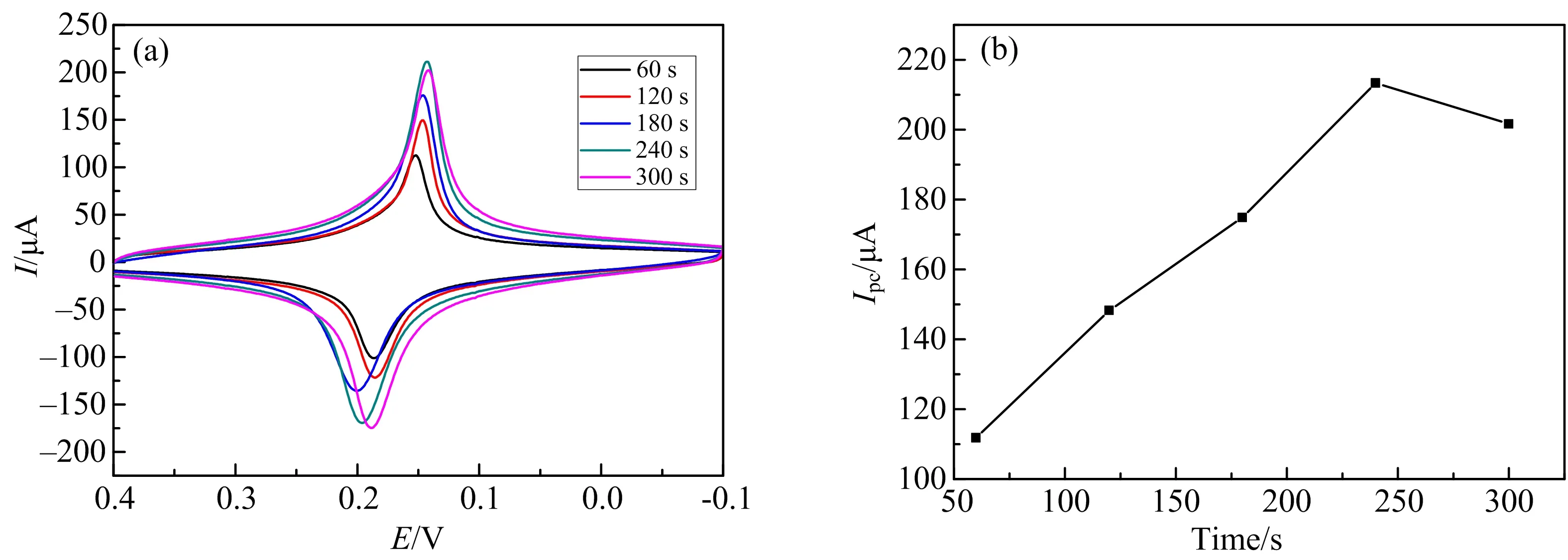
(a)CV图,扫速为50 mV·s-1;(b)还原峰电流与纳米金电沉积时间的关系.图1 纳米金不同电沉积时间下PB/AuNPs/Au修饰电极在0.1 mol·L-1 KCl 和0.1 mol·L-1 HCl溶液中电化学行为
从图1可以看出,修饰电极的电流随纳米金电沉积时间增大而逐渐增大,但当电沉积时间到240 s后,电流开始减小.这是因为较短的电沉积时间,只能在电极表面得到少量的纳米金,而电沉积时间过长时,则会在电极表面形成致密的金膜,二者均不能为PB的沉积提供足够的异相晶种,影响PB膜的形成.所以选择240 s作为最佳的纳米金电沉积时间来开展接下来的实验.
2.1.2 PB电沉积圈数的影响
PB膜电沉积圈数对修饰电极电流的影响,如图2所示.

(a)CV图,扫速为50 mV·s-1;(b)还原峰电流与电沉积圈数的关系.图2 PB不同电沉积圈数下PB/AuNPs/Au修饰电极的电化学行为
PB膜电沉积圈数对修饰电极的灵敏度有很大的影响.PB膜的厚度随着扫描圈数的增大而增加,同时也影响着修饰电极电流的大小.从图2可以看出,当电沉积圈数从10圈逐渐增大到20圈时,电流不断增大,但是20圈以后,电流增大幅度开始趋于平缓.PB膜薄,电极稳定性高,电流响应信号好,随着电沉积圈数增多,PB膜变厚,修饰电极的机械稳定性降低(易破碎),所以选择20圈作为最佳的电沉积圈数.
2.2 PB/AuNPs/Au修饰电极的表征
2.2.1 PB/AuNPs/Au修饰电极的EIS图
利用电化学阻抗谱跟踪电极的修饰过程,结果如图3所示.

图3 不同修饰阶段电极的阻抗图
图3中曲线a是处理干净的裸金电极的阻抗图,曲线b是自组装MTP后的阻抗图,由于Au-S键的作用,MTP自组装至电极表面,导致电荷传递电阻急剧增大.曲线c是修饰了纳米金的阻抗图,可以看出该曲线接近直线,这是由于修饰的纳米金粒子恢复了电子转移速率,导致电极的阻抗减小了.曲线d是PB/AuNPs/Au修饰电极的阻抗图,相比曲线c,它的直径较大,说明修饰了PB之后阻碍了溶液和电极之间的电子传递.
2.2.2 PB/AuNPs/Au修饰电极的SEM图
利用SEM评估修饰电极表面PB电沉积前后的形貌,结果如图4所示.

图4 AuNPs/Au电极(a)和PB/AuNPs/Au电极(b)的SEM图
图4(a)显示的是电沉积纳米金的SEM图.采用电沉积的方法制备纳米金的优点在于,可以通过改变HAuCl4浓度和电沉积时间来控制纳米金颗粒的尺寸和密度.从图中可以看到金晶体均匀地覆盖在电极表面,与裸金电极相比,覆盖纳米金的表面可以提供更高的表面体积比,同时提供异相晶种,从而优化PB在电极表面的固定化和成核.图4(b)显示的是PB/AuNPs/Au修饰电极的SEM图,可以看到PB颗粒成功沉积在之前修饰的纳米金的电极表面,PB膜结构致密,并且较好地分散在其表面.
2.3 PB/AuNPs/Au修饰电极的电沉积
PB的电沉积是一个复杂的过程,如图5所示.由图5可知,在约0.7 V的电位下,FeIII[FeIII(CN)6]络合物被还原,并且使PB沉积在电极表面上.在0.4 V的电位下,Fe3+被还原为Fe2+,然后生成的Fe2+与[Fe(CN)6]3-反应,导致大量PB在电极表面沉淀.电流随着沉积循环增加而增大,表明PB膜厚度在逐渐增加.在实验过程中,要保证参比电极和对电极放置在彼此靠近的位置,但必须与工作电极在空间上有一定的距离,以避免PB沉积在对电极上,同时在工作电极表面建立不受干扰的扩散区域,否则形成的PB膜不均匀而且易碎.此外,在PB沉积过程中溶液的pH不应超过1.因为对电极在反应过程中水的还原而导致OH-的释放,使整个溶液的pH发生显著变化,而pH的增大会导致Fe(OH)3的生成,从而阻止了PB膜的电沉积.
研究发现循环扫描过程会导致普鲁士蓝(PB)晶体结构的重新组织,可提高电极的稳定性[1].电沉积结束后,修饰电极在0.1 mol·L-1KCl 和0.1 mol·L-1HCl溶液中循环扫描20圈,电位范围0.4~-0.1 V,扫速50 mV·s-1,活化电极,结果如图6所示.

图5 在AuNPs/Au电极上电沉积PB的CV图

图6 循环伏安法活化沉积的PB的CV图
从图6可以看出,在该电位范围内有一对可逆性良好的氧化还原峰,其峰面积代表沉积物的质量.在每个循环过程中,峰值电流不断增大,电子转移速度加快,氧化还原可逆性增强.该对氧化还原峰对应的是氧化态的PB和还原态的PW,其反应为
KFeⅢFeⅡ(CN)6+ 4K++4e-K2FeⅡFeⅡ(CN)6,
(1)
PB PW
这一实验现象从电极表面颜色变化也可以明显观察到.当电极由0.4 V扫到-0.1 V时,膜从蓝色变成白色,而反向扫描时再次变成蓝色.同时为了维持膜的电中性,该氧化还原过程伴随着K+在晶格内的迁入和迁出.
2.4 PB/AuNPs/Au修饰电极的电化学行为
PB/AuNPs/Au修饰电极和PB/Au修饰电极的电化学行为如图7所示.

图7 PB/AuNPs/Au电极和PB/Au电极在0.1 mol·L-1 KCl和0.1 mol·L-1 HCl溶液中的CV图,扫速为50 mV·s-1
据文献报道,PB在电极表面膜的形成主要通过PB纳米晶体的成核作用[21].纳米金颗粒的存在为PB晶核的形成提供了异相晶种,因此加快了PB在电极表面的沉积速率.而且由于纳米金粒子粒径小,数量众多,可以为PB的电沉积提供更高的表面体积比,从而改善电沉积PB的固定和成核.由图7可知,在0.4~ -0.1 V的电势范围内,以50 mV·s-1的扫速进行循环伏安扫描,在两个电极中都可以明显观察到1对氧化还原峰,表明PB和PW之间的氧化还原反应无论是在纳米金修饰的表面还是裸金电极表面都是呈近可逆状态,2个电极上的阳极和阴极峰值电位几乎相同,分别为200 mV和150 mV.图7显示,PB/AuNPs/Au修饰电极电流远大于PB/Au修饰电极电流,这表明在裸金电极表面电沉积1层纳米金,可以促进沉积过程中PB颗粒的成核,使得电极表面上修饰更多PB.
PB/AuNPs/Au修饰电极在0.1 mol·L-1KCl和0.1 mol·L-1HCl中不同扫速下的CV图以及其峰值电流和扫速的线性关系曲线,如图8所示.

图8 PB/AuNPs/Au电极在不同扫速下的CV图(a)及其阳极和 阴极峰值电流与扫速平方根的关系曲线(b)
从图8可以看出,阴极峰值电流与阳极峰值电流之比几乎为1,电极的阳极峰电位(和阴极峰电位)均随着扫速的增大而向更正(和更负)一侧偏移.结果表明,PB在电极表面的氧化还原反应是准可逆反应.在较低扫速下,峰值电流与扫速的平方根(v1/2)成正比,表明整个电化学反应过程受K+在PB中的晶格扩散控制.
2.5 PB/AuNPs/Au修饰电极的稳定性
将修饰电极放置于0.1 mol·L-1KCl和0.1 mol·L-1HCl的溶液中,以50 mV·s-1的扫速,从-0.1 V至0.4 V进行循环伏安扫描150圈,结果如图9所示.

图9 PB/AuNPs/Au电极循环扫描150圈的CV图
从图9可以看出,电极经历了150圈的循环扫描后,还原电流仅下降7.9%,表明PB/AuNPs/Au修饰电极在实验条件下具有较高的稳定性.
2.6 PB/AuNPs/Au修饰电极对H2O2的电化学响应
为了评估PB/AuNPs/Au修饰电极的电催化活性,比较了PB/AuNPs/Au修饰电极和PB/Au修饰电极对H2O2的电催化还原.在工作电极上施加的电位为-100 mV,在搅拌下,连续加入H2O2溶液,通过计时电流法来记录测量结果,结果如图10所示.

图10 PB/AuNPs/Au电极和PB/Au电极对连续滴加H2O2的电流响应
从图10可以看出,在相同实验条件下,PB/AuNPs/Au修饰电极和PB/Au修饰电极都对H2O2有明显的电流响应,响应时间小于5 s,但是PB/AuNPs/Au修饰电极对相同浓度H2O2的响应明显优于PB/Au修饰电极,表明纳米金的存在增强了电极对H2O2的响应灵敏度.
由于PB/AuNPs/Au修饰电极对H2O2具有优良的电催化活性,进一步通过计时电流法探究其性能,结果如图11所示.

图11 PB/AuNPs/Au电极对连续滴加H2O2的电流响应(a)以及响应电流与H2O2浓度的校准曲线(b)
图11(a)显示,随着H2O2浓度逐渐增大,响应电流也随之增加,然后趋于稳定.对响应电流和与之对应的H2O2浓度进行作图,发现二者之间存在良好的线性关系,由图11(b)的校正曲线可以看出,PB/AuNPs/Au修饰电极在H2O2浓度为3.92×10-6~1.61×10-3mol·L-1范围内具有良好的线性关系,相关系数(R2)为0.998 9,校准曲线的斜率为54.32 μA·(mmol·L-1)-1,计算得出其灵敏度为1 730 μA·(mmol·L-1)-1·cm-2,电极的最低检出限为1.96×10-7mol·L-1.
2.7 PB/AuNPs/Au修饰电极的选择性和回收率的测定
在葡萄糖、尿酸(UA)、抗坏血酸(AA)、多巴胺(DA)等常见干扰因素存在的条件下,通过滴加H2O2记录修饰电极的计时电流响应来检验PB/AuNPs/Au修饰电极的选择性和抗干扰性,结果如图12所示.

图12 PB/AuNPs/Au电极抗干扰性能的测定
从图12可以看出,当向溶液中依次滴加0.5 mmol·L-1的葡萄糖、UA、AA、DA时,电极并无明显反应,而当加入0.3 mmol·L-1的H2O2时,电流由8 μA突然增大到近20 μA,而且在3 s内达到稳定响应,表明该修饰电极具有良好的抗干扰性能以及对H2O2优良的选择性.
为了考察PB/AuNPs/Au修饰电极的实用性,对该电极进行回收测试实验,结果如表1所列,所得回收率在97%~109%范围内,说明PB/AuNPs/Au修饰电极准确度良好,可以用于H2O2的检测.

表1 H2O2回收率的测定
3 结束语
笔者通过将PB电沉积到纳米金修饰的金电极上成功制备了一种新型PB修饰电极,并探究了其电化学和电催化性能.与直接在裸金电极上电沉积PB相比,PB被更好地沉积在电极表面,PB/AuNPs/Au修饰电极具有更高的峰值电流,而且对H2O2具有更高的电催化活性和灵敏度.同时该修饰电极显示出良好的选择性,有望用于实际样品中H2O2的检测.
