基于显色法的纸基微流控芯片用于水中的三氮检测
2020-09-14徐榕杨叶欣林敏李晓东冯爱玲
徐榕 杨叶欣 林敏 李晓东 冯爱玲


摘 要 硝酸盐、亚硝酸盐和氨氮 (简称“三氮”) 是水体中的主要污染物,目前我国的地表水和浅层地下水中普遍存在三氮污染问题。本研究将显色法与纸基微流控技术结合,制备了单通道纸基微流控芯片,在优化的反应条件下,分别对3种含氮化合物进行检测,亚硝酸盐、硝酸盐和氨氮的检出限分别为0.001 mmol/L、 1 mmol/L和1 mg/L; 在实际样本的检测中,3种样本的加标回收率均在95.4%~114.9%之内。其次,通过合理的结构设计将分别用于3种含氮化合物检测的单通道纸基微流控芯片集成于一体,制备出用于三氮同时检测的多通道纸基微流控芯片,多通道纸基微流控芯片的检测结果与单通道纸基微流控芯片的检测结果具有良好的一致性。本研究提出的基于显色法的多通道纸基微流控芯片可对水中的三氮进行同时检测,并且,此芯片具有成本低廉、灵敏度高和便于操作等特点,适用于现场快速检测,有望在资源匮乏的水源污染地区推广。
关键词 显色法; 三氮检测; 纸基微流控
1 引 言
水质安全与人类的生命健康息息相关,污染水的摄入会引发各类疾病,甚至导致死亡[1,2]。水体中的硝酸盐、亚硝酸盐和氨氮 (简称“三氮”) 作为主要的无机非金属含氮污染化合物,是水质安全检测的重要指标之一。通过对水体中三氮含量的检测,可有效监测水质安全,防止污染水的摄入,并能够准确判断水体污染的特征,采取及时有效的治理措施。目前,三氮的检测方法主要有分光光度法[3]、光谱法[4]和电化学法[5]。分光光度法是一種较为精确的水质检测方法,但该方法对仪器的要求通常较高,并且所用的检测试剂苯酚含有剧毒。光谱法检测水质安全时常需要复杂的样本预处理过程,以及专业的操作人员。电化学法操作简单,检测速度快,适用于水质安全的实时监测,但是,当水体成分复杂时,电极易受到其它离子的干扰,造成检测不稳定和检出限高等问题。化学显色法通过显色剂颜色的变化对检测结果进行直观快速的判断,具有操作简单、成本低廉、适合现场快速检测等特点[6]。目前,化学显色法已广泛应用于水体中含氮污染物的检测。如Cho等[7]提出以多孔滤纸为载体的检测策略,无需借助专业的实验室仪器,仅通过改进的Berthelot反应即可对水样中的氨氮含量进行比色检测,检测范围在10~1020 mg/L之间,但该方法仅实现了水样中氨氮的检测,无法对三氮进行同时检测。发展便携式的多目标物同时检测的装置可有效解决现存水质中三氮检测方案的缺陷,有利于偏远地区和野外的水质安全的实时监测。
纸基微流控分析器件 (Microfluidic paper-based analytical devices,μPADs) 是一种以纸为基体材料的微流控装置,因其成本低廉、质量轻巧、修饰简便等优势,成为近年检测分析的研究热点和有力手段[8,9]。通过结合不同的疏水试剂和图案化工具,纸基微流控分析器件可通过构建多样化的通道实现多目标物检测[10]。Jayawardane等[11]以纸基微流控芯片为检测平台,利用显色剂与目标物之间的化学反应,实现了对硝酸盐和亚硝酸盐的同时检测。但是,该检测平台仅可对两种含氮化合物进行同时检测,并且使用的纸基芯片需借助喷蜡打印机制备亲疏水通道,操作过程繁琐。目前,利用纸基微流控芯片对水体中三氮进行同时检测的文献鲜有报道。
本研究设计了一种基于显色反应的纸基微流控芯片,用于对水体中三氮的同时检测。首先利用单一通道的纸基微流控芯片分别验证每种含氮化合物的检测方案,并对反应条件进行优化; 其次,通过将3种单通道纸基微流控芯片的加样区进行集成,制备出多通道纸基微流控芯片,用于三氮同时检测。在本研究中,硝酸盐和亚硝酸盐的检测利用Griess试剂的偶氮反应,通过在相应的检测区产生洋红色的颜色变化判断检测结果; 通过Berthlot显色试剂与底物相互作用生成蓝绿色络合物反映氨氮的检测结果。结合显色反应与纸基微流控芯片的优势,本研究可对实际水样中的亚硝酸盐、硝酸盐和氨氮进行同时检测,检出限分别为0.001 mmol/L、1 mmol/L和1 mg/L,满足国标[12]对于饮用水中三氮检测的要求。
2 实验部分
2.1 仪器与试剂
VLS2.30激光切割机(美国Universal公司); DPX-9082B电热恒温培养箱(上海南荣实验设备有限公司); DZ-1BC II真空干燥箱(上海飞越实验室仪器有限公司) ; PVC背胶板(上海捷宁生物科技有限公司); 高速定量滤纸(上海捷宁生物科技有限公司); 打孔器和滤网筛(0.15 mm孔径)。
磺胺(纯度>99.5%)、柠檬酸(纯度>99.5%)、H2SO4(分析纯)、锌粉(分析纯)、LiOH(分析纯)、NaNO2(纯度99.9%)、NaNO3(纯度99.9%)、NH4Cl(纯度99.5%)、蔗糖(分析纯)、无水乙醇(分析纯)、无水乙醚(分析纯)均购于天津致远化学试剂公司; N-1萘基乙二胺盐酸盐(纯度>98%)、水杨酸钠(分析纯)、硝普钠(纯度99.98%)、二氯异氰尿酸钠(纯度98%)、甲基纤维素(纯度BR)均购于阿拉丁试剂有限公司; 实验用水为二次蒸馏水(18.2 MΩ·cm,IQ 7003Milli-Q 纯水仪(美国 Millipore 公司) 制备)。
2.2 实验方法
2.2.1 单通道纸基微流控芯片的构建 纸基微流控芯片主要由PVC背胶板、加样区、流道和检测区组成,加样区、流道和检测区均由高速定量滤纸构建。其中,亚硝酸盐通道和硝酸盐通道的构建方法: 使用CoreDraw软件绘制出加样区、流道和检测区的轮廓,再使用激光切割机对每一部分进行切割,以PVC背胶板为支撑基底将加样区、流道和检测区进行组装,得到单一通道的纸基微流控芯片。氨氮通道的构建方法: 首先使用滤网筛将所用试剂均匀分布在滤纸上,再使用乙醇润湿,室温放置30 min后,将其剪裁成直径为5 mm的显色区,同样以PVC背胶板为基底,依次将加样区、流道和检测区进行组装,其中检测区和流道之间有2 mm的重叠。
2.2.2 亚硝酸盐的单通道纸基微流控检测方法 亚硝酸盐中NO2的检测过程: 首先,在组装完成的单通道微流控芯片的检测区滴加1 μL 2% HCl 溶液,室温放置10 min; 然后,在检测区内滴加0.8 μL Griess试剂,将芯片置于60℃真空干燥箱中干燥15 min; 将10 μL样品梯度液滴加在单通道纸基微流控芯片的检测区,室温放置3 min后,将芯片置于内置固定光源的暗箱中,使用CCD相机对芯片的检测区进行显色结果的拍摄。其中,Griess试剂的配制方法参照文献[13],试剂配比为:柠檬酸钠330 mmol/L,磺胺 30 mmol/L 和1-2萘乙二胺盐酸盐 10 mmol/L,溶剂为超纯水。本实验中梯度液的NO2来源于NaNO2,首先使用超纯水配制10 mol/L NaNO2母液,再将其按照10∶1的比例稀释为10、1、0.1、0.01和0.001 mmol/L的浓度梯度样本溶液。
对实际水样进行检测和加标回收实验时,首先使用单通道纸基微流控芯片对随机选取的湖水样进行初始浓度的测量,然后进行标准加入实验,加标水平分别为0.025、0.05和0.1 mmol/L,在单通道芯片的加样区滴加每种浓度的梯度加标溶液10 μL,室温放置3 min后,使用CCD相机对芯片的检测区进行显色结果的拍摄,每个加标水平重复检测3次。
显色结果使用Image J软件进行分析:将检测结果照片导入到软件中,使用软件对图片进行分通道,处理选取绿色通道(检测结果的颜色变化在绿色通道中最为明显),选中显色区域,进行平均灰度值计算,将目标物浓度与检测结果的灰度值相对应,绘制标准曲线。
2.2.3 硝酸盐的单通道纸基微流控检测方法 金属锌可将硝酸盐还原为亚硝酸盐,在进行硝酸盐检测时,首先使用锌粉将其还原为亚硝酸盐,再采用2.2.2节的方法进行检测。锌粉还原硝酸盐分为两步: 第一步需要对锌粉进行活化,将3 mL 2% (w/V) HCl 与1.2 g 锌粉混合搅拌1 min,分别使用超纯水洗涤3次,无水乙醇洗涤2次,无水乙醚洗涤1次,洗涤完成之后的锌粉置于37℃烘箱中彻底干燥后,于真空干燥箱进行保存; 第二步将活化后的锌粉用于还原硝酸盐,在制备完成的单通道纸基微流控芯片的检测区上滴加1 μL 2% (w/V) HCl,室温放置10 min,然后在检测区内滴加0.8 μL Griess试剂,并在60℃真空干燥箱中干燥15 min,称取0.1 g活化后的锌粉溶于500 μL蔗糖溶液中 (饱和度为50%) 配制锌粉蔗糖溶液,混匀后静置,直至锌粉完全沉淀,再使用移液枪吸取锌粉蔗糖溶液的沉淀物在单通道芯片的流道上划线2次 (1 μL/次),室温放置15 min后,将样本梯度浓度液和梯度加标溶液滴加在检测区进行检测。本实验中标准样本的NO3来自于NaNO3,称取101.1 mg NaNO3溶于10 mL超纯水中,然后将其稀释为1000、500、100、50、10和5 mmol/L的浓度梯度样本溶液,在单通道芯片的加样区滴加每种梯度加标溶液10 μL,每个加标溶液重复检测3次,室温放置3 min后,使用CCD相机对芯片的检测区进行显色结果的拍摄。
在对实际样本进行检测时,首先使用单通道微流控芯片对随机选取的湖水样本中的硝酸盐进行初始浓度的测定,然后进行加标回收实验,实际样本的梯度加标溶液的检测和检测结果分析同2.2.2节。
2.2.4 氨氮的单通道纸基微流控检测方法 氨氮的单通道纸基微流控检测分为两步: (1)加入显色剂。 称取甲基纤维素38.2 mg、蔗糖60 mg、水杨酸钠38.2 mg、二氯异氰尿酸钠15.2 mg、LiOH 7.6 mg和硝普鈉20 mg于玛瑙研钵中混合,研磨均匀,使用孔径为0.15 mm的滤网筛将粉末均匀分散在乙醇润湿的高速定量滤纸上,在滤纸表面均匀喷洒乙醇,直至粉末完全湿润,室温放置30 min后,将其剪裁成5 mm的检测区; (2)将加样区、流道和检测区组装后用于样本检测,组装时检测区与流道之间有2 mm重叠。
用于氨氮检测的标准样品由NH4Cl配制,将NH4Cl试剂置于105℃烘箱中干燥2 h后,配制成氨氮浓度为1 mg/mL的母液,再稀释为50、20、10、5和1 mg/L的梯度浓度样本溶液,在单通道芯片的加样区滴加每种浓度的加标溶液20 μL,重复检测3次,室温放置15 min后,使用CCD相机对芯片的检测区进行显色结果的拍摄。
在对实际样本进行检测时,用单通道芯片对随机选取的湖水样本进行初始浓度测量,然后取3份样品,分别加入干燥处理后的NH4Cl,进行标准添加实验,实际样本梯度加标溶液的检测和检测结果分析同2.2.2节。
2.2.5 多通道纸基微流控芯片的构建及三氮同时检测 多通道纸基微流控芯片的构建是通过合理的结构设计将3个单通道纸基微流控芯片进行集成,实现三氮同时检测。多通道纸基微流控芯片主要由1个PVC基底、3条流道、3个检测区和1个加样区构成,首先使用激光切割机将PVC背胶板切割成直径为4 cm的圆形基底,再在圆形基底上切割出装配通道,然后将高速定量滤纸分别切割成加样区、流道和检测区,分别使用单通道纸基微流控芯片中检测区的处理方法,对多通道纸基微流控芯片的3个检测区进行处理。处理完成之后,将圆形基底上装配通道的胶面撕下,依次将流道、检测区和加样区进行粘贴,其中,检测区和加样区分别与流道有2 mm的重叠,粘贴完成之后即可形成多通道纸基微流控芯片。
将多通道纸基微流控芯片用于三氮同时检测时,标准检测液为包含亚硝酸盐、硝酸盐和NH4Cl的梯度混合液,其中梯度混合液中亚硝酸盐、硝酸盐和氨氮的浓度梯度分别与单通道纸基微流控芯片中的样本梯度浓度液相同。在使用多通道纸基微流控芯片检测梯度混合液时,取每种浓度的梯度混合液40 μL滴加在加样区,室温放置3 min后,使用CCD相机对亚硝酸盐和硝酸盐的检测区进行拍照; 15 min后,对氨氮的检测区进行拍照,显色照片的处理方法同2.2.2节。
3 结果与讨论
3.1 检测原理
用于水中三氮检测的纸基微流控芯片包含3个检测区、3条流道和1个加样区,3个检测区分别用于硝酸盐、亚硝酸盐和氨氮的检测。亚硝酸盐的检测是通过NO2与对氨基苯磺酸重氮化后,再与1,2萘乙基盐酸盐耦合,在检测区形成紫红色染料,通过检测区颜色强度的变化判断亚硝酸盐的含量,此方法参照国标亚硝酸盐检测法[15]; 在使用微流控芯片检测硝酸盐时,首先用锌粉将其还原成亚硝酸盐,再用上述方法检测; 氨氮检测是在苯酚存在下,利用NH+4与HClO形成蓝绿色络合物进行显色[14]。检测区的颜色深度与目标物的浓度呈正相关,检测区颜色越深,目标物浓度越高。通过Image J软件分析检测区域图片的灰度值,与标准曲线进行比对,实现3种目标物的定量检测。
3.2 亚硝酸盐单通道检测结果与反应条件优化
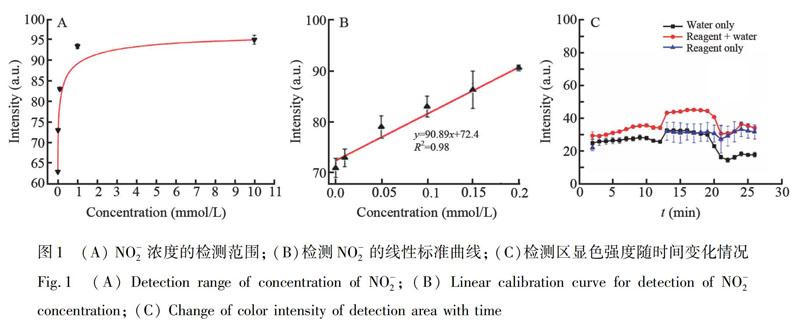
亚硝酸盐浓度的检测范围和线性标准曲线如图1A和1B所示,检测范围为0.001~10 mmol/L,在0.001~1 mmol/L之间呈良好的线性关系,线性回归方程为y=90.89x+72.4 (R2=0.98),检出限为0.001 mmol/L。与Zheng等[16]使用水溶性铜纳米簇检测亚硝酸盐的方法相比,本方法避免了复杂的纳米材料制备过程,仅通过化学试剂相互作用产生的颜色变化便可观察显色结果。
在亚硝酸盐检测中,显色剂在湿润条件下可能会与空气中的某些物质发生氧化反应,进而影响检测结果。对显色剂开始产生氧化的时间进行判断,进而推断检测时目标物的最佳反应时间。 以不含显色剂的空白检测区作为参照,分别在空白检测区和含有显色剂的检测区滴加等体积的水,以20 s的时间间隔,使用CCD相机记录检测结果。检测结果如图1C所示,在0~3 min内,空白显色区和含有显色剂的检测区灰度值相近,此时未发生氧化; 在3~6 min内,检测区被完全浸透,与空白显色区相比,含有显色剂的检测区灰度值较高,表明显色剂开始氧化; 6 min后,样本液体逐渐蒸发,含有显色剂的显色区灰度值明显高于参照组。因此,检测亚硝酸盐时反应时间控制在3 min,此时显色剂未发生氧化,显色效果达到最优。
3.3 硝酸盐单通道检测结果与反应条件优化
硝酸盐浓度的检测范围和线性标准曲线分别如图2A和2B所示,检测范围为1~300 mmol/L,线性检测范围为1~210 mmol/L,线性方程为y=0.5377x + 69.04 (R2=0.99),检出限为1 mmol/L。
在硝酸盐检测方案中,锌粉对硝酸盐的还原情况是影响检测结果的主要因素。对纸基微流控芯片中活化后锌粉的加入量进行了考察,分别在单通道纸基微流控芯片的流道上滴加1、2、3次锌粉溶液,每次滴加的量为1 μL,芯片的显色结果如图2C所示,滴加两次锌粉时,显色强度达到最佳; 继续增加锌粉的量后,可能会导致样品损失,使达到检测区的样本量减少,影响显色结果。本研究选择锌粉加入量为2 μL,每次滴加1 μL于流道上。
3.4 氨氮单通道检测结果与反应条件优化
氨氮浓度的检测范围和线性标准曲线分别如图3A和3B所示,检测范围为1~50 mg/L,在1~20 mg/L 之间呈良好的线性关系,线性标准方程 y=15.3x+ 68.72 (R2=0.96),检出限为1 mg/L。在氨氮检测中,催化剂硝普钠的含量对显色强度有直接影响。在其它试剂保持不变的情况下,考察了硝普钠的含量为8、12、16、20和24 mg的影响,检测结果如图3C所示,当硝普钠的含量为20 mg时,显色强度达到最佳。
3.5 多通道纸基微流控芯片结构的优化
纸基微流控芯片可以通过合理的结构设计实现在同一检测平台上多种目标物的同时检测。本研究在构建了检测亚硝酸盐、硝酸盐及氨氮的單通道纸基芯片的基础上,通过结构优化,将3种单通道纸基微流控芯片集成,制成用于同时检测三氮化合物的多通道纸基微流控芯片,多通道纸基微流控芯片的初始流道宽度及检测区面积和单通道纸基微流控芯片一致。但是,由于亚硝酸盐和硝酸盐的检测体系所需样本体积小于氨氮检测所需的样本体积,故对氨氮流道的尺寸进行调整,亚硝酸盐和硝酸盐流道宽度保持不变 (3 mm) 。在对氨氮流道进行尺寸调整时,以超纯水为样本,验证不同的流道直径可容纳的样本量。分别称量加样前后检测区的重量,最终确定当氨氮流道的宽为4 mm时,检测区可容纳约210 mg超纯水,满足氨氮检测所需的样本量,纸基微流控芯片各组分的尺寸如图4A所示,最终的多通道纸基微流控芯片结构如图4C 所示。
3.6 实际水样分析
使用制备的纸基微流控芯片对随机选取的实际湖水样品进行检测,亚硝酸盐、硝酸盐和氨氮的检出值分别为0.008 mmol/L、14.79 mmol/L和1.50 mg/L。实际样本中三氮的加标回收实验结果(表1)表明,三氮的加标回收率均在95.4%~114.0%之间。与Lin等[17]将分光光度法和流动注入分析结合的方式相比,本方法成本低廉,无需借助大型仪器便可对检测结果进行读取。
4 结 论
设计和制备了基于显色反应的纸基微流控芯片,用于同时检测水中三氮的含量,亚硝酸盐、硝酸盐和氨氮的检出限分别为0.001 mmol/L、1 mmol/L和1 mg/L,实际样本3种含氮化合物的加标回收率在95.4%~114.9%之间。相比于现有的三氮化合物检测方法,本研究提出的纸基微流控芯片法有效简化了操作步骤,降低了成本,操作简单,无需借助大型仪器和专业的操作人员,有望用于资源匮乏的地区的水质监测。
References
1 Yu C Q,Huang X,Chen H,Godfray H C J,Wright J S,Hall J W,Gong P,Ni S Q,Qiao S C,Huang G R,Xiao Y C,Zhang J,Feng Z,Ju X T,Ciais P,Stenseth N C,Hessen D O,Sun Z L,Yu L,Cai W J,Fu H H,Huang X M,Zhang C,Liu H B,Taylor J. Nature,2019,567(7749): 516-520
2 Landrigan P J,Fuller R,Acosta N J R,Adeyi O,Arnold R,Basu N,Balde A B,Bertollini R,Bose-O′Reilly S,Boufford J I,Breysse P N,Chiles T,Mahidol C,Coll-Seck A M.,Cropper M L,Fobil J,Fuster V,Greenstone M,Haines A,Hanrahan D,Hunter D,Khare M,Krupnick A,Lanphear B,Lohani B,Martin K,Mathiasen K V,McTeer M A.,Murray C J L,Ndahimananjara J D,Perera F,Potocnik J,Preker A S,Ramesh J,Rockstrom J,Salinas C,Samson L D,Sandilya K,Sly P D,Smith K R,Steiner A,Stewart R B,Suk W A,van Schayck Onno C P,Yadama G N,Yumkella K,Zhong M. Lancet,2018,391(10119): 462-512
3 Zhu Z L,Guan X D,Zheng H T,Yang C,Xing Z,Hu S H. J. Anal. Atom. Spectrom.,2018,33(12): 2153-2159
4 Correa-Duarte M A,Perez N P,Guerrini L,Giannini V,Alvarez-Puebla R A.J. Phys. Chem. Lett.,2015,6(5): 868-874
5 Baciu A,Manea F,Pop A,Pode R,Schoonman L.Proc. Safety Environ. Protect.,2017,108: 18-25
6 Oh J W,Chung W J,Heo K,Jin H E,Lee B Y,Wang E,Zueger C,Wong W,Meyer J,Kim C,Lee S Y,Kim W G,Zemla M,Auer M,Hexemer A,Lee S W. Nat. Commun.,2014,5: 3043
7 Cho Y B,Jeong S H,Chun H,Kim Y S. Sens. Actuators B,2018,256: 167-175
8 Jin B R,Yang Y X,He R Y,Park Y I,Lee A,Bai D,Li F,Lu T J,Xu F,Lin M. Sens. Actuators B,2018,276: 48-56
9 You M L,Lin M,Gong Y,Wang S R,Li A,Ji L Y,Zhao H X,Ling K,Wen T,Huang Y,Gao D F,Ma Q,Wang T Z,Ma A Q,Li X L,Xu F. ACS Nano,2017,11(6): 6261-6270
10 Xia Y Y,Si J,Li Z Y. Biosens. Bioelectron.,2016,77: 774-789
11 Jayawardane B M,Wei S,McKelvie I D,Kolev S D. Anal. Chem.,2014,86(15): 7274-7279
12 GB 5749-2006,Standards for Drinking Water Quality. National Standards of the People′s Republic of China
生活飲用水卫生标准. 中华人民共和国国家标准. GB 5749-2006
13 Sun J,Zhang X J,Broderick M,Fein H. Sensors,2003,3(8): 276-284
14 Lau K T,Edwards S,Diamond D. Sens. Actuators B,2004,98(1): 12-17
15 GB/T 5009.33-1996,National Food Safety Standard Determination of Nitrite and Nitrate in Food. National Standards of the People′s Republic of China
食品中亚硝酸盐与硝酸盐的测定. 中华人民共和国国家标准. GB/T 5009.33—1996
16 Zheng X J,Liang R P,Li Z J,Zhang L,Qiu J D. Sens. Actuators B,2016,230: 314-319
17 Lin K N,Ma J,Yuan D X,Feng S C,Su H T,Huang Y M,Shanguan Q P. Talanta,2017,167: 166-171