滇重楼地上部分化学成分研究
2020-09-14陶俊杰闻晓东
陶俊杰,杨 杰,闻晓东
(中国药科大学中药学院,天然药物活性组分与药效国家重点实验室,南京211198)
重楼是百合科(Liliaceae)重楼属(Paris)植物的总称,共有26 个种及14 个变种,广泛分布于欧亚大陆的热带至温带地区。我国分布有其中的20个种及数个变种,主要集中在西南各省区。重楼属植物药用历史悠久,早在《神农本草经》中就有记载,主治疔疮痈肿、蛇虫咬伤、跌扑伤痛等症[1-4],是著名中成药云南白药、宫血宁胶囊的重要药物成分。现代药理研究表明,重楼所含有的甾体皂苷具有显著的止血作用[5-6]。滇重楼(Paris polyphyllavar. yunnanensis)是重楼药材的重要基源植物,各版药典均有收录,但由于长期掠夺式的采挖,缺乏保护,滇重楼的野生资源日益枯竭。与此同时,滇重楼每年都可再生的地上部分一直被认为是非药用部位而被丢弃。为了扩大滇重楼植物的药用资源,本研究对滇重楼地上部分的甾体皂苷类成分进行了研究,为充分利用重楼属植物资源提供科学依据。
从滇重楼地上部分90%乙醇提取物中共分离得到6 个甾体皂苷类化合物,利用MS、IR、UV、1D以及2D NMR 等波谱技术对其结构进行鉴定,分别为26-O-β-D-glucopyranosyl-kryptogenin-3-O-α-Lrhamnopyranosyl-(1→4)-α-L-rhamnopyranosyl-(1→4)-[α-L-rhamnopyranosyl-(1→2)]-β-D-glucopyranoside(1),dioseptemloside G(2),polyphylloside III(3),chonglouoside SL-19(4),protodioscin(5),chonglouoside SL-5(6)。其中化合物1 为新化合物,化合物2为首次从重楼属植物中分离得到。对以上6 个化合物进行促血小板聚集作用以及细胞毒性评价,结果发现:6 个化合物均未表现出明显的促血小板聚集作用;化合物2、4对于结肠癌细胞HT29具有较强的细胞毒性。
1 材 料
1.1 仪器与试剂
Tensor 27光谱仪、Bruker Avance DRX-500/600核磁共振光谱仪(德国Bruker 公司);Agilent 1100 series 高效液相色谱仪(美国Agilent 公司);Alltech 2000 ES 蒸发光散射检测器(美国Alltech 公司);R-100 旋转蒸发仪(瑞士Buchi 公司);LBY-NJ4 型血小板聚集仪(北京泰利康信公司);Multiskan FC 酶标仪、Forma 311 CO2细胞培养箱(美国赛默飞世尔公司);D101-大孔吸附树脂(沧州宝恩吸附材料科技有限公司);MCI-GEL 精细分离填料(日本三菱化学公司);ODS 柱色谱填料(日本YMC 公司);薄层色谱硅胶板GF254及柱色谱硅胶(青岛海洋化工有限公司)。
1.2 药 材
滇重楼药材于2017 年8 月采自云南腾冲地区,由中国药科大学中药分析系王强教授鉴定为百合科(Liliaceae)重楼属Paris植物滇重楼Paris.polyphyllavar.yunnanensis的地上部分。药材标本保存于中国药科大学中药分析系。
1.3 动物与细胞株
SPF 级KM 小鼠,雄性,体重(25±5)g,由南京青龙山动物繁殖中心提供,合格证号:SCXK(苏)2017-0001。人结肠癌细胞株HT29(上海中科院细胞库)。所有动物实验均符合动物伦理委员会标准。
2 提取与分离
滇重楼药材10 kg,用90%乙醇回流提取4 次,合并滤液,减压浓缩回收乙醇,浓缩至3 L,用水饱和正丁醇液萃取4 次,合并正丁醇液,减压回收正丁醇至干,得滇重楼地上部分正丁醇萃取部位。取该部位100 g 进行D-101 大孔树脂柱色谱分离(乙醇-水),得到乙醇30%、50%、70%及90% 4 个洗脱部位。70%和90%两个部位合并后进行硅胶柱色谱分离(二氯甲烷-甲醇20∶1→1∶1),洗脱液根据薄层色谱(TLC)检测结果合并、浓缩,共得到9个洗脱部位:1-9。取部位9(CM 3∶1)再进行硅胶柱色谱分离(二氯甲烷-甲醇,10∶1→1∶1),共得到5个洗脱部位:9-1-9-5,取部位9-4(CM 3∶1)进行MCI 柱色谱分离(甲醇-水20%→100%),收集甲醇30%、50%、70% 3 个洗脱部位,3 个部位再进一步经反相硅胶柱色谱反复分离(丙酮/甲醇-水),最后经过制备HPLC 纯化(乙腈-水),其中30%部位得到化合物1(27 mg)、3(13 mg)、4(28 mg),50%部位得到化合物5(42 mg),70%部位得到化合物2(17 mg)、6(9 mg)。化合物1~6的结构式见图1。
3 结构鉴定
化合物1 白色无定形粉末,HR-ESI-MSm/z1 191.579 8 [M-H]-(Calcd. for C57H91O26,1 191.573 3),确定化合物1 的分子式为C57H92O26,不饱和度为12。[α]-254.1°(c0.30,MeOH);UV(MeOH)λmax255(lgε3.22)nm;IR(KBr,ν):3 420,1 734,1 040 cm-1。13C NMR(C5D5N,150 MHz)共显示出57 个碳原子信号,其中包括5 组六碳糖单元信号和一组27个碳信号的苷元部分。结合1H NMR(600 MHz,C5D5N)以及HSQC 图谱分析发现,化合物1 的苷元部分具有4 个甲基结构[δH0.71(3H,s),δC13.7;δH1.07(3H,d,J= 6.0 Hz),δC16.5;δH1.02(3H,d,J= 6.5 Hz),δC18.3 以及δH1.07(3H,s),δC20.2],10 个亚甲基结构,2个羰基碳原子[δC214.6;219.2]以及一对双 键 碳 原 子[δC122.3,δH5.32(1H,m),δC141.7]。对比已知化合物anguivioside XV[7]苷元部分的波谱数据,确定化合物1 的苷元为kryptogenin(3α,26-dihydroxycholest-5-ene16,22-dione)。在1D NMR 以及HSQC 谱中,可以观察到5 个糖分子的端基碳信号及其对应的质子[δH4.92(1H,d,J= 6.2 Hz),δC101.0;δH6.39(1H,br. s),δC102.9;δH5.83(1H,br. s),δC103.0;δH6.28(1H,br. s),δC103.9;δH4.86(1H,d,J= 7.9 Hz),δC105.4],以及位于高场区的3 个糖链甲基碳及其对应的质子[δH1.60(1H,d,J=5.8 Hz),δC19.4;δH1.60(1H,d,J=5.6 Hz),δC19.6以及δH1.78(1H,d,J= 6.0 Hz),δC19.2],通过与已知化合物anguivioside XV 糖链部分比较,推测化合物1 的糖链由3 分子L-鼠李糖及2 分子D-葡萄糖构成,由葡萄糖分子端基氢的偶合常数确定葡萄糖分子端基碳的构型为β型,鼠李糖端基碳构型由其C-5 的化学位移确定为α型[8]。HMBC 谱中观察到δH6.28(Rha Ⅲ-H-1)与δC81.0(Rha Ⅱ-C-4)、δH5.83(Rha Ⅱ-H-1)与δC78.3(Glc Ⅰ-C-4)、δH6.39(Rha Ⅰ-H-1)与δC78.9(Glc Ⅰ-C-2)、δH4.92(GlcⅠ-H-1)与δC79.0(C-3)存在相关信号,说明RhaⅢ连接在Rha Ⅱ的4 位,Rha Ⅱ连接在Glc Ⅰ的4 位,Rha Ⅰ连接在Glc Ⅰ的2 位,Glc Ⅰ连接在苷元的3 位上;另外,δH4.86(Glc Ⅱ-H-1)与δC75.9(C-26)相关,表明Glc Ⅱ连接在苷元的26 位碳原子上。
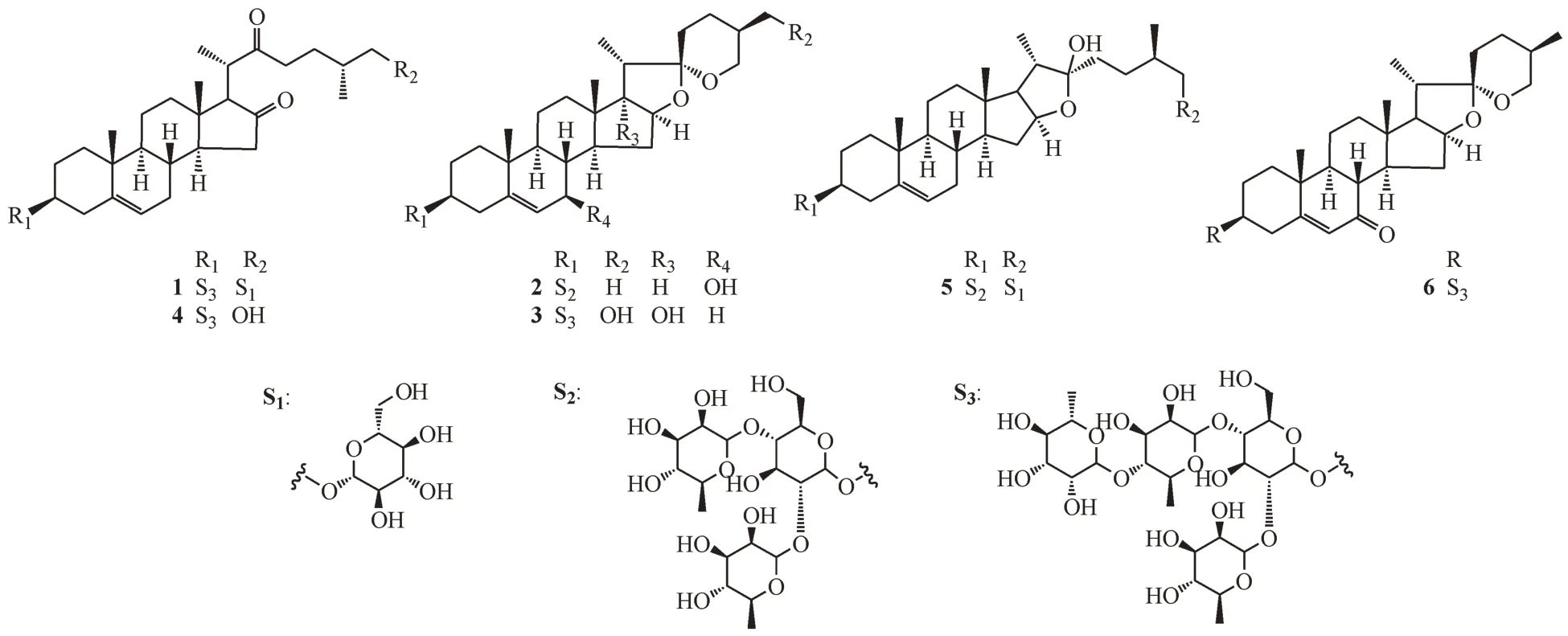
Figure 1 Chemical structures of compounds 1-6
其他HMBC、HSQC 以及1H-1H COSY 谱图(图2)进一步证实了对化合物1 的结构推测。综合上述分析,将化合物1 的结构鉴定为26-O-β-D-glucopyranosyl-kryptogenin-3-O-α-L-rhamnopyranosyl-(1-4)-α-L-rhamnopyranosyl-(1-4)-[α-L-rhamnopyranosyl-(1-2)]-β-D-glucopyranoside。 化 合 物1 的1H NMR和13C NMR波谱数据全归属见表1。
化合物2 白色无定形粉末,ESI-MS(m/z)907.4[M+Na]+,分 子 式C45H72O17。1H NMR(C5D5N,500 MHz)δ:0.71(3H,d,J=5.5 Hz,CH3-27),0.90(3H,s,CH3-18),1.04(3H,s,CH3-19),1.18(3H,d,J=7.0 Hz,CH3-21),1.65(3H,d,J=6.0 Hz,CH3-Rha I),1.77(3H,d,J=6.5 Hz,CH3-Rha II),4.99(1H,d,J= 7.2 Hz,Glc-H-1),5.87(1H,br.s,Rha II-H-1),6.40(1H,br. s,Rha I-H-l),5.71(1H,br. s,H-6);13C NMR(C5D5N,125 MHz)δ:37.78(C-1),30.45(C-2),78.37(C-3),39.06(C-4),141.92(C-5),129.20(C-6),73.03(C-7),41.30(C-8),49.11(C-9),37.58(C-10),21.70(C-11),40.39(C-12),41.46(C-13),56.87(C-14),35.69(C-15),82.11(C-16),63.03(C-17),16.88(C-18),19.32(C-19),42.55(C-20),15.58(C-21),109.67(C-22),32.25(C-23),29.76(C-24),31.11(C-25),67.31(C-26),17.79(C-27),Glc:100.78(C-1′),78.37(C-2′),78.37(C-3′),79.11(C-4′),77.40(C-5′),61.78(C-6′),Rha I:102.56(C-1″),72.98(C-2″),73.34(C-3″),74.61(C-4″),69.94(C-5″),18.97(C-6″),Rha II:103.39(C-1‴),72.98(C-2‴),73.13(C-3‴),74.40(C-4‴),70.90(C-5‴),19.10(C-6‴)。以上数据与文献报道[9]的数据基本一致,故化合物2鉴定为dioseptemloside G。
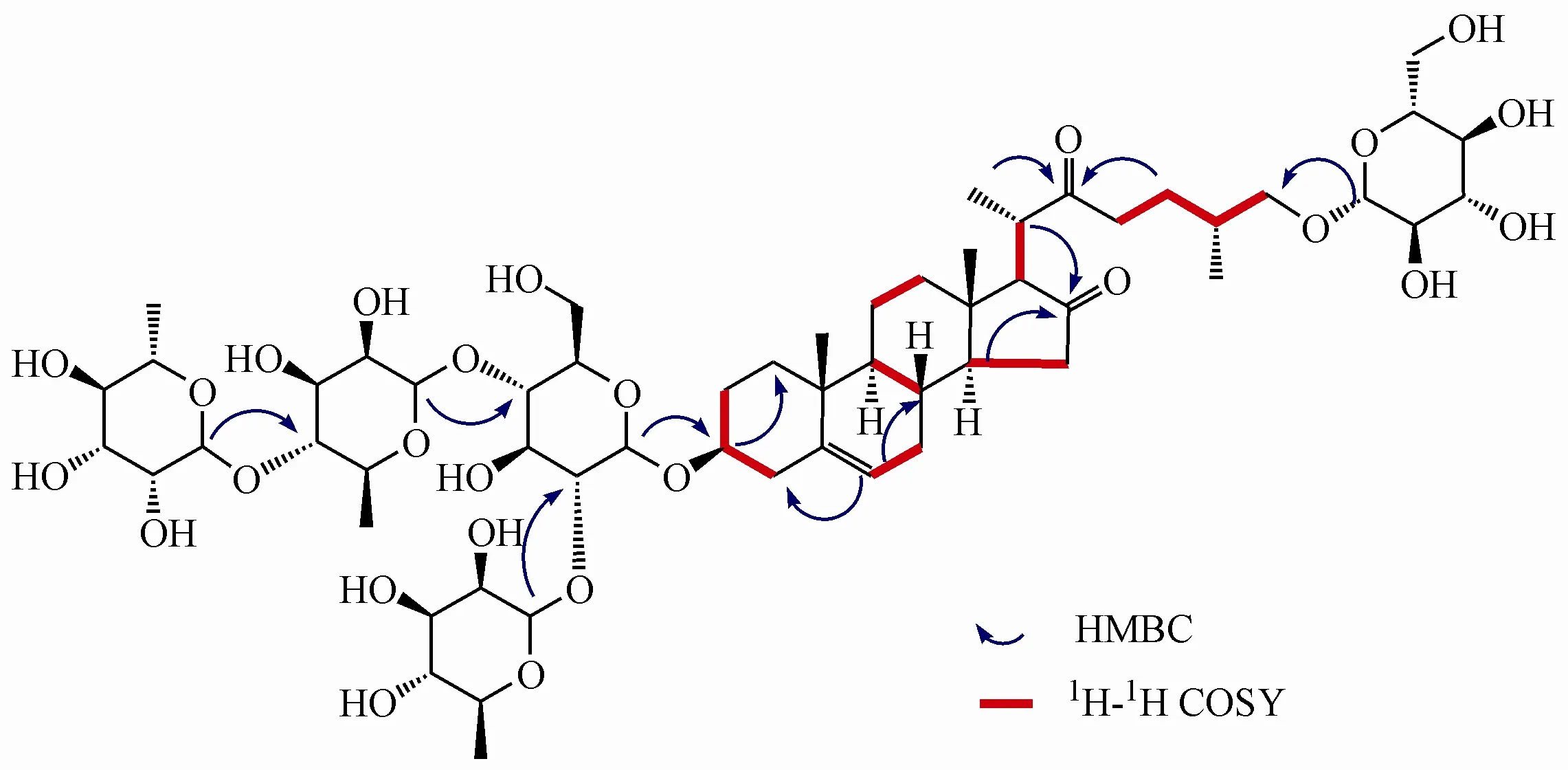
Figure 2 Key HMBC, 1H-1H COSY correlations of compound 1
化合物3 白色无定形粉末,ESI-MS(m/z)1 069.4[M+Na]+,分 子 式C51H82O22。1H NMR(C5D5N,500 MHz)δ:1.00(3H,s,CH3-18),1.11(3H,s,CH3-19),1.27(3H,d,J= 7.0 Hz,CH3-21),1.62(3H,d,J= 5.0 Hz,CH3-Rha I),1.62(3H,d,J= 5.5 Hz,CH3-Rha II),1.78(3H,d,J=6.0 Hz,CH3-Rha III),4.92(1H,br. s,Glc-H-1),5.83(1H,s,Rha II-H-1),6.28(1H,s,Rha III-H-1),6.39(1H,s,Rha I-H-l);13C NMR(C5D5N,125 MHz)δ:36.76(C-1),29.36(C-2),77.28(C-3),38.19(C-4),139.99(C-5),121.02(C-6),31.27(C-7),31.55(C-8),49.46(C-9),36.35(C-10),20.15(C-11),31.55(C-12),44.35(C-13),52.23(C-14),32.8(C-15),89.24(C-16),89.36(C-17),16.34(C-18),18.63(C-19),44.07(C-20),8.93(C-21),109.40(C-22),31.27(C-23),22.78(C-24),38.16(C-25),63.12(C-26),63.58(C-27),Glc:99.49(C-1′),79.56(C-2′),76.14(C-3′),77.28(C-4′),76.91(C-5′),60.42(C-6′),Rha I:101.35(C-1″),72.08(C-2″),71.67(C-3″),73.31(C-4″),68.73(C-5″),17.58(C-6″),Rha II:101.42(C-1‴),72.44(C-2‴),72.01(C-3‴),77.20(C-4‴),67.53(C-5‴),17.80(C-6‴),Rha III:102.46(C-1),72.00(C-2),71.80(C-3),73.18(C-4),69.58(C-5),18.04(C-6)。以上数据与文献报道[10]的数据基本一致,故化合物3鉴定为polyphylloside III。
化合物4 白色无定形粉末,ESI-MS(m/z)1 053.2[M+Na]+,分 子 式C51H82O21。1H NMR(C5D5N,500 MHz)δ:0.73(3H,s,CH3-18),1.08(3H,d,J= 8.0 Hz,CH3-21),1.09(3H,s,CH3-19),1.14(3H,d,J= 7.0 Hz,CH3-27),1.62(3H,d,J= 3.0 Hz,CH3-Rha I),1.62(3H,d,J=3.0 Hz,CH3-Rha II),1.79(3H,d,J=6.0 Hz,CH3-Rha III),4.97(1H,d,J=6.0 Hz,Glc-H-1),5.84(1H,s,Rha II-H-1),6.29(1H,s,Rha III-H-1),6.40(1H,s,Rha I-H-l);13C NMR(C5D5N,125 MHz)δ:37.25(C-1),30.16(C-2),78.07(C-3),38.97(C-4),140.97(C-5),121.48(C-6),32.00(C-7),31.04(C-8),50.05(C-9),37.10(C-10),20.78(C-11),38.72(C-12),41.72(C-13),51.18(C-14),37.44(C-15),217.69(C-16),66.42(C-17),12.88(C-18),19.41(C-19),43.79(C-20),15.64(C-21),213.28(C-22),40.41(C-23),27.69(C-24),36.22(C-25),67.48(C-26),17.28(C-27),Glc:100.40(C-1′),78.05(C-2′),77.91(C-3′),77.76(C-4′),77.04(C-5′),61.32(C-6′),Rha I:102.21(C-1″),72.52(C-2″),72.88
(C-3″),74.17(C-4″),69.57(C-5″),18.44(C-6″),Rha II:102.28(C-1‴),72.88(C-2‴),73.30(C-3‴),80.42(C-4‴),68.39(C-5‴),18.67(C-6‴),Rha III:103.32(C-1),72.66(C-2),72.94(C-3),74.03(C-4),70.43(C-5),18.90(C-6)。以上数据与文献报道的数据[11]基本一致,故化合物4 鉴定为chonglouoside SL-19。
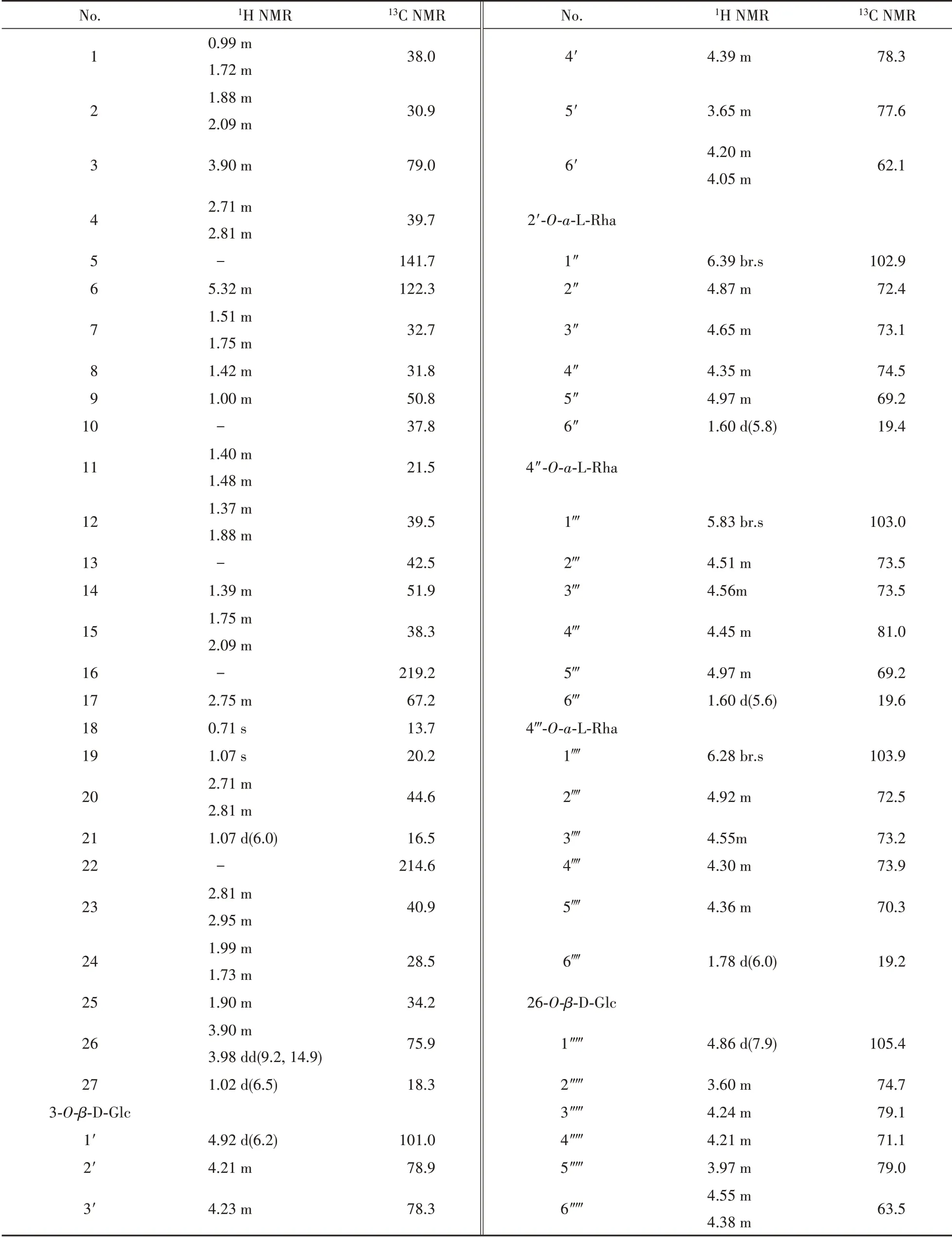
Table 1 1H NMR(600 MHz,C5D5N)and 13C NMR(150 MHz,C5D5N)spectral data of compound 1(J in Hz)
化合物5 白色无定形粉末,ESI-MS(m/z)1 071.5[M+Na]+,分 子 式C51H84O22。1H NMR(C5D5N,500 MHz)δ:0.88(3H,s,CH3-18),1.01(3H,d,J=7.0 Hz,CH3-27),1.07(3H,s,CH3-19),1.35(3H,d,J= 7.0 Hz,CH3-21),1.65(3H,d,J= 6.0. Hz,CH3-Rha I),1.78(3H,d,J=6.0 Hz,CH3-Rha II),4.83(1H,d,J= 8.0 Hz,Glc I-H-1),4.93(1H,d,J= 7.0 Hz,Glc II-H-1),5.88(1H,s,Rha II-H-1),6.42(1H,s,Rha I-H-l),5.32(1H,br. s,H-6);13C NMR(C5D5N,125 MHz)δ:38.00(C-1),30.66(C-2),78.26(C-3),39.48(C-4),141.27(C-5),122.31(C-6),32.83(C-7),32.17(C-8),50.85(C-9),37.62(C-10),21.59(C-11),40.42(C-12),41.27(C-13),57.08(C-14),32.95(C-15),81.58(C-16),64.34(C-17),16.92(C-18),19.88(C-19),41.47(C-20),16.94(C-21),111.14(C-22),37.62(C-23),28.84(C-24),34.77(C-25),75.69(C-26),17.95(C-27),Glc I:100.79(C-1′),78.61(C-2′),77.41(C-3′),79.10(C-4′),78.26(C-5′),61.78(C-6′),Rha I:102.49(C-1″),73.01(C-2″),73.03(C-3″),74.62(C-4″),69.99(C-5″),18.97(C-6″),Rha II:103.39(C-1‴),73.01(C-2‴),73.21(C-3‴),74.40(C-4‴),70.90(C-5‴),19.11(C-6‴),Glc II:105.43(C-1),75.74(C-2),78.96(C-3),72.20(C-4),78.44(C-5),63.32(C-6)。以上数据与文献报道的数据[12]基本一致,故化合物5鉴定为protodioscin。
化合物6 白色无定形粉末,ESI-MS(m/z)1 051.4[M+Na]+,分 子 式C51H80O21。1H NMR(C5D5N,500 MHz)δ:0.69(3H,d,J= 5.0 Hz,CH3-27),0.86(3H,s,CH3-18),1.13(3H,s,CH3-19),1.15(3H,d,J=5.5 Hz,CH3-21),1.63(3H,d,J= 4.0 Hz,CH3-Rha II),1.63(3H,d,J=4.0 Hz,CH3-Rha I),1.78(3H,d,J=4.5 Hz,CH3-Rha III),4.92(1H,br. s,Glc-H-1),5.78(1H,br.s,H-6),5.87(1H,s,Rha II-H-1),6.32(1H,s,Rha III-H-1),6.46(1H,s,Rha I-H-l);13C NMR(C5D5N,125 MHz)δ:36.91(C-1),30.22(C-2),77.60(C-3),39.31(C-4),165.66(C-5),126.75(C-6),201.48(C-7),45.48(C-8),50.28(C-9),39.18(C-10),21.57(C-11),39.18(C-12),41.65(C-13),50.46(C-14),34.84(C-15),81.81(C-16),62.36(C-17),16.93(C-18),17.53(C-19),42.40(C-20),15.61(C-21),109.76(C-22),32.29(C-23),29.70(C-24),31.06(C-25),67.26(C-26),17.77(C-27),Glc:101.05(C-1′),78.14(C-2′),78.04(C-3′),78.06(C-4′),77.49(C-5′),61.70(C-6′),Rha I:102.52(C-1″),72.95(C-2″),73.28(C-3″),74.58(C-4″),70.02(C-5″),19.12(C-6″),Rha II:102.72(C-1‴),73.34(C-2‴),73.78(C-3‴),80.88(C-4‴),68.82(C-5‴),19.37(C-6‴),Rha III:103.82(C-1),73.14(C-2),73.34(C-3),74.49(C-4),70.92(C-5),18.92(C-6)。以上数据与文献报道的数据[13]基本一致,故化合物6 鉴定为chonglouoside SL-5。
4 生物活性检测
4.1 促血小板聚集活性检测
血小板聚集的浊度测量参考Sun 等[14]的方法及仪器操作手册。用3.8%柠檬酸钠溶液抗凝,下腔静脉穿刺取小鼠血液。血液采集后用水平离心机500 r/min 转速离心5 min,待自然停止后取出,获得富血小板血浆(PRP),小心吸取上层富含血小板血浆后,将剩余的血液3 000 r/min 转速离心10 min,待自然停止后取出,获得血小板缺乏血浆(PPP),离心温度维持在22 ℃。对PRP 中的血小板进行计数后用生理盐水进行调整,将血小板浓度稀释到每升2×1011个。血小板聚集试验在制备PRP后3 h内完成。
在测定样品方杯中加入1 个小磁棒和PRP 300µL,置恒温孔中预热5 min,待仪器扣除背景且示数稳定后,用微量进样器吸取待测样品5 µL 加入杯底,记录血小板聚集引起的光密度变化。聚合的程度是根据透光率的最大增加百分比来估计的,血小板缺乏血浆表示100%的透光率。以生理盐水为空白对照,以重楼皂苷Ⅶ为阳性对照。
4.2 细胞毒性检测
取单层培养的HT29 细胞,用含10%胎牛血清的DMEM 培养基配成每毫升5×104个细胞悬液后接种于96 孔板(每孔100µL),于37 ℃、5% CO2及饱和湿度的条件下静置24 h,待细胞贴壁后分别加入不同浓度(1,5,10,25,50,100 µmol/L)的化合物1~6 及阳性药顺铂,并设空白组,同样培养条件下培养48 h 后,每孔加入MTT(5 mg/L)20µL 作用3 h,加入DMSO 溶解形成的蓝紫色结晶,并于492 nm 波长测定各孔细胞吸收度,并计算IC50。实验重复3次。
4.3 生物活性测定结果
采用血小板聚集仪对已经分离鉴定的6 个化合物进行促血小板聚集活性评价。研究结果表明,与空白对照组血小板最大聚集率(33.06%)相比,在20 mmol/L 浓度下,化合物1(31.93%)、2(33.34%)、3(30.28%)、4(31.26%)、5(34.19%)、6(36.16%)均未显示出明显的促进血小板聚集的作用;在相同浓度下,阳性对照重楼皂苷Ⅶ血小板最大聚集率为63%。
采用MTT 比色法对已分离鉴定的6 个化合物进行细胞毒性评价。研究结果表明,化合物2[IC50(6.215±1.016)µmol/L]、化合物4[IC50(17.750±1.304)µmol/L]对于人结肠癌HT29 细胞具有较强的细胞毒性,且化合物2的细胞毒性强于阳性药顺铂[IC50(11.145 ± 1.109)µmol/L]。其他4 个化合物的IC50超过100µmol/L,因此认为对该细胞株没有明显的细胞毒性。
5 结果与讨论
本研究对滇重楼(Paris. polyphyllavar.yunnanensis)地上部分的化学成分进行了初步研究,分离并鉴定了6 个化合物,其中包括1 个新化合物。同时发现分离得到的化合物2 和4 对HT29 细胞具有较强的细胞毒性,具有进一步研究的价值。本研究结果丰富了滇重楼的化学库,为其药用价值的开发利用提供了研究基础。但本研究对滇重楼地上部分的成分分离还不够全面,药理活性研究不够深入,亟待后续的进一步研究。
