全程营养支持治疗对局部晚期鼻咽癌患者营养状况的影响
2020-09-11
0 引言
鼻咽癌(nasopharyngeal carcinoma,NPC)由于早期症状不明显,缺乏特异性,大部分鼻咽癌患者确诊时已处于局部中晚期[1]。目前,诱导化疗继之同步放化疗是局部晚期鼻咽癌的首选根治性治疗方式,可明显提高局部控制率,降低远处转移率[2-3]。放疗会引起患者味觉障碍、吞咽困难、口腔黏膜炎等不良反应,联合化疗时出现食欲下降、恶心呕吐等胃肠道反应,易导致患者进食困难、摄入减少,进而发生体重丢失和营养不良,严重影响患者放化疗疗效、生存质量和预后[4-6]。既往研究[7-9]表明,营养支持治疗是改善鼻咽癌患者营养状况的有效方法,针对肠胃功能正常的鼻咽癌患者,口服营养补充(oral nutritional supplements,ONS)是国内外营养治疗指南共识[10-11]推荐的首选肠内营养途径。但目前针对局部晚期鼻咽癌患者营养支持治疗的研究报道较少。本研究拟联合运用患者主观整体营养评估量表(patientgenerated subjective global assessment,PG-SGA)、体格测量、血液学指标和急性放射反应进行全面的营养评估,探讨全程营养支持治疗对局部晚期鼻咽癌患者放化疗期间营养状况的影响,以期为患者制订和优化更为科学合理的营养支持方案 。
1 资料与方法
1.1 一般资料
选取2018年10月—2019年10月湖北省肿瘤医院放疗科收治的90例初治局部晚期鼻咽癌患者为研究对象,采用随机数字表法将患者分为实验组45例(全程营养支持治疗+同步放化疗)、对照组45例(同步放化疗)。纳入标准:(1)经病理学确诊为鼻咽非角化性癌,未分化型;(2)影像学临床分期为T3和(或)N2及以上;(3)年龄18~70岁;(4)ECOG体力状况0~1分;(5)未进行过放疗、化疗、靶向药物等治疗;(6)肝肾功能正常;(7)预计生存期≥3月;(8)签署知情同意书。排除标准:(1)合并其他恶性肿瘤;(2)确诊时已发生远处转移;(3)依从性差,不能配合PG-SGA评估和养支持治疗。
1.2 治疗方法
1.2.1 全身化疗及放射治疗 90例患者均采用诱导化疗+同步放化疗的治疗方式。诱导化疗为含铂两药方案,顺铂+氟尿嘧啶或顺铂+多西他赛,以3周为一周期,诱导化疗为2~3周期。同步化疗药物均为顺铂,顺铂30~40 mg/m2,每周方案,或顺铂100 mg/m2,3周方案。
放射治疗采用容积旋转调强(VMAT)或调强放疗(IMRT)。处方剂量:肿瘤原发病灶及阳性淋巴结(gross tumor volume,GTV)69.3~72.6 Gy,肿瘤亚临床区域(clinical target volume,CTV)56.1~59.4 Gy,淋巴结引流区临床靶区(clinical target volume of lymph nodes,CTVln)52.8~56.1Gy,分割33次,1次/日,5次/周。治疗在6~7周内完成。根据RTOG 0225要求设定危及器官(OAR)的限制剂量。
1.2.2 全程营养支持治疗 自放疗开始前至放疗结束始终采用口服营养补充定义为全程营养支持[7,12]。实验组放疗前3天开始全程营养支持治疗,口服营养补充制剂采用肠内营养粉剂(能全素,320 克/罐,纽迪希亚制药生产)。营养治疗指南和专家共识[11,13]均推荐肿瘤患者每日目标能量需要量为25~30 kcal/kg,具体实施根据患者进食情况适时调整营养制剂用量。营养师全程参与实验组患者的营养支持治疗,并进行营养咨询和饮食指导。对照组患者常规方式处理,出现严重放化疗相关不良反应时给予对症支持治疗。
1.3 观察指标
1.3.1 体格测量 包括身高、体重和体质指数(body mass index,BMI)。
1.3.2 血液学检查 主要包括总蛋白(total protein,TP)、白蛋白(albumin,ALB)、前白蛋白(prealbumin,PA)、尿素氮(blood urea nitrogen,BUN)、肌酐(Creatinine,Cr)和血红蛋白(hemoglobin,Hb)。
1.3.3 营养评估 采用患者主观整体评价法(PGSGA)。PG-SGA是美国营养师协会及中国抗癌协会肿瘤营养与支持治疗专业委员会推荐用于肿瘤患者营养评估的首选方法[13]。根据患者PG-SGA评分分为:0~1分为营养良好;2~3分为可疑营养不良;4~8分为中度营养不良;≥9分为重度营养不良。
1.3.4 急性放射反应 根据美国肿瘤放射治疗协作组(radiation therapy oncology group,RTOG)急性放射损伤分级标准评价患者不良反应。主要包括放射性皮炎、骨髓抑制、口腔黏膜炎、吞咽困难或疼痛和口干燥症等。
1.3.5 观察和评估时间点 放疗前、放疗第2周、放疗第4周、放疗结束。
1.4 统计学方法
应用SPSS22.0进行数据分析。计数资料采用χ2检验,计量资料采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 基本情况
两组患者基本临床资料差异均无统计学意义(P>0.05),见表1。
2.2 体重和BMI
同步放化疗期间,两组患者体重均有不同程度下降,放疗结束后实验组下降均值为3.61±0.35 kg,对照组下降均值为7.62±0.37 kg,差异有统计学意义(P<0.001)。实验组放疗各时间点(放疗2周、4周和放疗结束)的体重较放疗前无明显变化(P=0.873、P=0.232、P=0.065);对照组体重呈进行性下降,放疗第4周后体重明显低于放疗前(P=0.015)。对照组放疗第4周后体重下降程度显著高于实验组(P=0.000),放疗结束后体重下降10%以上的患者比例高达71.1%,见表2。以BMI判断患者同步放化疗期间的营养状况,结果显示,两组患者BMI均有下降,对照组放疗第4周后BMI下降程度显著高于实验组(P=0.048),放疗结束后对照组BMI<18.5 kg/m2的患者比例达28.9%,见表3。

表1 两组患者基本临床资料比较 (n(%))Table 1 Comparison of clinical characteristics of NPC patients between two groups (n(%))

表2 两组患者的体重下降比较 (n(%))Table 2 Comparison of weight loss between two groups (n(%))

表3 两组患者的BMI变化比较 (n(%))Table 3 Comparison of BMI between two groups (n(%))
2.3 血液学指标
同步放化疗期间,除尿素氮、肌酐外,两组患者营养相关血液学指标均进行性下降,放疗第4周后,总蛋白、白蛋白、前白蛋白和血红蛋白均明显低于放疗前(P=0.000、P=0.000、P=0.000、P=0.031);其中对照组的前白蛋白、血红蛋白在放疗第2周后已显著低于放疗前(P=0.025、P=0.000),较实验组下降更早,较其他指标更敏感。放疗第4周后,对照组的总蛋白、白蛋白和前白蛋白均明显低于实验组(P=0.000、P=0.000、P=0.001),其中血红蛋白在放疗第2周后已显著低于实验组(P=0.001),放疗结束后对照组贫血发生率(64.4%(29/45))明显高于实验组(31.1%(14/15))(P=0.002),见表4。
2.4 营养状况评估
同步放化疗期间,两组患者PG-SGA评分均呈升高趋势,放疗第2周后,两组PG-SGA评分均明显高于放疗前(P=0.000),放疗第2周后、第4周后及放疗结束对照组PG-SGA评分(8.7分、11.3分、14.0分)均明显高于实验组(6.8分、9.2分、11.2分),两组比较差异有统计学意义(P=0.000),见表4、图1。

图1 两组患者PG-SGA评分Figure 1 PG-SGA scores of two groups
两组患者PG-SGA评分在同步放化疗过程中呈动态变化,重度营养不良(≥9分)患者比例逐渐增加;放疗第2、4周后及放疗结束,对照组重度营养不良患者比例(60.0%、82.2%、91.1%)均显著高于实验组(22.2%、60.0%、75.6%),两组比较差异有统计学意义(P=0.001、P=0.020、P=0.048),见图2。
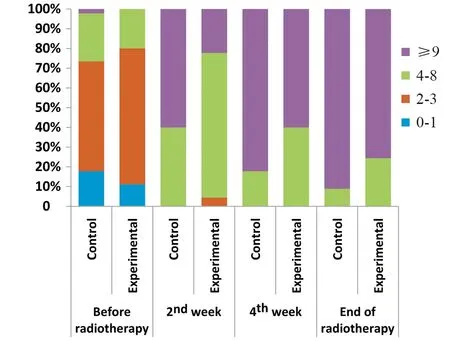
图2 两组患者PG-SGA评分分布Figure 2 Distribution of PG-SGA scores of two groups
2.5 急性放射反应
两组患者放疗期间均出现不同程度的急性放射反应。放射性皮炎和口腔干燥症在两组间差异无统计学意义(P=0.617、P=0.206)。对照组骨髓抑制、口腔黏膜炎、吞咽困难或疼痛的分级程度均显著高于实验组(P=0.009、P=0.005、P=0.002)。Ⅱ级以上骨髓抑制、口腔黏膜炎、吞咽困难或疼痛在对照组和实验组的发生率分别为:62.3%、91.1%、86.7%和28.9%、77.7%、71.1%,见表5。
表4 两组患者营养相关指标的变化比较 ()Table 4 Comparison of nutritional indexes between two groups ()
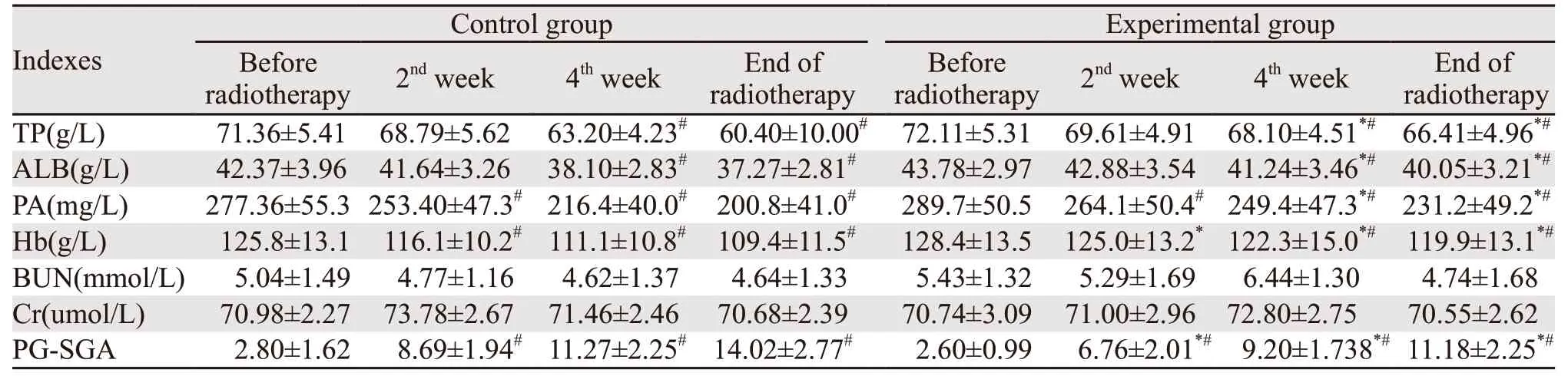
表4 两组患者营养相关指标的变化比较 ()Table 4 Comparison of nutritional indexes between two groups ()
Notes:*:P<0.05,compared with Control group; #:P<0.05,compared with the indexes before radiotherapy; TP:total protein; ALB:albumin; PA:prealbumin; Hb:hemoglobin; BUN:blood urea nitrogen; Cr:Creatinine.
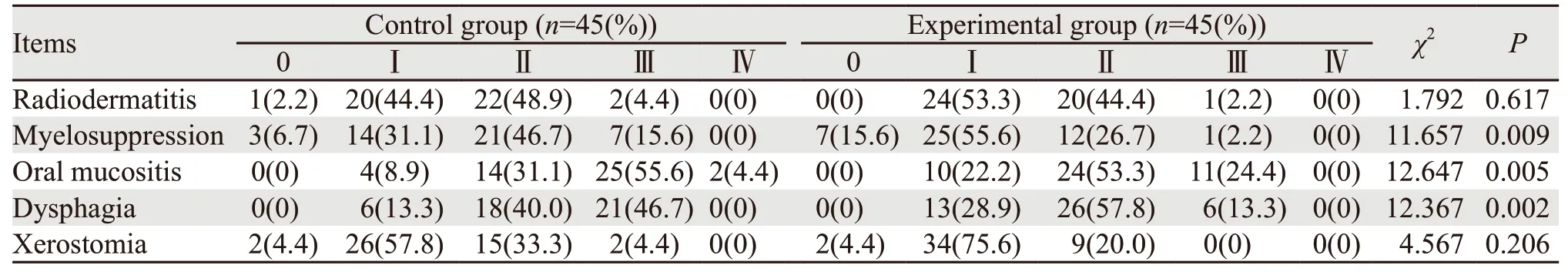
表5 两组患者急性放射反应 (n(%))Table 5 Comparison of acute radiation reaction between two groups (n(%))
3 讨论
局部晚期鼻咽癌患者营养不良的发生是肿瘤本身、放化疗及患者自身等多种因素共同作用的结果。诱导化疗+同步放化疗是目前局部晚期鼻咽癌的标准治疗方案,但在提高患者疗效的同时也增加了口腔黏膜炎、吞咽困难、胃肠道反应、骨髓抑制等不良反应,以至患者进食减少,在消耗增加和摄入减少的双重作用下导致营养不良。严重的营养不良会加剧放化疗不良反应,影响治疗耐受性和疗效,延长住院时间,影响患者生活质量和总生存[8,14-15]。因此,为改善局部晚期鼻咽癌患者放化疗期间的营养状况,对其进行合理的营养支持是十分有必要的。营养支持治疗已成为鼻咽癌多学科诊疗的重要组成部分,也得到越来越多临床医师的重视。
目前,肿瘤患者营养评估主要采用主观问卷调查、体格检查、人体测量和实验室检查四大类,但营养不良的诊断尚无统一标准。运用单一指标虽操作简便,但敏感度较低,存在一定的局限性[16]。本研究联合运用患者PG-SGA评分、体格测量、血液学指标和急性放射反应对患者营养状况进行准确、全面的评估。
多个营养治疗指南[5-6,13]推荐鼻咽癌放化疗患者的营养支持治疗应遵循五阶梯治疗原则[17],首先选择营养教育,然后依次向上晋级选择口服营养补充、全肠内营养、部分肠外营养、全肠外营养。当下一阶梯不能满足60%目标能量需求3~5天时,应该选择上一阶梯。口服营养补充(ONS)是肠胃功能正常放化疗患者首选的营养支持治疗方法,其接近于患者自然的进食过程,具有良好的依从性。
当患者胃肠道功能不全或功能障碍时,可选择鼻胃/肠管(NGT/NIT)、经皮内镜下胃/空肠造瘘术(PEG/PEJ)和外科手术胃/空肠造瘘。不推荐放疗患者常规使用肠外营养[10,18]。
体重下降是肿瘤患者营养不良最主要的临床特征,BMI能简单、有效地评估患者营养状况的变化。本研究显示,两组患者体重和BMI均有不同程度下降,尤以对照组下降明显,放疗结束后对照组体重下降≥10%和BMI<18.5 kg/m2的患者比例分别高达71.1%和28.9%;放疗第4周后,对照组体重明显低于放疗前,体重和BMI下降程度显著高于实验组。这与曹远东、崔巍等[7,19]研究中第4周后鼻咽癌患者体重下降程度最为明显结果相一致,提示全程营养支持治疗能在一定程度上有效抑制患者体重和BMI下降,维持和改善患者体重是保证疗效的重要基础。
白蛋白、前白蛋白、血红蛋白等血液学指标常作为临床上评价患者营养状况的客观指标,可从不同方面反映患者的营养状况[20]。本研究发现,两组患者TP、ALB、PA和Hb均呈进行性下降,于放疗第4周后下降明显,尤以对照组下降显著。其中对照组PA、Hb在放疗第2周已明显下降,且Hb也明显低于实验组。结果与苏瑞玉、潘海卿[21-22]等研究结果相似,可见局部晚期鼻咽癌患者同步放化疗期间营养相关血液学指标下降明显,PA和Hb下降较其他指标更为敏感,Pan等[23]也发现,PA用于评估患者营养状况的敏感度比ALB更高,考虑与ALB半衰期较长、易受其他因素影响有关。提示全程营养支持治疗可减缓血液学指标的下降,应密切监测患者放化疗期间血液学指标的变化,为患者营养状况评估提供依据。
PG-SGA是多个营养治疗专家共识[13,18]推荐的专门针对肿瘤患者设计的特异性营养评估工具。本研究发现,两组患者PG-SGA评分呈升高趋势,放疗第2周开始急剧上升,放疗结束达到最高,与丁慧萍[9]等研究一致。对照组放疗第2周后的PGSGA评分及重度营养不良(≥9分)比例均显著高于实验组。对照组和实验组放疗结束后的PG-SGA评分为14.0分和11.2分,重度营养不良(≥9分)发生率为91.1%和75.6%。由此可见,局部晚期鼻咽癌患者同步放化疗期间营养不良发生率和严重程度较高,全程营养支持治疗可改善患者营养状况,降低一定比例的重度营养不良(≥9分)。
既往研究[21,24]显示,鼻咽癌患者放疗2~4周时出现严重的口腔黏膜炎反应,进食困难、体重丢失也最明显,Ⅱ级以上急性黏膜炎发生率约63%~83%。本研究发现,两组患者放疗期间均出现不同程度的急性放射反应,放疗第2周后开始显著上升,其中对照组骨髓抑制、口腔黏膜炎、吞咽困难或疼痛的分级程度明显高于实验组,与患者营养状况变化表现一致。随着放射剂量的增加,黏膜炎和吞咽困难程度进一步加重,导致患者摄入减少,加剧了营养不良的发生,营养不良反过来又会加重放化疗不良反应,产生恶性循环,影响治疗效果[25-26]。提示全程营养支持可降低急性放射反应发生率及其分级,改善患者营养不良状态,应尽早预防、对症处理,减轻机体组织的放射性损伤。
综上所述,局部晚期鼻咽癌患者同步放化疗期间营养不良发生率高,急性放射反应较重。全程营养支持治疗可明显减少患者体重下降,减缓营养相关血液学指标的持续降低,减轻急性放射反应,对预防和改善患者营养不良具有重要意义,且因其方便易行、经济实用,值得临床推广。临床工作中我们应综合运用多种营养评估方法,及时发现患者营养不良,尽早实施合理有效的全程营养支持治疗。
本研究的不足之处在于:(1)病例样本量较小,且患者同步放化疗期间营养状况影响因素众多。在优化营养治疗方案的基础上,有待进一步大样本的随机对照研究证实。(2)观察时间较短,对于全程营养支持是否能有生存获益,也需进一步的随访研究。
