油茶皂苷的制备及提纯工艺研究
2020-09-10张向杰陈塨李晴川傅晓东
张向杰 陈塨 李晴川 傅晓东


摘要:为研究油茶皂苷的制备及提纯工艺,为中试化生产提供科学的技术支撑,通过正交试验得到最佳工艺为乙醇体积分数75%,料液比1∶2,提取时间120 min,提取温度60 ℃,得到纯度为55.65%的油茶皂苷粗品,得率16.12%。油茶皂苷粗品配置成质量分数3%水溶液,加入10%体积的1%壳聚糖絮凝剂絮,经凝沉、淀除去杂质,澄清液经AB-8型大孔树脂吸附90 min,用质量分数2%氢氧化钠溶液洗脱杂质,再用体积分数70%乙醇溶液洗脱油茶皂苷,将洗脱液旋转蒸发,除去乙醇并烘干,即得到纯度85.36%的油茶皂苷。
关键词:油茶皂苷;茶粕浸提;壳聚糖絮凝剂;AB-8型树脂吸附
中图分类号:TQ461 文献标志码:A doi:10.16693/j.cnki.1671-9646(X).2020.02.042
Abstract:In order to study the preparation and purification technology of Camellia saponin and provide scientific technical support for production. Through orthogonal test,the best technology was obtained as follows:ethanol concentration 75%,ratio of material to liquid 1∶2,extraction time 120 min,extraction temperature 60 ℃. The purity of crude Camellia saponin 55.65%,and the yield 16.12%. The crude product of Camellia saponin was prepared into 3% aqueous solution,10% volume of 1% chitosan flocculant was added to flocculate and precipitate to remove impurities. The clarification solution was adsorbed by AB-8 macroporous resin for 90 min,eluted with 2% sodium hydroxide solution,eluted with 70% ethanol solution,and the eluent was rotated and evaporated to remove ethanol and dried to obtain 85.36% Camellia saponin.
Key words:Camellia saponin;extraction of tea seed meal;chitosan flocculant;AB-8 resin adsorption
0 引言
油茶(Camellia oleifera Abel)属于山茶科(Thea- ceae)山茶属(Camellia)植物,是我国特有的木本食用油料树种。油茶皂苷(即茶皂素)是从油茶饼粕中提取的五环三萜类化合物,其基本结构是皂苷元、糖体及有机酸,具有优良的乳化性、发泡性、持泡性,同时也具有抗菌、抗炎、溶血等生物活性,可用于日用化工、建材、水产养殖、医药等行业[1-5]。
由于油茶饼粕中成分复杂,除含有丰富的油茶皂苷外,还含有大量的蛋白质、黄酮、单宁、多糖、色素等物质,这给油茶皂苷的提取和纯化造成了较大的困难,传统工艺制取的油茶皂苷产品往往纯度较低,颜色深,溶于水时易产生糊状,严重限制了其应用范围[6-7]。因此,研究可行的油茶皂苷的制备及提纯工艺,以期为中试化生产提供科学的技术支撑。
1 材料与方法
1.1 材料与仪器
油茶饼粕,江西久晟油茶发展有限公司提供;油茶皂苷标准品,上海晶纯实业有限公司提供;壳聚糖絮凝剂,国药集团化学试剂有限公司提供;AB-8型大孔吸附树脂,上海昕沪实验设备有限公司提供;无水乙醇、浓硫酸、香草醛、氫氧化钠,均为分析纯。
索氏提取器,浙江赛因科学仪器有限公司产品;紫外-可见分光光度计,上海分析仪器厂产品;旋转蒸发仪,浙江蓝箭仪器有限公司产品。
1.2 试验方法
1.2.1 油茶皂苷制备及提纯工艺流程
将压榨后的油茶饼粕粉碎,用乙醇溶液加热回流浸提烘干得油茶皂苷粗品,油茶皂苷粗品配置成水溶液,加入壳聚糖絮凝剂絮凝沉淀除去杂质,将提纯后的澄清液经AB-8型大孔树脂吸附,用氢氧化钠溶液洗脱杂质,再用乙醇溶液洗脱油茶皂苷,将洗脱液旋转蒸发除去乙醇并烘干,即得到高纯度油茶皂苷。
1.2.2 油茶皂苷含量测定
试验采用香草醛-浓硫酸比色法[8-11]。准确称 取油茶皂苷标准品100.0 mg,用80%乙醇溶液溶于50 mL容量瓶中,定容、摇匀,即得标准溶液。分别取油茶皂苷标准溶液0.1,0.2,0.3,0.4,0.5 mL,加甲醇定容至0.5 mL,加入8%香草醛溶液0.5 mL,于冰水浴中加入质量分数77%硫酸溶液4 mL,以试剂为空白,摇匀,于60 ℃下加热15 min,置于冰水浴中冷却10 min,取出放置室温下,于波长452 nm处测定吸光度,并以吸光度对浓度值绘制标准曲线。
油茶皂苷试样的测定:分别称取试样50.0 mg左右,用体积分数80%乙醇定容至25 mL,取1.0 mL。测定吸光度,代入相应回归方程,根据标准曲线计算皂苷质量分数。
2 结果与分析
2.1 油茶皂苷標准曲线绘制
油茶皂苷标准品在紫外-可见分光光度计上扫描所得的最大吸收波长为452 nm。在452 nm处测定不同质量浓度标准溶液的吸光度,以油茶皂苷质量浓度(X)为横坐标,吸光度(Y)为纵坐标绘制标准曲线,建立回归方程Y=6.495X+0.035 1,R2=0.998 9。
油茶皂苷标准曲线见图1。
2.2 油茶皂苷提取工艺的优化
油茶皂苷粗品是将油茶饼粕粉碎,用乙醇溶液加热回流浸提干燥所得[12-14]。考虑到各个因素之间的相互影响,试验以乙醇体积分数、料液比、浸出时间、浸出温度为因素,以油茶皂苷得率为指标,在单因素试验的基础上,设计L9(34)正交试验,考查油茶皂苷提取的最佳工艺条件。
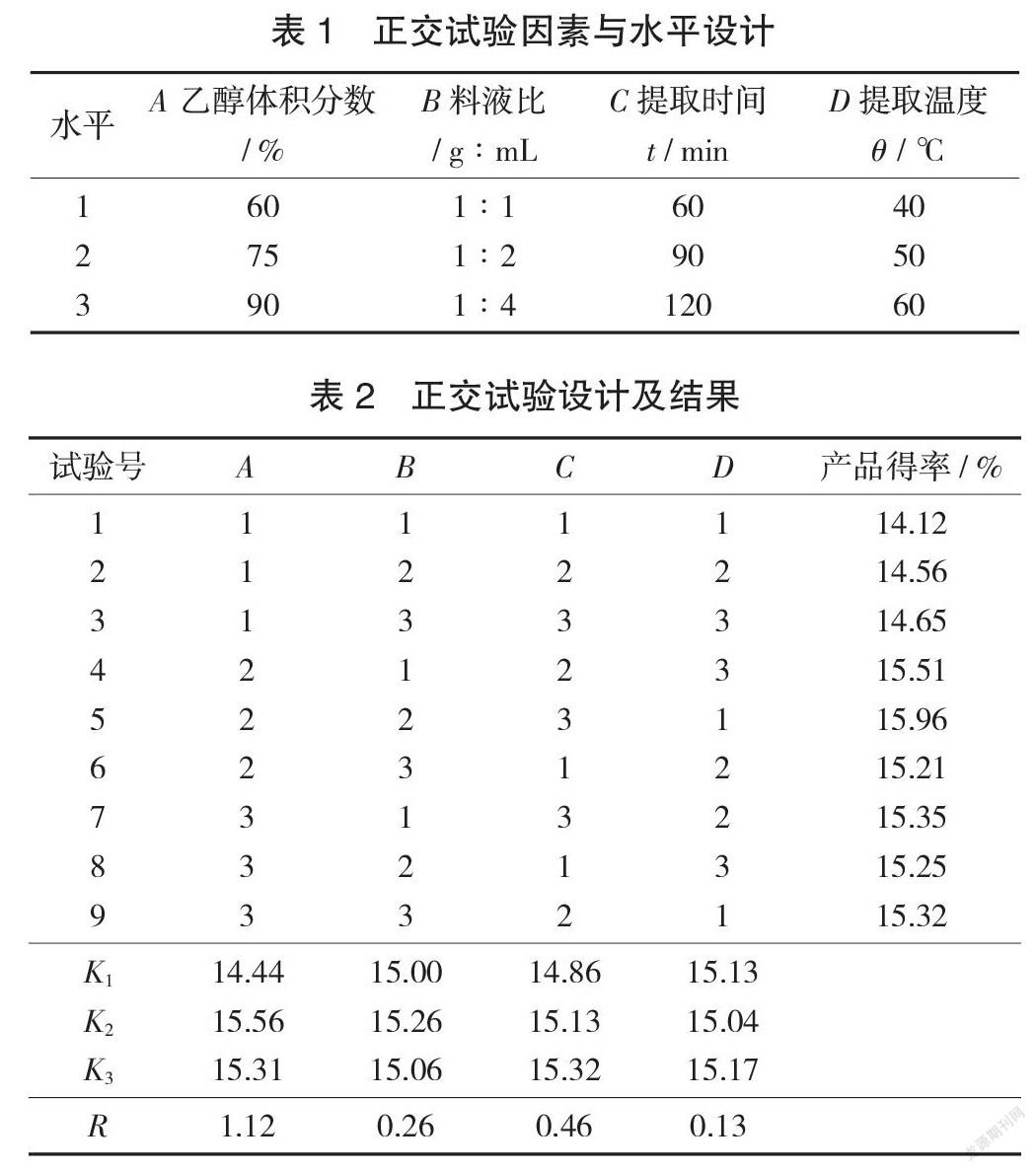
正交试验因素与水平设计见表1,正交试验设计及结果见表2。
从表2可以看出,在所考查的试验范围内,各因素对油茶皂苷得率影响主次顺序为乙醇体积分数>提取时间>料液比>提取温度,浸提的乙醇体积分数对油茶皂苷得率影响最大。根据正交试验,油茶皂苷提取的最佳工艺条件为A2B2C3D3,即乙醇体积分数为75%,料液比为1∶2,提取时间为120 min,提取温度为60 ℃。最优工艺条件下重复试验3次,油茶皂苷得率16.12%,纯度55.65%。
2.3 油茶皂苷提纯工艺的优化
油茶皂苷粗品含有大量的蛋白质、黄酮、单宁、多糖、色素等物质,影响产品的外观、品质和应用领域。试验对传统的油茶皂苷纯化工艺进行改进,采用絮凝沉淀和树脂吸附方法,研究适合油茶皂苷工业化提纯的途径。
2.3.1 絮凝除杂
壳聚搪是一种高分子絮凝剂,此步骤主要吸附油茶皂苷中的重金属、蛋白质、单宁等大分子物质[15-16]。
试验中,油茶皂苷粗品加水配置成质量分数3%水溶液,水溶液中加入10%体积的1%壳聚糖絮凝剂,水浴温度60 ℃,静置时间3 h,过滤。重复试验多次,杂质去除率为30%~40%,油茶皂苷损失率为6%~10%。
2.3.2 树脂吸附条件的分析
采用AB-8型大孔树脂对油茶皂苷溶液进行吸附纯化。AB-8型树脂物理化学性能稳定,不溶于酸、碱及有机溶剂,加热不熔,可在150 ℃以下使用。外观颜色淡白,给处理操作带来方便[17-20]。
试验中,将前步骤溶液上样,使用AB-8型大孔树脂进行吸附,控制上样速度为1.0 mL/min,选择合适吸附时间,用质量分数0.2%氢氧化钠溶液洗脱被吸附的杂质和色素,待洗出液变澄清后,用去离子水洗至中性。再用乙醇溶液进行洗脱,洗脱3个柱体积,收集此部分洗脱液。将洗脱液旋转蒸发除去乙醇并烘干得到高纯度油茶皂苷。
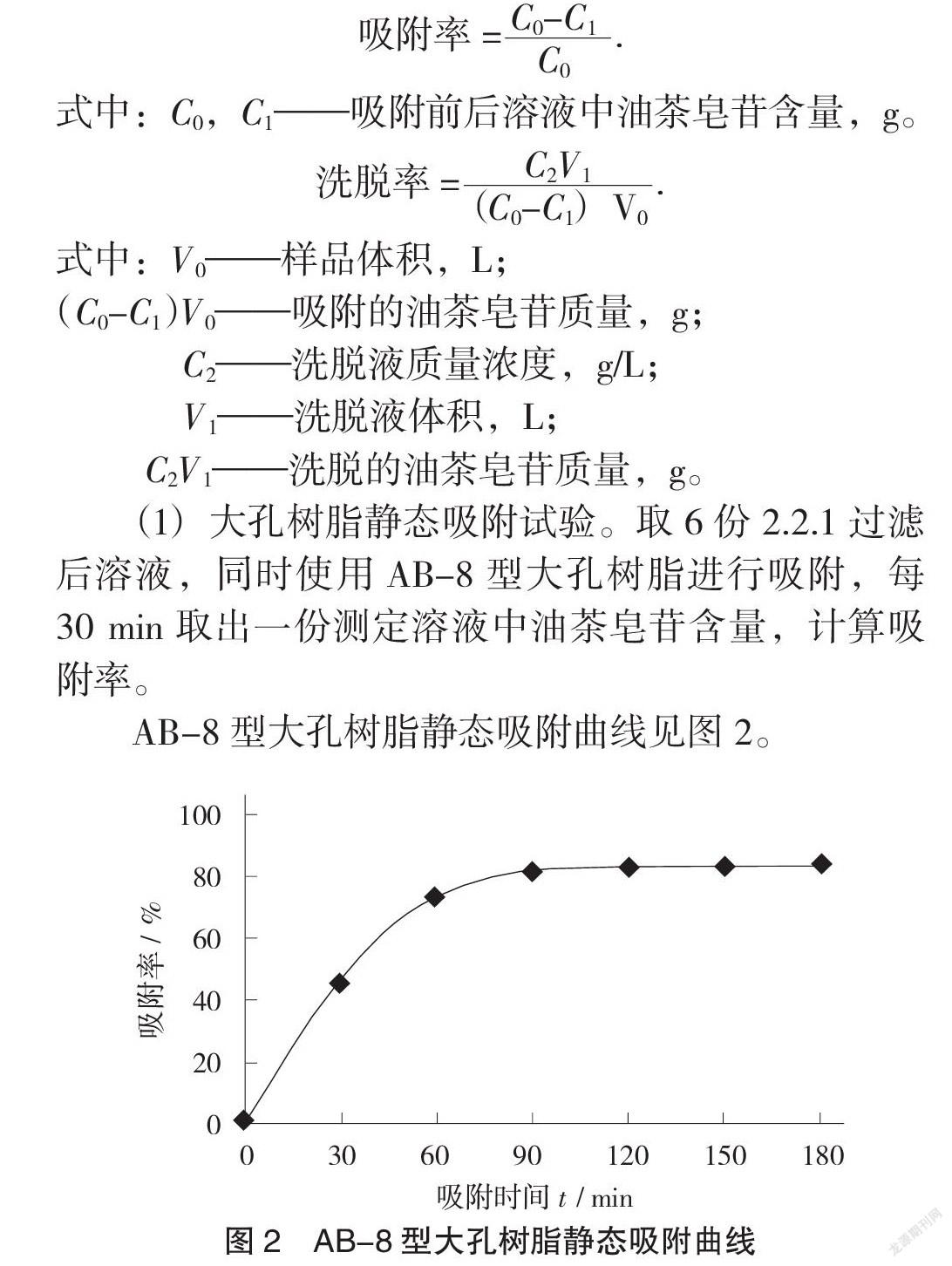
(1)大孔树脂静态吸附试验。取6份2.2.1过滤后溶液,同时使用AB-8型大孔树脂进行吸附,每30 min取出一份测定溶液中油茶皂苷含量,计算吸附率。
AB-8型大孔树脂静态吸附曲线见图2。
从图2可以看出,随着吸附时间的延长,AB-8 型大孔树脂的吸附容量在增加,前60 min吸附容量增加迅速,吸附90 min基本达到平衡状态,说明AB-8型大孔树脂对油茶皂苷具有良好的吸附效果,但吸附时间应不少于90 min。
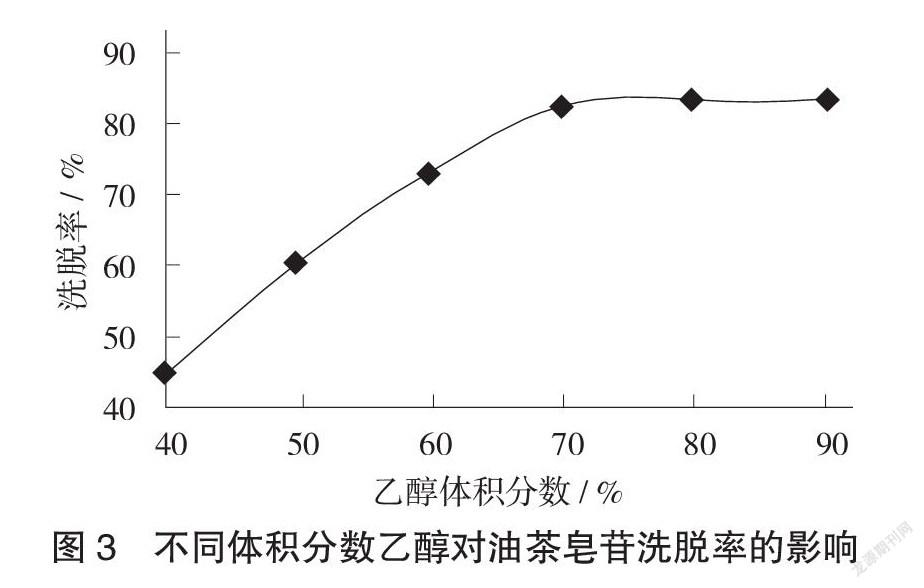
(2)洗脱剂体积分数的选择。分别用体积分数40%,50%,60%,70%,80%,90%的乙醇对吸附树脂进行洗脱。
不同体积分数乙醇对油茶皂苷洗脱率的影响见图3。
从图3可以看出,随着乙醇体积分数的增加,油茶皂苷的洗脱率也随之增加,70%乙醇与80%乙醇对油茶皂苷的洗脱率相当,考虑到实际使用成本,可以选择70%乙醇作为合适洗脱剂。
按2.3方法进行3次重复试验,按1.2.2方法进行检测,得到纯度85.36%,得率57.32%。
3 结论
(1)油茶皂苷提取试验中可以看到,在40~ 60 ℃区间内,提取温度对油茶皂苷得率影响较小,实际生产中,考虑到能耗要求,可对浸提温度具体调整。另外,提取时间的设置也要考虑到平转浸出器的转速等因素。
(2)实际生产可行的高纯度油茶皂苷制备路线为油茶饼粕→乙醇浸提→壳聚糖絮凝沉淀→AB-8型大孔树脂吸附→0.2%氢氧化钠溶液洗脱→70%乙醇溶液洗脱→喷雾干燥。工艺简便环保,产品纯度为80%以上,可广泛用于日用化工、食品工业、动物饲料等领域。
参考文献:
柳荣祥,朱全芬,夏春华. 茶皂素生物活性应用研究进展及发展趋势[J]. 茶叶科学,1996,16(2):81-86.
夏晓萍,郑彩虹,俸春红,等. 山茶属植物之山茶皂苷及其药理活性研究进展[J]. 茶叶科学,2011,31(5):391-398.
Murakami T,Nakmura J,Kageura T,et al. Bioactive saponins and glycosides. Xvii. Inhibitory effect on gastric emptying and accelerating effect on gastrointestinal transit of tea saponins:Structures of assamsaponins f,g,h,i, and j from the seeds and leaves of the tea plant[J]. Chem Pharm Bull,2000,48(11):1 720-1 725.
郝媛华,蒋林树. 茶皂素的生物学活性及其在动物生产中的应用研究进展[J]. 中国农学通报,2015,31(11):1-4.
宋昱,史丽颖. 山茶属植物的化学成分及药理活性研究[J]. 中国药房,2018,29(15):2 143-2 148.
Kobayashi K,Teruya T,Suenaga K,et al. Isotheasaponins b1-b3 from camellia sinensis var. Sinensis tea leaves[J]. Phytochemistry,2006,67(13):1 385-1 389.
Matsui Y,Kobayashi K,Masuda H,et al. Quantitative analysis of saponins in a tea-leaf extract and their antihypercholesterolemic activity[J]. Biosci Biotech Bioch,2009(7):1 513-1 519.
譚搏,曹福祥,赵莹. 油茶饼中茶皂素的定量分析[J]. 精细化工中间体,2009,39(2):67-69.
胡智明,叶有标,杨祖勇,等. SN/T 1852—2006 出口茶皂素中皂甙含量的测定[S]. 北京:中国标准出版社出版,2006.
傅春玲,洪奇华,阮晖,等. 茶皂素定量测定方法的研究[J]. 杭州大学学报(自然科学版),1997,24(3):239-243.
侯如燕,宛晓春,黄继轸. 油茶皂苷标准品的制备及定量方法的比较[J]. 食品与发酵工业,2005,31(8):62-65.
赵世光,薛正莲,杨超英,等. 茶皂素浸提条件优化及其抑菌效果[J]. 中国油脂,2010,35(5):64-67.
李敏,王承明. 油茶籽粕中茶皂素的提取工艺研究[J].中国粮油学报,2011,26(5):38-41.
石珊珊. 茶皂素提取并提纯工艺研究概述[J]. 粮食与食品工业,2019,29(3):25-29.
李永明,唐玉霖. 壳聚糖絮凝剂在水处理中的应有研究进展[J]. 水处理技术,2011,37(9):11-14.
刘尧刚,胡健华,周易枚. 壳聚糖对茶皂素水溶液絮凝工艺的研究[J]. 粮食与食品工业,2009,16(2):13-16.
张新富,朱翔,刘亚军,等. 油茶皂素大孔树脂纯化工艺优化及LC/TOF-MS分析[J]. 食品科学,2012,33(16):7-11.
徐德平,裘爱泳. 高纯度茶皂素的分离[J]. 中国油脂,2006,31(3):43-45.
顾姣,杨瑞金,谢斌,等. 大孔树脂纯化茶皂素及其产品性质研究[J]. 食品与机械,2017,33(6):153-158.
张海龙,张维农,蒋继丰,等. 茶皂素纯化方法的比较及其组分的鉴定[J]. 中国油脂,2015,40(11):94-98. ◇
