双吡啶酰腙Schiff碱Hg(Ⅱ)/Cd(Ⅱ)配合物的合成及其对甲醇蒸气的吸附
2020-09-10刘红娟魏小康朱必学
刘红娟 魏小康 易 瑞 黄 超 朱必学
(贵州大学大环及超分子化学重点实验室,贵阳 550025)
金属配合物由于其独特组装结构,在催化剂[1]、传感器[2]、气体吸附[3]、发光材料[4]、抗癌药物[5-6]和抗菌[7]等方面都有潜在的应用价值,因此一直以来都受到广泛的关注。含有吡啶基团的酰腙Schiff碱化合物,由于吡啶环上的氮原子的亲核能力很强,酰腙Schiff碱化合物易与不同的过渡金属离子以不同的配位模式作用,组装成结构新颖的酰腙Schiff碱配合物[8-13]。与此同时,过渡金属Hg(Ⅱ)和Cd(Ⅱ)都是对自然有害的金属元素,所以如何从混合体系中有效地提取和分离Hg(Ⅱ)和Cd(Ⅱ)一直是人们不断研究的方向[14-17]。我们设计、合成了一种含吡啶环的双酰腙类Schiff碱有机配体(L)[18],得到了配体L的晶体结构。再将配体L分别与氯化汞(HgCl2)和氯化镉(CdCl2)在甲醇和DMF的混合溶剂中进行配位作用,得到 2 个配位聚合物{[Cd(L)2Cl2]·2DMF·6H2O}n(1)和[Hg(L)Cl2]n(2),然后进一步考察配合物的热稳定性及其对甲醇蒸气的吸附性能。
1 实验部分
1.1 试剂与仪器
对叔丁基苯酚、六次甲基四胺、异烟肼、三氟乙酸、HgCl2、CdCl2以及其它所用试剂均为分析纯。
所用仪器有JEOL ECX 400 MHz核磁共振仪(TMS,DMSO-d6)、Vario EL Ⅱ型元素分析仪(德国)、MS(Angilent 1100)质谱仪、Ry-2型熔点仪(温度计未校正)、Bio-Rad型傅立叶红外光谱仪(4 000~400 cm-1)、Bruker Smart ApexⅡ晶体衍射仪和Micromeritics ASAP 2020型物理吸附仪。
1.2 配体与配合物的合成
配体L的合成路线如Scheme 1所示。
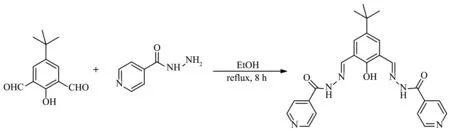
Scheme 1
1.2.1 配体L的合成
4-叔丁基-2,6-二甲酰基苯酚按照文献[19]的方法合成。称取0.42 g(2.0 mmol)4-叔丁基-2,6-二甲酰基苯酚于250 mL三口烧瓶中,加入50 mL无水乙醇,向反应液中加入0.68 g(4.96 mmol)异烟肼的无水乙醇溶液50 mL,回流反应8 h。冷却,抽滤,得到淡黄色固体。乙醇重结晶,抽滤,真空干燥得到亮黄色固体0.62 g。产率70.5%,m.p.226~227℃。1H NMR(DMSO-d6,400 MHz):δ1.30(s,9H,-CH3),7.77(s,2H,Ar-H),7.81,7.83(d,J=8.0 Hz,4H,Py-H),8.76(s,2H,-CH=N-),8.77,8.78(d,J=4.0 Hz,4H,Py-H),12.29(s,1H,-OH),12.37(s,2H,CONH)。ESI-MS:m/z=445.20[M+H]+。元素分析(%,按C25H28N6O4计算,括号内为计算值):C 63.03(63.01),H 5.94(5.92),N 17.61(17.64)。FT-IR(KBr pellet,cm-1):3 418(s),3 157(s),2 064(w),1 650(s),1 555(w),1 400(s),1 294(m),1 226(w),1 069(m),895(w),682(w),550(m)。
单晶培养:取少量配体L的固体产品溶解在CH3OH/DMF(8∶1,V/V)溶液中,室温静置3~5 d后,得到适合于X射线衍射测定的亮黄色块状晶体。
1.2.2 配合物1和2的合成
配合物1的合成:将CdCl2(18.3 mg,0.1 mmol)溶解在20 mL甲醇溶液中,将其缓慢滴加到40 mL配体(88.8 mg,0.2 mmol)的甲醇溶液中,然后再滴加6 mL的DMF,室温下搅拌0.5 h,过滤得到黄色溶液,2~3 d后得到适合于X射线衍射测定的黄色块状晶体。元素分析(%,按C54H62CdCl2N14O8·6H2O计算,括号内为计算值):C 48.87(48.89),H 5.65(5.62),N 14.76(14.78)。 FT-IR(KBr pellet,cm-1):3 438(s),3 165(s),2 060(w),1 637(s),1 400(s),1 284(m),1 223(w),1 073(m),558(m)。
配合物2的合成:将HgCl2(27.2 mg,0.1 mmol)溶解在20 mL甲醇溶液,将其缓慢滴加到20 mL配体(44.4 mg,0.1 mmol)的甲醇溶液中,然后再滴加5 mL的DMF,室温下搅拌0.5 h,过滤得到棕色溶液,3~4 d后得到适合于X射线衍射测定的棕色块状晶体。元素分析(%,按C24H24Cl2HgN6O3计算,括号内为计算值):C 40.28(40.26),H 3.35(3.38),N 11.72(11.74)。FT-IR(KBr pellet,cm-1):3 421(s),3 161(s),2 056(w),1 634(s),1 401(s),1 301(w),1 075(m),607(m)。
1.3 晶体结构的测定与解析
选择表面干净、透明无裂痕的大小为0.31 mm×0.21 mm×0.18 mm的配体、0.25 mm×0.22 mm×0.21 mm的配合物1和0.24 mm×0.23 mm×0.20 mm的配合物2的晶体,用Bruker Smart Apex单晶衍射仪,采用经石墨单色器单色化的MoKα射线(λ=0.071 073 nm),以φ-ω扫描方式收集单晶衍射数据,强度数据进行了经验吸收校正、Lp校正。晶体结构由直接法解得,对全部非氢原子坐标及其各向异性热参数进行了全矩阵最小二乘法修正。所有计算使用SHELX-2014程序完成[20-21](有关晶体学数据详见表1)。单晶结构解析揭示了配合物1中水分子高度无序,为了不影响结构精修结果,采用Platon/Squeeze程序将其滤去。
CCDC:1975243,L;1975244,1;1975245,2。
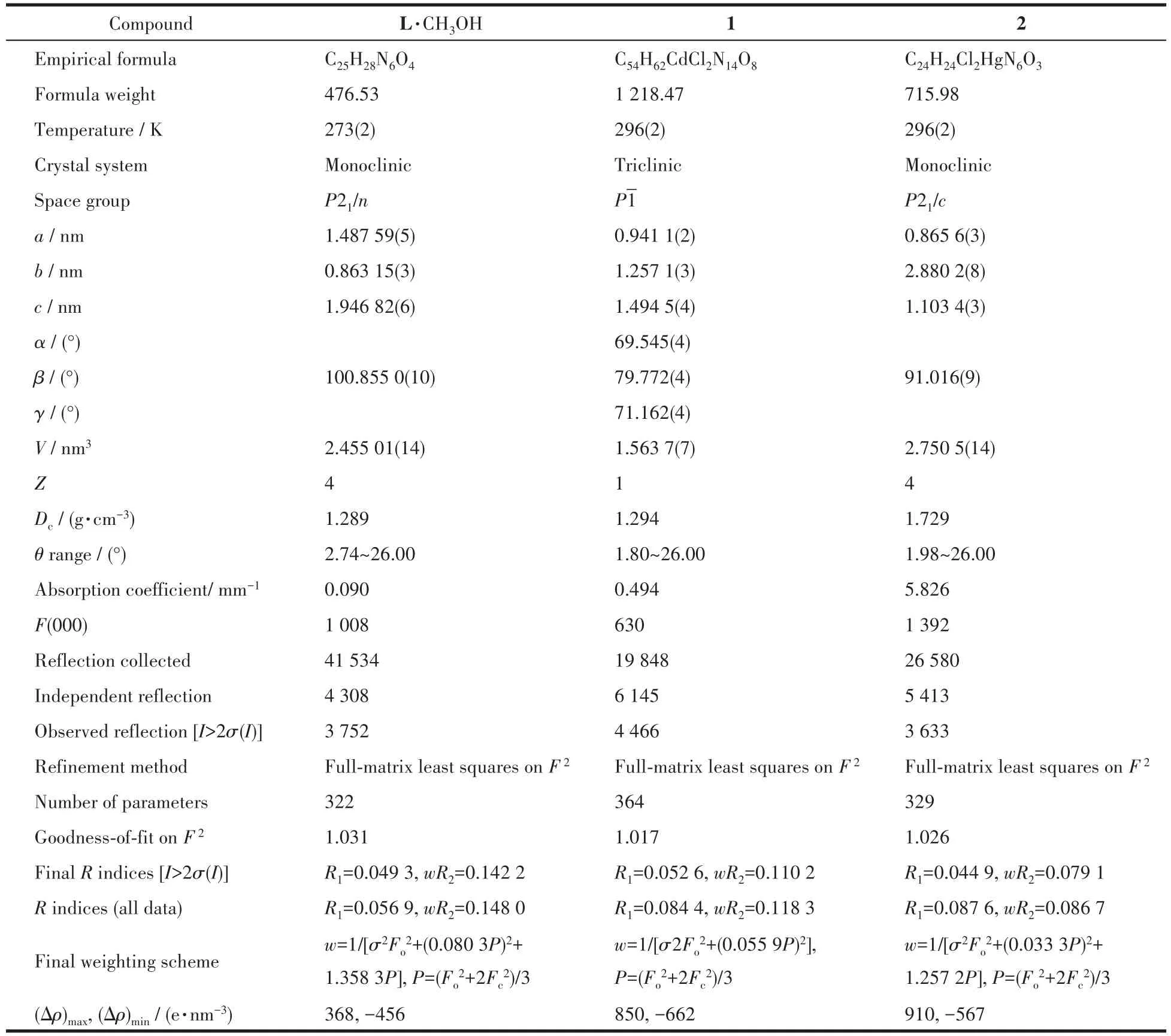
表1 配体L、配合物1和2的晶体学及结构修正数据Table 1 Crystal data and structure refinement for ligand L,complexes 1 and 2
2 结果与讨论
2.1 晶体结构描述
2.1.1 配体L的晶体结构
配体L呈稍微扭曲的“V”型结构(图1),位于中央酚环两臂的吡啶环与酚环不共面,吡啶环之间的二面角为148.2°。L的主要键长和键角列于表2。在L分子中,酚羟基质子与Schiff碱氮形成分子内O-H…N氢键(氢键参数见表3)。
2.1.2 配体L与Cd(Ⅱ)的配位结构与组装
配体L与Cd(Ⅱ)进行配位作用后,形成了配位聚合物1。在配合物1的不对称单元结构中(图2a),每个Cd(Ⅱ)分别与配体L分子的1个吡啶氮和1个氯离子配位。在配位聚合物1的结构中,每个Cd(Ⅱ)呈现为稍微扭曲的八面体配位构型,4个配位氮原子分别来自相邻的4个配体L的吡啶氮,2个氯离子在轴向配位,具有“V”形的2个配体L两端的吡啶氮原子分别与2个Cd(Ⅱ)桥联形成具有环状结构的亚单元,类似的环状亚单元通过Cd(Ⅱ)中心依次连接形成1D链状结构(图2b)。在每个环状亚单元中,2个DMF分子通过分子间氢键(N-H…O)作用位于环腔内,相邻的1D链之间通过轴向配体氯离子与相邻链中吡啶环碳(C4)上的质子形成分子间氢键作用组装为2D结构(图2c)。沿晶体c轴观察,发现这个2D结构具有孔槽,DMF分子填充在孔槽中(图2d)。相关氢键参数见表3。
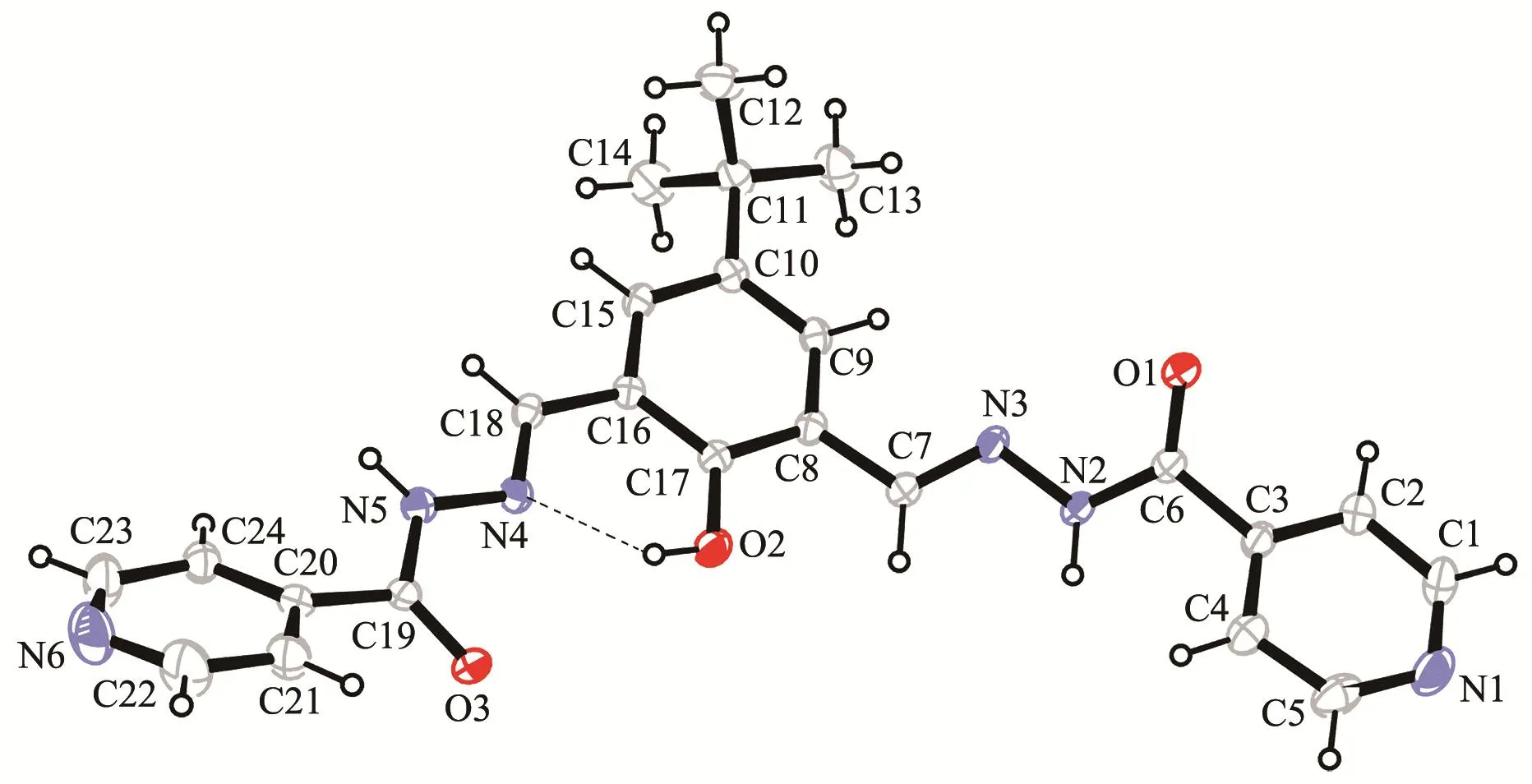
图1 配体L的分子结构Fig.1 Structure of ligand L
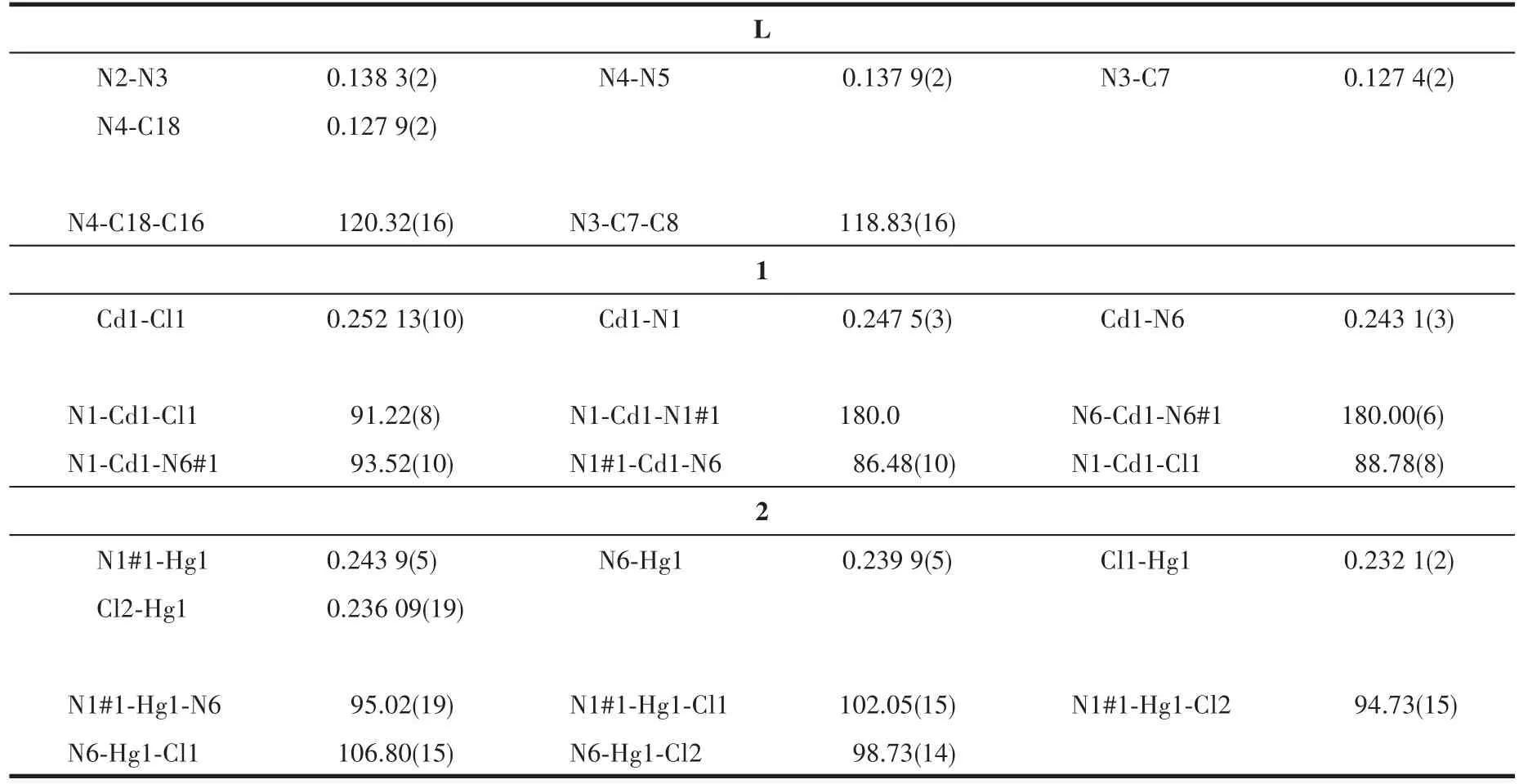
表2 配体L、配合物1和2的部分键长和键角Table 2 Selected bond lengths(nm)and bond angles(°)for ligand L,complexes 1 and 2
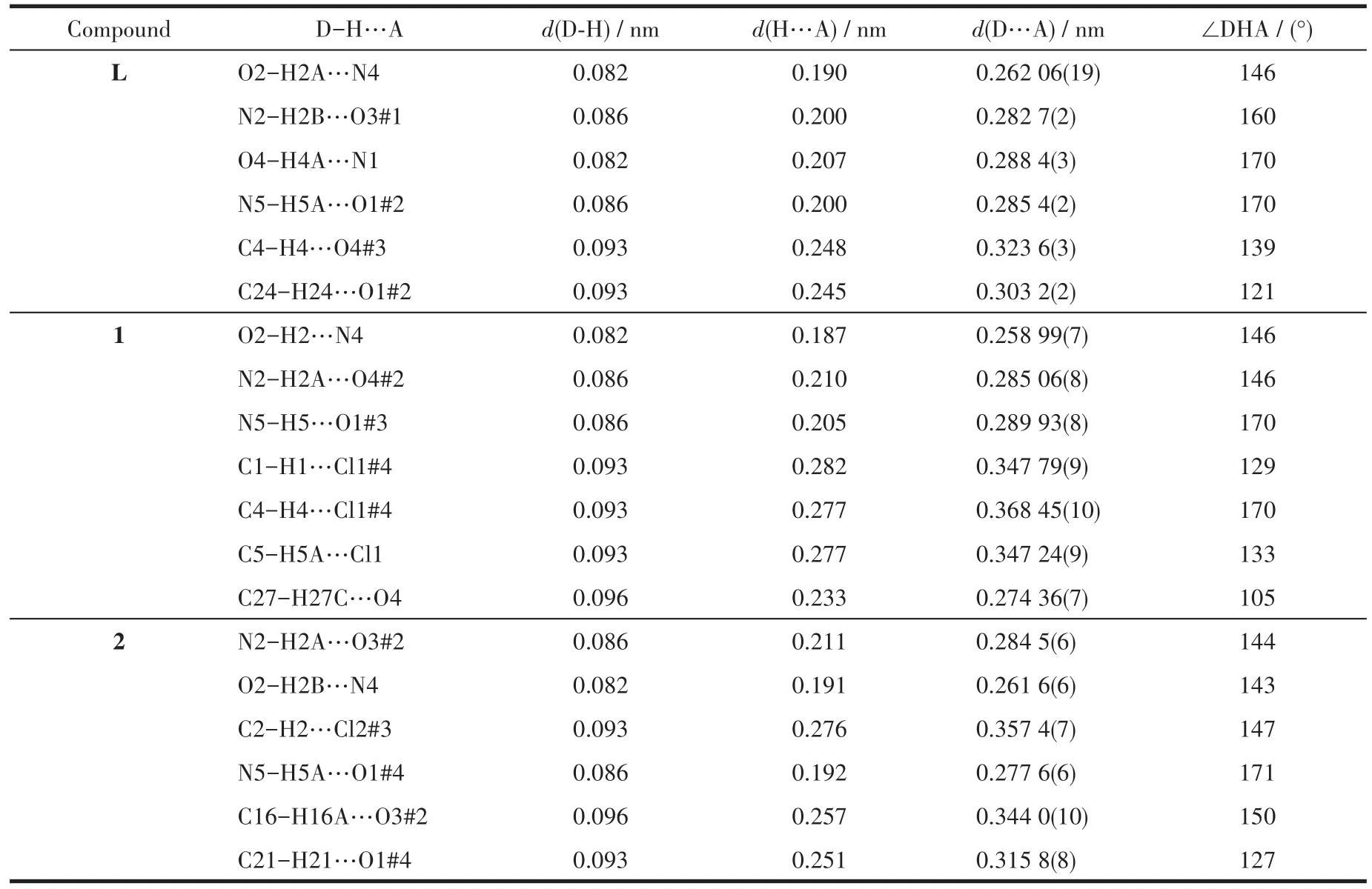
表3 配体L、配合物1和2的部分氢键参数Table 3 Selected hydrogen bond parameters for ligand L,complexes 1 and 2

图2 (a)配合物1的不对称单元椭球图(椭球概率为30%);(b)Cd(Ⅱ)连接的1D链结构;(c)相邻1D链之间通过分子间(C-H…Cl)氢键作用沿晶体a轴形成的2D结构;(d)DMF分子填充在配合物形成的1D孔道中Fig.2 (a)ORTEP view of the asymmetric unit of complex 1(probability of ellipsoid is 30%);(b)1D chain structure linked by Cd(Ⅱ);(c)2D network in 1 involving C-H…Cl hydrogen bonds along a axis;(d)DMF molecules filled in 1D channels formed by complex 1
2.1.3 配体L与Hg(Ⅱ)的配位结构与组装
配体(L)与Hg(Ⅱ)进行配位作用形成配位聚合物[Hg(L)Cl2]n(2)。在配位聚合物2的不对称单元结构中(图3a),每个Hg(Ⅱ)中心分别与配体L分子的1个吡啶氮和2个轴向的氯配位。在配位聚合物结构中(图3b),每个Hg(Ⅱ)呈现为扭曲的四面体配位构型,4个配位原子中2个氮原子分别来自相邻的2个配体L,2个为氯离子,具有“V”形结构的配体L依次通过Hg(Ⅱ)配位连接形成1D“之”字螺旋链。相邻的1D“之”字链间通过配位氯离子与相邻链中吡啶环碳(C2)质子之间形成的C-H…Cl氢键组装,形成非互穿的层状结构(图3c和3d)。氢键参数见表3。

图3 (a)配合物2的不对称单元结构(椭球概率为30%);(b)Hg(Ⅱ)连接L形成的1D螺旋链;(c)1D链之间的分子间(C-H…Cl)氢键作用;(d)组装形成非互穿的3D层状结构Fig.3 (a)Ortep view of the asymmetric unit of the complex 2(probability of ellipsoid is 30%);(b)1D chain structure linked by Hg(Ⅱ);(c)Intermolecular hydrogen bonding(C-H…Cl)between 1D chains;(d)Assembled non-interpenetrating 3D layered structure
2.2 配合物的热稳定性
以10℃·min-1的升温速率,在N2气氛下于室温到800℃范围内测试了配合物1和2的热稳定性(图4)。配合物1从受热后便持续失重19.32%,推测其与配合物结构中的溶剂分子(结晶水和DMF分子,理论值19.16%)失去有关。此后持续快速失重。配合物2的失重情况和配合物1的不同,在260℃以下基本保持稳定;260~360℃快速失重64.41%,可能与失去配体中的吡啶基片段以及氯化汞的气化有关;至800℃时残重为12.77%。结果表明,配合物2的热稳定性比配合物1的热稳定性好。
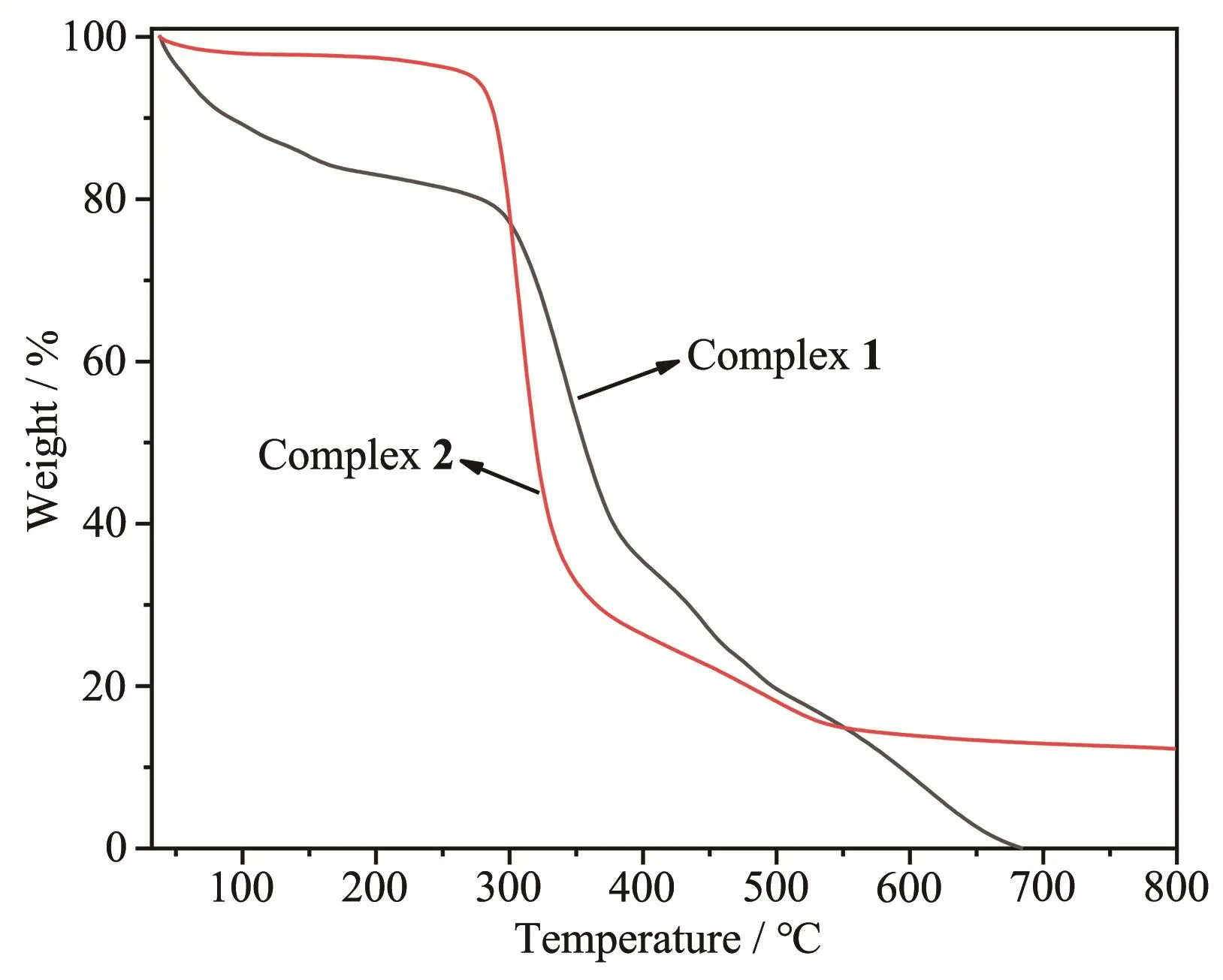
图4 配合物1和2的TG曲线Fig.4 TG curves of complexes 1 and 2
2.3 配合物对甲醇蒸气的吸附性能研究
由于配合物1和2的组装体具有不同的孔道结构,在其孔道或层间孔隙中,可能容纳一定尺寸的小分子,因此在室温(25℃)下分别研究了2个配合物对甲醇蒸气分子的吸附性能,结果见图5。测得配合物1的BET比表面积为219 m2·g-1。随着相对压力的增加,吸附量逐渐增多,配合物1对甲醇蒸气的最大吸附量为5.94 mmol·g-1。测得配合物2的BET比表面积为71 m2·g-1,配合物2对甲醇蒸气的最大的吸附量达到2.70 mmol·g-1。从配合物1和配合物2对甲醇蒸气的吸附性能结果可以看出,配合物1和配合物2对甲醇蒸气都具有很好的吸附效果,但是配合物1对甲醇蒸气的最大吸附量大约是配合物2的2倍。导致这个结果的因素可能是因为2个配合物的组装结构不同,配合物1形成的空腔尺寸明显比化合物2的大很多,配合物1形成的菱形孔道使得配合物1能够吸附更多的甲醇蒸气分子。
3 结 论
合成及表征了一种双吡啶酰腙类Schiff碱有机配体(L),并通过溶剂挥发法制备得到2个金属配合物。晶体结构解析表明2个配合物均为一维链状聚合物,进一步考察了2个配合物的热稳定性及其对甲醇蒸气的吸附性能,结果表明配合物2相对1具有更好的热稳定性,而配合物1中形成的菱形孔道使其具有较好的甲醇蒸气吸附能力。
