无刺枸骨果实化学成分及其抗氧化和抑菌活性研究
2020-09-09佘新松翟大才胡宗浩滕芸芸朱雯培李士壮柏晓辉
佘新松,翟大才,胡宗浩,滕芸芸,朱雯培,李士壮,柏晓辉
(黄山学院生命与环境科学学院,安徽 黄山 245041)
无刺枸骨(Ilex cornutavar.fortunei),是冬青属(IlexL.)植物枸骨(Ilex cornutaLindl. et Paxt.)的自然变种,是一种常绿小乔木或灌木,其叶形奇特,球形核果入秋成熟转红,鲜艳夺目,是一种良好的观赏树种[1]。枸骨在我国长江下游各省均有分布,且其根、树皮、叶与果实等均可入药,具有益肾、活络强筋等功效,可用于治疗风湿性关节酸痛、腰肌劳损等病症[2]。此外,有文献报道,无刺枸骨具有降血脂、抗生育和抑菌等作用[3],但具体作用机制不明。
目前,关于无刺枸骨的研究主要集中在无刺枸骨快速繁殖与扦插技术[4-5]、嫁接与造型技术[6],无刺枸骨叶片结构对环境温度的适应[7]、枸骨和无刺枸骨不同光强下光合能力比较[8],无刺枸骨不同部位齐墩果酸和熊果酸的含量分析[1]及果实总黄酮的提取及稳定性研究[3]等,对无刺枸骨果实化学成分的研究较少,而对其果实抗氧化和抑菌活性研究仍处于空白阶段。本文以无刺枸骨果实为对象,采用多种极性不同的溶剂分别对其果实的活性物质进行萃取,并采用2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)和1,1-二苯基-2-三硝基苯肼(DPPH)法、滤纸片抑菌法检测其活性物质的抗氧化活性与抑菌活性;同时结合GC-MS(气相色谱-质谱联用)技术对抗氧化及抑菌活性显著的正丁醇萃取物化学组成进行分析鉴定,以期为无刺枸骨果实资源的综合利用与开发提供数据支持。
1 材料与方法
1.1 试剂与材料
1.1.1 仪器设备 高压蒸汽灭菌锅(SQ510C型,重庆雅马拓科技公司)、恒温培养箱(ZGP-2 050型,上海智城分析仪器公司)、超净工作台(ZHJH-C1106B型,上海智城分析仪器公司)、紫外可见分光光度计(UV754N型,上海精密科学仪器公司)、气相色谱-质谱联用仪(Agilent 7 890 A-5 975C型,美国Agilent公司)。
1.1.2 试剂 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)与1,1-二苯基-2-三硝基苯肼(DPPH)购于东京化成株式会社,均为分析纯;无水乙醇、甲醇、正丁醇、乙酸乙酯、石油醚、过硫酸钾等试剂购于上海国药集团,均为分析纯;酵母提取物、蛋白胨、琼脂粉和维生素C等生化试剂购于上海生工有限公司。
1.1.3 实验材料 实验所用的无刺枸骨成熟期果实(凭证标本采集号-03;采集人:佘新松;鉴定人:方建新;采集地点:安徽屯溪;采集时间:2019年12月4日)采集于黄山学院校园内。
本文抑菌实验所用菌株为枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)、绿脓杆菌(Pseudomonas aeruginosa)、鼠伤寒沙门氏菌(Salmonella typhimurium)和变形杆菌(Proteusbacillus vulgaris),以上菌株保存于黄山学院微生物学实验中心且均购自于中国典型培养物保藏中心。抑菌实验所用固体培养基为LB(Luria-Bertani)平板培养基,其配制方法参考文献[9]。
1.2 实验方法
1.2.1 无刺枸骨果实成分的提取 将采集的新鲜无刺枸骨果实去果梗后粉碎至糊状,称取20.0 g糊状果实于500 mL圆底烧瓶中,加入200 mL甲醇并于60 ℃恒温萃取3 h;过滤后收集上清液,并向滤渣中再加入新甲醇200 mL后重复提取2次;将3次提取液合并后于旋转蒸发仪内60 ℃真空蒸干得到甲醇粗提物,收集并称质量后用100 mL双蒸水重悬甲醇粗提物,再按1:1等体积比依次加入100 mL正丁醇、乙酸乙酯和石油醚进行萃取,各萃取溶剂分别重复3次,收集300 mL各萃取相溶剂后于旋转蒸发仪内60 ℃减压旋干并称质量;最后用无水乙醇分别将上述萃取物配制成10 mg·mL-1溶液,保存于4℃冰箱备用。
1.2.2 无刺枸骨果实萃取物对ABTS自由基的清除能力 参考文献[10]方法检测并改进无刺枸骨果实萃取物清除ABTS自由基的能力,方法如下:按体积比1∶1分别移取2.45 mmol·L-1K2S2O8溶液与7 mmol·L-1ABTS溶液混匀并避光反应12 h;用甲醇将反应后ABTS液稀释至λ734nm吸光值为0.68~0.72待用。分别移取无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯和石油醚萃取物不同浓度溶液200 μL于2 mL上述甲醇稀释后的ABTS溶液中,混匀后于暗处室温反应6 min测其吸光值Ax。以相同方法测定200 μL甲醇与2 mL反应后的ABTS溶液反应后的吸光值A0;同时,测定100 μL不同浓度的无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯和石油醚萃取物溶液与2 mL甲醇反应后的吸光值Ay,每组重复测定3次。以Vc为阳性对照,采用上述方法测定其清除ABTS自由基的能力,重复3次。按公式(1)计算清除ABTS自由基的清除率(Y),取其平均值进行分析。

1.2.3 无刺枸骨果实萃取物对DPPH自由基的清除能力 参考文献[11]方法并适当改善检测无刺枸骨果实萃取物清除DPPH自由基的能力,方法如下:分别移取经无水乙醇稀释的无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯和石油醚萃取物溶液100 μL于0.06 mmol·L-1DPPH-乙醇(95%)溶液中配制成一系列不同浓度的溶液,混匀并避光反应20 min后于λ517nm处测定吸光值Bx。同时,吸取100 μL无水乙醇至DPPH-乙醇(95%)溶液中作为对照组,测定其吸光值B0。以Vc为阳性对照,采用上述方法测定其清除DPPH自由基的能力,重复3次。按公式(2)计算清除DPPH自由基的清除率(Z),取平均值进行分析。
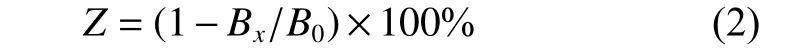
1.2.4 无刺枸骨果实萃取物的抑菌活性 参考文献[9]方法检测无刺枸骨果实萃取物对不同受试菌的抑菌活性,方法如下:将活化后的受试菌枯草芽孢杆菌、金黄色葡萄球菌、绿脓杆菌、鼠伤寒沙门氏菌和变形杆菌培养至λ600nm处吸光值为0.25~0.35,吸取100 μL上述菌液于LB固体培养基上涂布均匀,放置直径6 mm无菌滤纸片,分别吸取10 μL无刺枸骨果实甲醇粗提物的正丁醇、乙酸乙酯和石油醚萃取物滴加于纸片中央;以无水乙醇为空白对照,将以上LB固体培养基于37℃恒温培养12 h,测量并记录抑菌圈的大小,重复3次,以其均值进行分析。
1.2.5 无刺枸骨果实正丁醇萃取物GC-MS分析依据文献[12-13]的方法并改进,采用HP-5 MS石英毛细管柱(30 m×250 μm×0.25 μm)为色谱柱对无刺枸骨果实甲醇粗提取物的正丁醇萃取物进行GC-MS分析,萃取物进样量为0.5 μL;以纯度99.999 %氦气作为载气,流速设置为1.0 mL·min-1;柱箱采取程序梯度升温:起始温度设置为50℃,先以4℃·min-1速率升至150℃后保持1 min,再以1℃·min-1速率升至220℃后维持1 min,最后以3℃·min-1速率升至260℃后维持5 min,共运行50 min。
采用电子轰击(EI)离子源,70 eV电子能量;设置离子源为230℃,四极杆为150℃;扫描质量数范围m/z为50.0~500.0,质谱数据库选择为标准谱库NIST08。
1.2.6 无刺枸骨果实正丁醇萃取物UPLC-Q-TOF/MS分析 参考文献[14-16]中的方法并适当修改测定正丁醇萃取物的成分,具体参数简述如下:取1 μL待测样品注入UPLC仪器中,设置流速为0.3 mL·min-1;采用ACQUITY HSS T3(2.1 mm×100 mm,1.8 μm)色谱柱,柱温恒定为30℃;流动相分别为0.1%甲醇水溶液(A)和乙腈(B);洗脱程序设置为:0~10 min,5% B;10~20 min,20% B;20~28 min,40% B;28~38 min,60%B;38~43 min,100% B;43~46 min,100% B;46~50 min,5% B。采用电喷雾离子源(ESI),正离子模式;离子源温度设为100℃,脱溶剂气(N2)温度为400℃;毛细管电压设为2.0 kV,锥孔电压为40 V;锥孔气(N2)流量设为50 L·h-1;利用氩气作为碰撞气,碰撞能量为6 V和20~30 V。
2 结果与分析
2.1 无刺枸骨果实萃取物的抗氧化活性
2.1.1 无刺枸骨果实萃取物对ABTS自由基的清除作用 将无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯和石油醚等萃取物稀释为一系列浓度梯度,检测其对ABTS自由基的清除作用。图1表明:无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯与石油醚萃取物对ABTS自由基的清除作用均与萃取物浓度呈正相关,即ABTS自由基清除率随萃取物浓度增加而增大,当正丁醇、乙酸乙酯、石油醚萃取物浓度分别为0.075、0.125、0.625 mg·mL-1时,对ABTS自由基清除率分别为99.68%、99.95%、53.21%。阳性对照Vc浓度(X)与ABTS自由基清除率(Y)的线性回归方程为:Y=20 783.00X+5.94 (R2=0.971 1)。无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯、石油醚萃取物及Vc对ABTS自由基清除作用的ED50值分别为0.033 6、0.054 0、0.559 1、0.002 1 mg·mL-1。
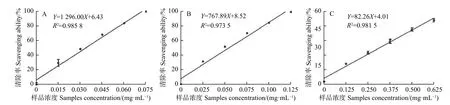
图1 无刺枸骨果实甲醇粗提取物的正丁醇(A)、乙酸乙酯(B和石油醚(C)萃取物对ABTS自由基的清除作用。Fig. 1 Free radical scavenging assays of the 1-butanol (A), ethyl acetate (B), and petroleum ether (C) extraction from the crude methanol extract of the fructus of I. cornuta var fortunei against ABTS
2.1.2 无刺枸骨果实萃取物对DPPH自由基的清除作用 分别取无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯和石油醚等萃取物稀释为一系列梯度,检测其对DPPH自由基的清除作用。图2可知:无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯与石油醚萃取物对DPPH自由基的清除作用均与萃取物浓度呈正相关,且随着萃取物浓度增加,DPPH清除率显著增大。当正丁醇、乙酸乙酯、石油醚萃取物浓度分别为0.125、0.25、1.25 mg·mL-1时,对DPPH自由基清除率分别为90.83%、98.15%、75.50%。阳性对照Vc浓度(X)与DPPH自由基清除率(Y)的线性回归方程为:Y=18 986.00X+4.49 (R2=0.987 3)。无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯、石油醚萃取物及Vc对ABTS自由基清除作用的ED50值分别为0.054 3、0.096 4、0.774 1、0.002 4 mg·mL-1。
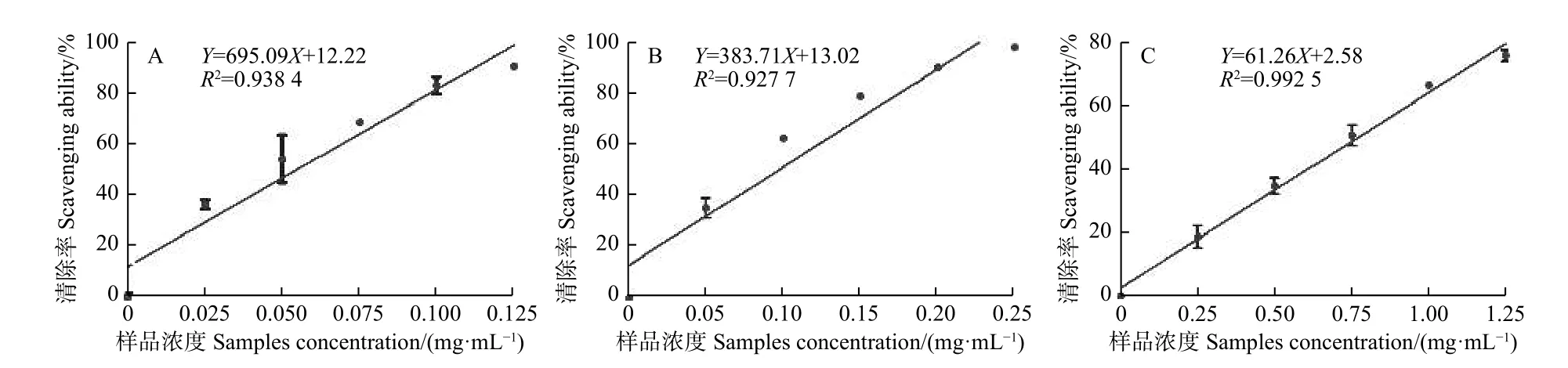
图2 无刺枸骨果实甲醇粗提取物的正丁醇(A)、乙酸乙酯(B和石油醚(C)萃取物对DPPH自由基的清除作用Fig. 2 Free radical scavenging assays of the 1-butanol (A), ethyl acetate (B), and petroleum ether (C) extraction from the crude methanol extract of of the fructus of I. cornuta var fortunei against DPPH
2.2 无刺枸骨果实萃取物的抑菌作用
以滤纸片抑菌法检测无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯和石油醚萃取物对枯草芽孢杆菌、金黄色葡萄球菌、绿脓杆菌、鼠伤寒沙门氏菌与变形杆菌的抑菌活性。图3结果表明:正丁醇、乙酸乙酯和石油醚萃取物对上述5种受试菌均有抑制作用。与对照乙醇相比,正丁醇萃取物的抑菌效果最显著,对5种受试菌的抑制作用顺序为:鼠伤寒沙门氏菌>变形杆菌>枯草芽孢杆菌>绿脓杆菌>金黄色葡萄球菌,抑菌圈减去同条件下乙醇对照的均值分别为6.20、5.15、4.24、3.45、3.24 mm;乙酸乙酯萃取物对枯草芽孢杆菌、鼠伤寒沙门氏菌和变形杆菌有显著抑制作用,对金黄色葡萄球菌与绿脓杆菌无显著抑制作用;石油醚萃取物对枯草芽孢杆菌、鼠伤寒沙门氏菌、金黄色葡萄球菌有显著抑制作用,对绿脓杆菌和变形杆菌无显著的抑制作用。
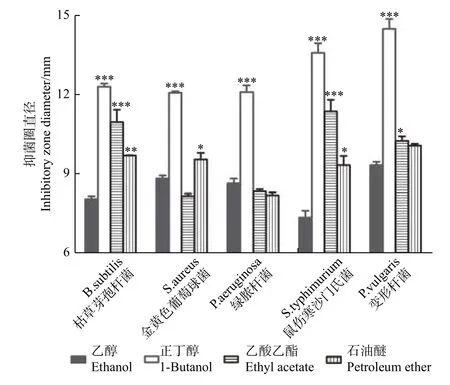
图3 无刺枸骨果实萃取物对不同受试菌的抑菌作用Fig. 3 Antibacterial activity of the solvent extraction of the fructus of I. cornuta var fortunei against the different tested bacteria

图4 无刺枸骨果实甲醇粗提取物的正丁醇萃取物GC-MS总离子流Fig. 4 The total ion chromatogram of the 1-butanol extraction from the crude methanol extract of the fructus of I. cornuta var fortunei by GC-MS
2.3 无刺枸骨果实甲醇粗提取物的正丁醇萃取物化学成分分析
2.3.1 无刺枸骨果实甲醇粗提物的正丁醇萃取物GC-MS分析 无刺枸骨果实甲醇粗提取物的正丁醇萃取物抗氧化活性和抑菌效果最好,故采用GCMS技术对其进行化学组成分析,总离子流结果见图4。通过与标准谱库NIST08的质谱峰比对分析,结合峰面积归一法分析其各组分的相对含量(表1)。由图4和表1可知:无刺枸骨果实甲醇粗提取物的正丁醇萃取物中共分离出色谱峰35个,经鉴定后得到14个化合物(表1),占正丁醇萃取物总量的83.15%,其相对含量高于1.00%的化合物依次为N1-(叔丁基)-2-(2-[2-[(叔丁基氨基)碳硫基]肼基]亚乙基)肼-1-碳硫酰胺(48.63%)、丁醛二丁基乙缩醛(25.53%)、1-丁氧基-2-乙基-1-己烯(2.37%)、丁酸丁酯(1.67%)和丙位癸内酯(1.04%),这5种组分占总化合物的79.24%。

表1 无刺枸骨果实甲醇粗提取物的正丁醇萃取物的GC-MS鉴定结果Table 1 The chemical constituents of the 1-butanol extraction from the crude methanol extract of the fructus of I. cornuta var fortunei by GC-MS
2.3.2 无刺枸骨果实甲醇粗提物的正丁醇萃取物UPLC-Q-TOF/MS分析 利用UPLC-Q-TOF/MS同时对无刺枸骨果实甲醇粗提取物的正丁醇萃取物化学组成进行定性分析,其总离子流结果见图5,推测和鉴定出化合物共10种(表2)。从表2可知:鉴定出的10种化合物含有2种乙酰腈、2种酯类、3种羧酸、2种酮类和1种酰胺。

图5 无刺枸骨果实甲醇粗提取物的正丁醇萃取物UPLCQ-TOF/MS总离子流Fig. 5 The total ion chromatogram of the 1-butanol extraction from the crude methanol extract of the fructus of I. cornuta var fortunei by UPLC-Q-TOF/MS
3 讨论
现有研究表明,枸骨具有降血脂、抗生育和抑菌等作用[3],但具体药用分子不明。为探究无刺枸骨成熟果实中的药效分子,本文首次利用不同极性的有机溶剂正丁醇、乙酸乙酯和石油醚等溶剂对其生物活性成分进行萃取,并证明其萃取物具有非常好的抗氧化性;同时,发现其抗氧化活性较好的成分主要富集在正丁醇相中。利用抑菌试验,本文证明无刺枸骨果实成分具有较好的抑菌活性,这与现有的报道相吻合[3]。通过比较正丁醇、乙酸乙酯和石油醚萃取物的抑菌活性可发现,抑菌活性较好的生物活性成分也富集在正丁醇萃取物中,但具体的生物活性分子不明。

表2 无刺枸骨果实甲醇粗提取物的正丁醇萃取物的UPLC-Q-TOF/MS鉴定结果Table 2 The chemical constituents of the 1-butanol extraction from the crude methanol extract of the fructus of I. cornuta var fortunei by UPLC-Q-TOF/MS
采用GC-MS与UPLC-Q-TOF/MS技术对正丁醇萃取物进行分析,发现无刺枸骨果实中存在化合物(1S,3R,4R,5R)-3-((3-(3,4-二羟基苯基)丙烯酰)氧代)-1,4,5-三羟基环己羧酸,该化合物又称为绿原酸[17]。现有研究表明,绿原酸是很多药材和中成药具有消炎利胆、抗菌解毒的主要药效分子[17];其具有很强的清除DPPH自由基能力,也具有显著的抗菌、抗病毒作用[17]。因此,正丁醇萃取物具有很强的抗氧化和抑菌活性可能与其含有绿原酸有关。同时,UPLC-Q-TOF/MS数据显示,无刺枸骨果实甲醇粗提取物的正丁醇萃取物中的化合物比较多,值得进一步发掘。
4 结论
通过测定无刺枸骨果实甲醇粗提取物的正丁醇、乙酸乙酯和石油醚萃取物对ABTS和DPPH自由基的清除能力,发现萃取物均有较好的抗氧化性,其中,正丁醇萃取物的抗氧化能力最好。抑菌试验表明,以上3种萃取物的抑菌能力为正丁醇>乙酸乙酯>石油醚。通过GC-MS和UPLC-QTOF/MS技术对正丁醇萃取物成分的分析,本文首次报道绿原酸是无刺枸骨果实的重要药效分子,这为无刺枸骨果实的综合开发与利用提供了数据支持。
